抑癌基因PTEN与可变剪接相关性研究的重大发现
前体mRNA的可变剪切与肿瘤密切相关,然而可变剪切与致癌基因以及抑癌因子之间的关系还仍不明确。2018年6月,上海交通大学细胞分化和凋亡教育部重点实验室沈少明博士和上海生命科学研究院健康科学研究所冀颜博士为论文第一作者在《Nature Communication》(IF=12.353)发表了题为“Nuclear PTEN safeguards pre-mRNA splicing to link Golgi apparatus for its tumor suppressive role.”的文章,报道了存在于细胞核内PTEN蛋白通过与mRNA剪接体相互作用,调控pre-mRNA的可变剪接,进而干预高尔基体的伸展和分泌,从而发挥其肿瘤抑制作用。
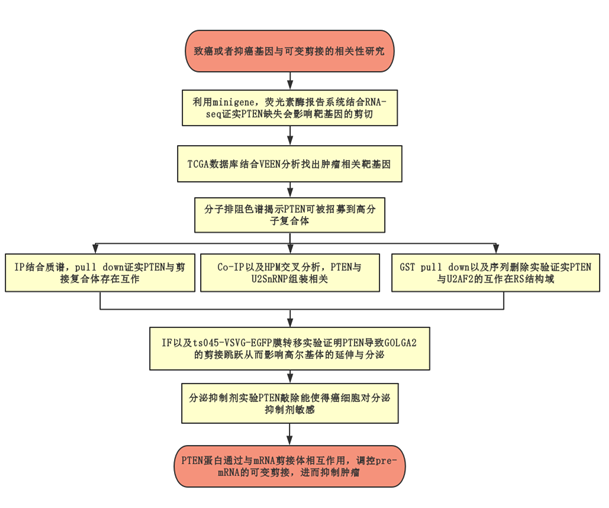
技术路线
结果
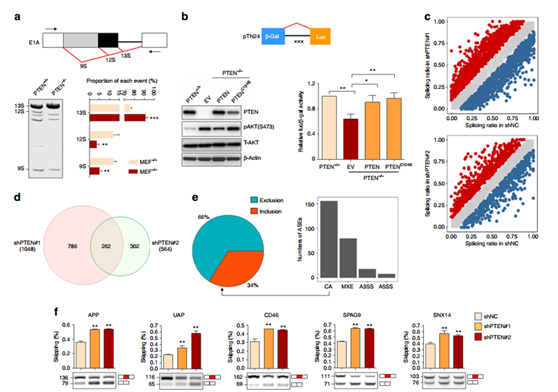
图1 PTEN调节整体的可变剪切。
构建pMTE1A minigene或者 pTN24荧光素酶报告基因,并将其转入到PTEN+/+ 以及PTEN-/-小鼠胚胎成纤维(MEF) 细胞中,均证明PTEN的缺失会影响剪切事件(a, b);利用shRNA干扰PTEN的表达后通过RNA-seq检测与对照组相比检测下游靶基因的变化,262 可变剪接事件(ASEs) 代表 208 人类基因被检测出来,并且通过RT-PCR得以验证。
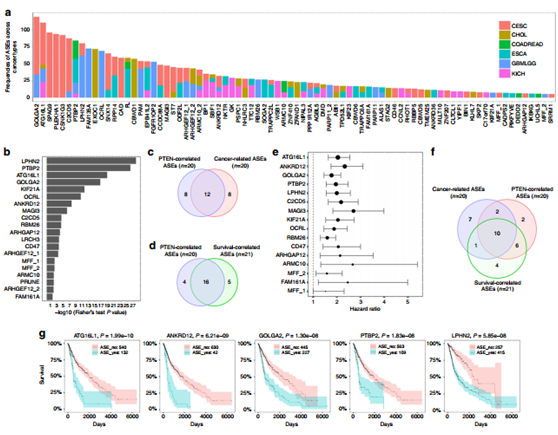
图2 PTEN调节的 ASEs在肿瘤中得以证实。
利用TCGA数据库分析,发现上述的262个基因绝大多数与肿瘤有关,其中我们挑出与胶质母细胞瘤 (GBMLGG)相关的20个基因(a, b);12个基因与肿瘤以及ASEs均相关,16个与病人的生存具有相关性(c, d),三者交叉共有10个基因被挑选出来做进一步研究(e,f);在PTEN缺失与野生型的胶质母细胞瘤细胞中证实了GOLGA2, KIF21A ,C2CD5的表达。

图3 核PTEN 与剪接复合体蛋白相互作用。
293T细胞的核提取物进行尺寸排阻色谱分析得到了PTEN可能被招募到高分子的复合体(a)免疫沉淀结合LC-MS/MS鉴定到136个与核PTEN相互作用的蛋白质(b),KEGG 分析得到38个属于剪接体的组成成分(c)。通过细胞核质分离并结合co-IP以及pull-down实验证实了核PTEN与剪接体蛋白紧密结合并且调控剪接体组装(e,d,f)。
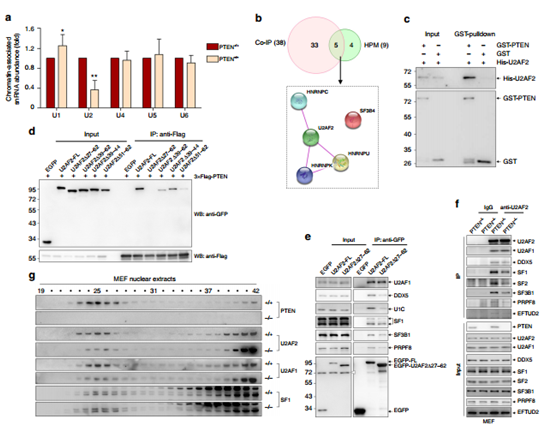
图4 PTEN能够与剪接体蛋白U2AF2的RS结构域直接相互作用。
利用qRT-PCR检测到 U2 与MEF细胞中PTEN的缺失有关(a)揭示了PTEN可能与U2 snRNP复合物的组装有关;co-IP 以及HPM 的交叉分析,并通过String database得到剪接复合体的互作网络GST-标签的 PTEN 蛋白与His-标签的U2AF2共孵育进行GST pulldown实验证实两者的互作(c)删除aa27–62, 精氨酸U2AF2丝氨酸富富集的区域(RS) 能调节U2AF2–PTEN 相互作用(d) 并且在PTEN+/+ 以及PTEN-/- MEF细胞在体内水平进行了验证(e,f,g)
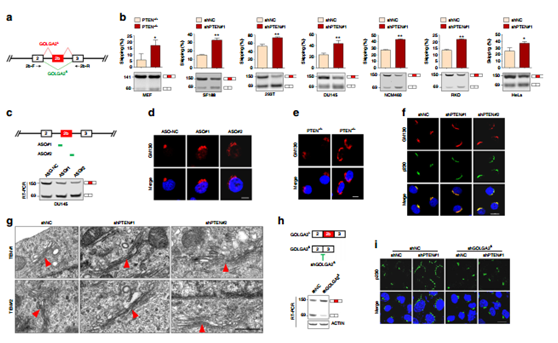
图5 PTEN的敲除诱导了GOLGA2 的可变剪切,促进了高尔基体伸展与分泌功能。
高尔基体相关功能基因GOLGA2的可变剪接是核PTEN所调控的可变剪接事件之一。PTEN缺失使得其在新定义的外显子2b处发生剪接跳跃,产生了更多不含有外显子2b的变体(a,b);利用ASO引起的外显子2b处发生剪接跳跃,IF免疫荧光证实了高尔基体变得更加的伸展(d)同样的在PTEN-/- MEF 细胞以及PTEN 敲减的DU145细胞内也如此。TEM电镜也观察到PTEN表达缺失后导致的高尔基体的分泌功能减弱(g)。外显子2b的变体这一可变剪接事件的发生使得高尔基体变得更为伸展,分泌功能大幅增强(h,i)。
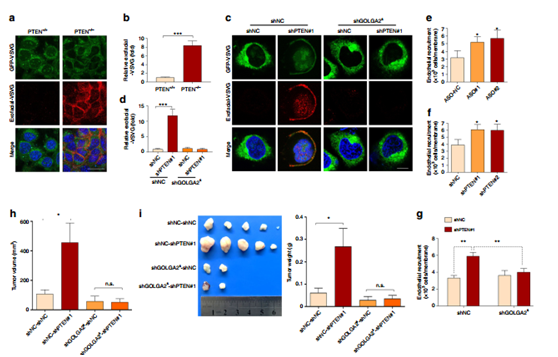
图6 通过GOLGA2 的剪接跳跃导致了PTEN缺失肿瘤的生长优势。
利用ts045-VSVG-EGFP(具有从ER移出到高尔基复合体中的能力,并且在温度降低到32℃时最终到达质膜,因此已被广泛用于研究膜转运)研究高尔基体分泌,结果显示PTEN缺失促进高尔基体分泌(a,b,c,d)ASO电穿孔转化以及PTEN的干扰实验也证明了这一点(e,f,g)进一步研究了GOLGA2S对肿瘤生长的影响。发现PTEN缺失促进肿瘤生长,敲低GOLGA2S也会抑制这种生长现象(h,i,j),因此GOLGA2剪接有助于PTEN缺失诱导的分泌和肿瘤生长
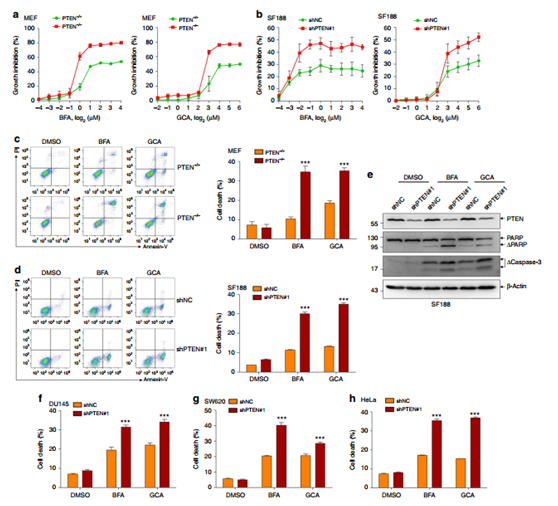
图7 PTEN敲除能使得癌细胞对分泌抑制剂敏感。
接着研究人员用两种分泌抑制剂BFA和GCA处理PTEN+/+和PTEN-/- MEF细胞。结果显示,一旦达到一定的浓度(BFA为1μg/ ml,GCA为8μg/ ml),BFA和GCA对PTEN-/- 细胞抑制作用更明显,表明分泌抑制剂BFA和GCA能够选择性地杀死PTEN缺失的肿瘤细胞。






