Drosophila tsRNAs preferentially suppress general translation machinery via antisense pairing and participate in cellular starvation response
转运RNA衍生的小RNA(tsRNA)是一类新兴的小RNA,但它们的调节作用尚未得到很好的理解。近日,北京生命科学中心陆剑研究组在Nucleic Acids Research(IF=11.561)研究发表了tsRNA介导的果蝇调节的分子机制和后果。通过分析495个公共小RNA文库,他们证明了这些RNA在果蝇中是保守的,普遍存在的。通过对单链tsRNA模拟和模拟转染的S2细胞进行mRNA测序和核糖体分析,他们发现tsRNA通过保守的互补序列匹配识别靶mRNA,并通过翻译抑制抑制靶基因。目标预测表明tsRNA优先抑制一般翻译机制的关键组分的翻译,这解释了tsRNA如何抑制全球mRNA翻译。血清饥饿实验证实tsRNA通过优先靶向核糖体蛋白和翻译起始或延伸参与细胞饥饿反应。在正常和饥饿条件下敲除S2细胞中的AGO2揭示了tsRNA介导的调节对AGO2的依赖性。他们还通过荧光素酶报告基因检测验证了代表性tsRNA对细胞全局翻译和特定靶标的抑制作用。他们的研究表明,tsRNA介导的调节可能对细胞系统中的能量稳态和代谢适应至关重要。
技术路线
主要结果
1.果蝇中,tsRNA对果蝇的小RNA表达谱有显着贡献。
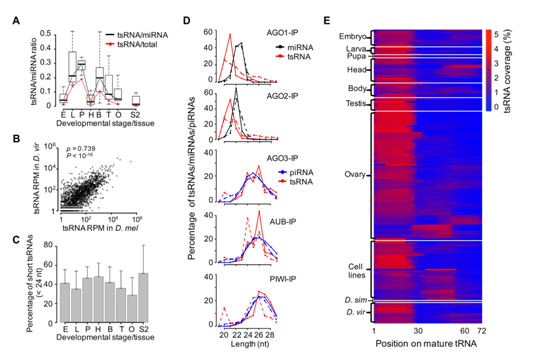
图1 tsRNA在果蝇中是保守的,丰富的和普遍的
(A)tsRNA reads和miRNA reads在个体不同的发育组织中的比率。字母代表每个部位(胚胎、幼虫、蛹、头、体、睾丸和卵巢)的首字母缩写。还显示了tsRNA reads与所有基因组图谱reads的平均比率,不包括rRNA,snRNA和snoRNA(红线)。(B)单个20-22nt tsRNA种类(N = 1725,RPM> 1)的标准化丰度在D. melanogaster(x轴)和果蝇(y轴)中共享,以百万分之一(RPM)测量。(C)在不同发育类别的小RNA文库中,总tsRNA(20-29nt)中的短tsRNA(20-23nt)的百分比。字母定义与A相同。(D)tsRNA长度在AGO1、AGO2、AGO3、AUB和PIWI-IP文库中的分布。(E)每个文库中成熟tRNA上每个核苷酸位置的tsRNA的相对覆盖率(N = 495)。
2.果蝇tsRNAs可能抑制全局mRNA的翻译,并且通过保守的反义匹配调节靶基因的翻译。
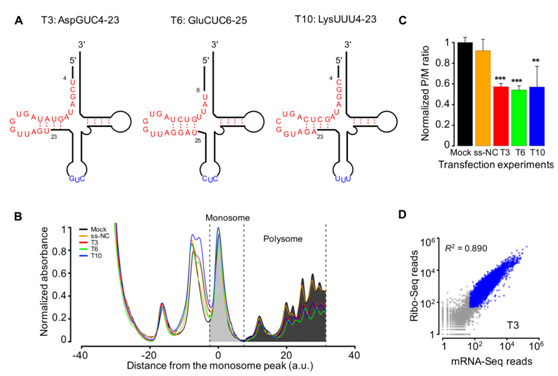
图2将tsRNA模拟物转染到S2细胞中抑制全局翻译活性
(A)在成熟tRNA中三种tsRNAs tsRNA AspGUC(T3),tsRNA GluCUC(T6)和tsRNA LysUUU(T10)的结构的示意图。 tsRNA为红色,反密码子为蓝色。(B)使用来自没有任何RNA序列(模拟,黑色)转染的S2细胞的10 45%蔗糖梯度分离的RNA的吸光度曲线(在UV波长254nm处),具有阴性对照小RNA(ss-NC,橙色), tsRNA T3(红色),T6(绿色)或T10(蓝色)。(C)多核糖体分区(P)内的聚集强度与单体分区(M)的比率通过对照实验的中值归一化。 星号表示转染和模拟之间显着不同的P / M比率。(D)Ribo-seq reads的散点图对T3转染实验中各个基因的mRNA-seq reads计数。 蓝色圆圈代表具有> 50个mRNA-seq读数和> 50个Ribo-seq读数的基因。
3.果蝇tsRNAs通过保守的反义匹配调节靶基因的翻译。
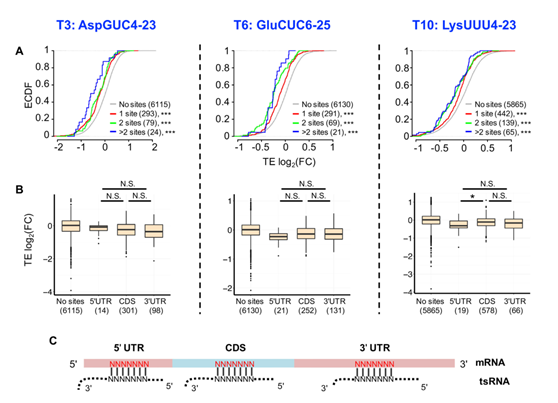
图3 tsRNA通过反义配对抑制靶mRNA的翻译
(A)所有基因的翻译效率(TE)变化的累积分布。 x轴是用tsRNA模拟物转染的S2细胞中的log 2(FC TE)(从左到右的T3,T6,T10)与用ss-NC转染相比。具有7-mer位点的基因在果蝇(Drosophila melanogaster)和果蝇(Drosophila virilis)之间保守,与tsRNA的任何部分配对的反义基因被定义为tsRNA靶基因。红色,绿色,蓝色,灰色分别表示具有一个,两个,两个,0个以上保守的tsRNA靶位点的基因。每个类别中的基因数量用括号表示。星号表示与ss-NC对照组相比TE FC的显着差异。(B)tsRNA的抑制效率与mRNA转录物中tsRNA靶位点的位置无关“No sites”:没有保守的tsRNA靶位点的mRNA;其他依次表示有在该区域有保守的位点。每个类别中的基因数量在括号中给出。(C)显示tsRNA反义配对与mRNA的不同位置中的进化上保守的7聚体靶位点(红色)的方案。
4.AGO2结合的tsRNA优先抑制一般翻译机制的组分。
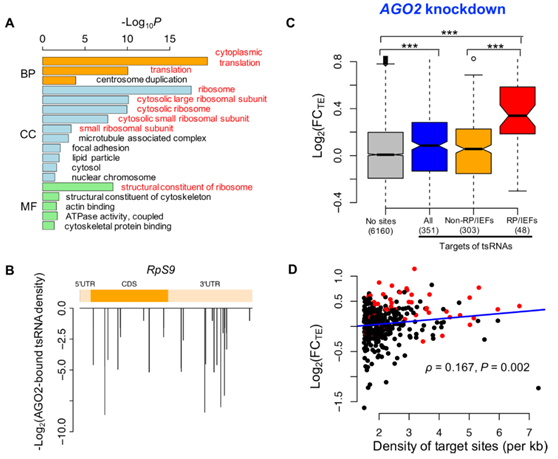
图4 tsRNA以AGO2依赖性方式介导翻译抑制
(A)对AGO2结合的tsRNA的前600个靶基因的GO分析。与翻译相关用红色表示。(B)AGO2结合的tsRNA对RpS9 mRNA的靶位点密度。 y轴是每个靶位点的-log 2(AGO2结合的tsRNA的reads)。(C)在正常条件下培养的AGO2敲低与ds-NC转染的S2细胞中的TE的log 2(FC)。(D)在敲除AGO2后,mRNA中的tsRNA靶位点的密度(x轴)与翻译去抑制(y轴)的程度正相关。 在该分析中使用AGO2结合的tsRNA的前351个靶标。 RP / IEF以红色显示(N = 48)。
5.tsRNA参与细胞饥饿反应。
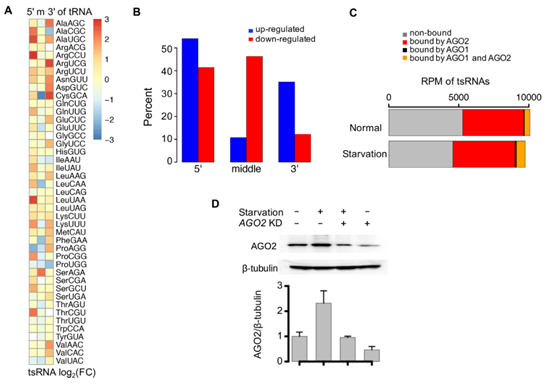
图5 tsRNA参与果蝇细胞饥饿反应
(A)血清饥饿反应中每种tRNA类型5’,中间,3’ tsRNA丰度。(B)来自5’,中间,3’ tsRNA中tsRNA丰度的变化是不同。 血清饥饿下的上调显示为蓝色,血清饥饿下的下调显示为红色。 y轴是三种类型的tsRNA中上调/下调的tsRNA的百分比。(C)正常和饥饿的S2细胞中tsRNA的丰度(RPM)。 不受AGO1和AGO2结合的tsRNA为灰色,仅由AGO2结合的tsRNA为红色,仅由AGO1结合的tsRNA为黑色,由AGO1和AGO2结合的tsRNA为橙色。(D)在S2细胞的四种不同条件下对AGO2进行Western印迹。 S2细胞的四种条件:在正常条件下培养,血清饥饿,血清饥饿下AGO2敲低,和AGO2敲低。
6.tsRNA和miRNA介导的调节在很大程度上是独立的。
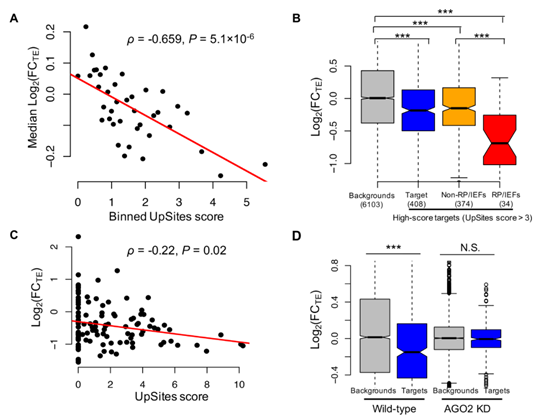
图6 tsRNA抑制细胞饥饿反应中靶基因的翻译
(A)通过上调的AGO2结合表现出更高的靶位点的mRNA(UpSitesscore,x-轴)和经过基因翻译的表达(y轴)相关性。显示了Spearman的相关性和P值。(B)由上调的AGO2结合的tsRNA靶向的基因(UpSites得分> 3 / kb,N = 408)在饥饿的S2细胞中降低了TE。(C)FC TE(log 2 scaled,y轴 血清饥饿下的5’TOP基因)和UpSites得分(x轴)之间的显着负相关(N = 115)。(D)在正常(左)和正常(左)和下饥饿的S2细胞(UpSites> 3和5’TOP基因未包括,N = 376)中上调的tsRNA的最高得分靶基因的TEs(y轴)的变化。
7.得到一个tsRNAs如何抑制特异性靶标和全局mrna翻译的模型。
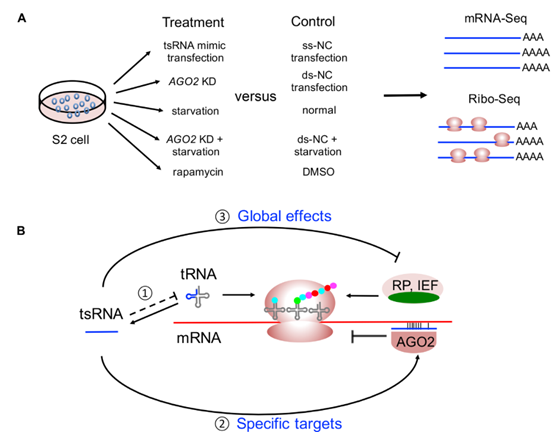
图7 tsRNA如何抑制特定靶标和全局mRNA翻译的模型
(A)本研究中S2细胞砂测序工作流程的实验处理概述。(B)tsRNA通过反义配对优先靶向RP和IEF以调节全局翻译活性。(1)AGO2结合从tRNA切割的tsRNA,并且那些tsRNA特异性结合具有部分互补性的mRNA并抑制它们的翻译。(2)在饥饿的情况下,翻译抑制也受mTOR途径调节5’ TOP基因和一些tsRNA靶标与5’ TOP基因(绿色)。(3)一些RP和IEF的翻译被tsRNA压制,这反过来抑制了全球翻译活动。
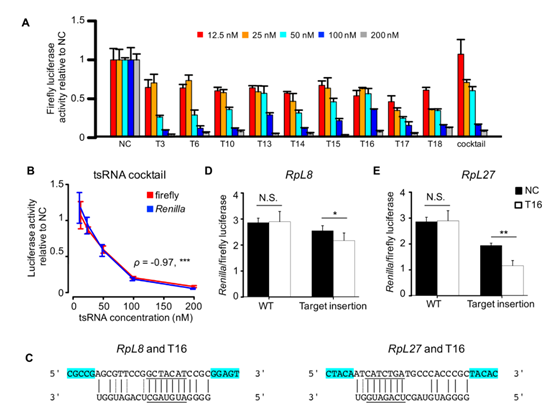
图8 使用双荧光素酶报告基因检测验证tsRNA对全局翻译活性和特定靶位点的抑制作用
(A)将tsRNA模拟物和psiCHECK-2质粒共转染到S2细胞中降低了萤火虫荧光素酶的活性。颜色键显示tsRNA模拟物的不同最终浓度。(B)较高浓度的tsRNA混合物在psiCHECK-2质粒上引起较低的萤火虫(红色)和海肾(蓝色)荧光素酶活性。 *** P <0.001(每次测定进行三次重复)。(C)tsRNA T16与RpL8和PpL27 mRNA中预测的靶向位点之间的碱基配对。靶位点两侧的侧翼5bp(以青色突出显示)包括在合成的靶向位点中。(D和E)用T16共转染的S2细胞和含有靶位点的psiCHECK-2质粒(RpL8,D; RpL27,E)的相对荧光素酶活性显着低于用ss-NC和相同质粒共转染的那些质粒。






