Nature重磅!癌细胞释放的外泌体携带PD-L1远程干扰抗免疫细胞,控制免疫系统
肿瘤免疫逃逸(Tumor immune escape)是指肿瘤细胞通过多种机制逃避机体免疫系统识别和攻击,从而得以在体内生存和增殖。例如伪装成正常细胞,或者直接抑制免疫细胞的功能。传统思想认为,免疫细胞只有进入肿瘤内部才会被癌细胞打击。然而,近期,来自宾夕法尼亚大学的徐小威教授与郭巍教授领导的团队揭示,肿瘤内的癌细胞会产生携带压制T细胞活性的PD-L1的外泌体,直接散播到全身各处,通过免疫细胞对人体的免疫系统进行全面的打击和压制。
这项研究于今年8月在《Nature》杂志上发表,题为“Exosomal PD-L1 contributes to immunosuppression and is associated with anti-PD-1 response”。揭示了肿瘤细胞系统抑制免疫系统的机制,并为外泌体PD-L1作为抗PD-1治疗的预测因子的应用提供了理论基础。
摘要:
肿瘤细胞表面的程序性死亡配体1(PD-L1)和T细胞表面的程序性死亡受体1(PD-1)相互作用,诱发免疫检查点反应,导致免疫效应细胞失活。肿瘤细胞则通过上调PD-L1的表面表达来逃避免疫监测。抗PD-1抗体在治疗肿瘤方面显示出很好的前景,包括转移性黑色素瘤。但是,患者的反应率很低。所以需要更好地了解PD-L1介导的免疫逃避,以预测患者反应并提高治疗效果。该研究报道了转移性黑色素瘤释放细胞外囊泡,主要是外泌体,其表面携带PD-L1。用干扰素-γ(IFN-γ)刺激增加了这些囊泡上PD-L1的量,这抑制了CD8 T细胞的功能并促进肿瘤生长。在患有转移性黑素瘤的患者中,循环外泌体PD-L1的水平与IFN-γ的水平呈正相关,并且在抗PD-1疗法的过程中变化。在治疗的早期阶段,循环外泌体PD-L1的增加幅度可作为肿瘤细胞对T细胞更新的适应性反应的指标,从而区分临床应答者与非应答者。研究揭示了肿瘤细胞系统性抑制免疫系统的机制,并为外泌体PD-L1作为抗PD-1治疗预测因子的应用提供了理论依据。
研究结果:
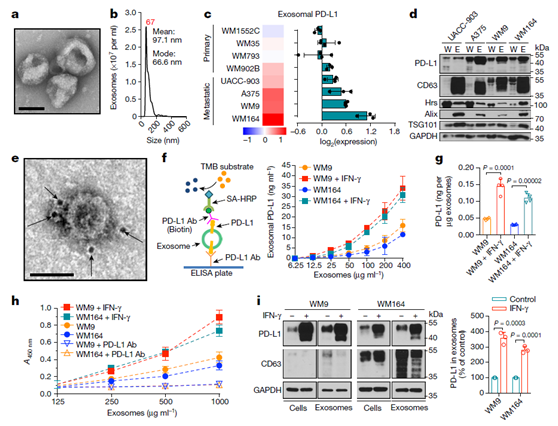
图1 黑素瘤细胞来源外泌体表面的PD-L1表达和IFN-γ对它的调控。
a, WM9 细胞分泌的外泌体电镜图。 b, 泌体的纳米粒子跟踪分析(NTA)。 c, 反向蛋白芯片(RPPA)分析数据显示原发性或转移性黑素瘤细胞系外泌体中PD-L1的水平(n = 3, WM1552C, WM902B, A375, WM164);n = 4 WM35, WM793, uac -903, WM9)。 d,整个细胞裂解液 (W)和不同转移性黑色素瘤细胞分泌的外泌体(E)中PD-L1的WB结果。e, 抗PD-L1抗体标记的WM9细胞来源外泌体的TEM图像。 f, ELISA的示意图(左),从指定细胞类型中分离出来的外泌体表面的PD-L1浓度(右) 。 g, ELISA检测揭示 IFN-γ处理后黑素瘤细胞来源外泌体表面的 PD-L1浓度增加。h, IFN-γ 或 PD-L1抗体处理黑素瘤细胞后 PD-l 与外泌体的结合结合能力增加。I, Western blot 显示IFN-γ处理后外泌体表面的 PD-L1表达增加。
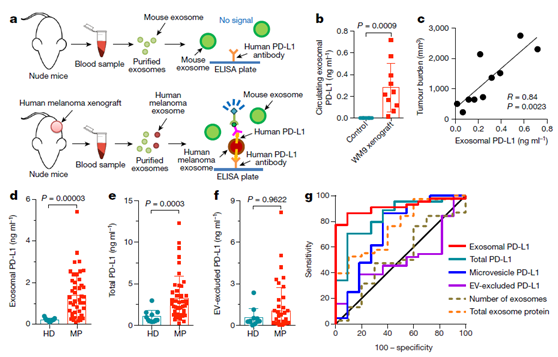
图2 循环外泌体的PD-L1水平将转移性黑色素瘤患者与健康捐赠者区分开来。
a, 示意图显示,ELISA检测人黑色素瘤异种移植小鼠中血浆来源外泌体表面人PD-L1 的表达. b, ELISA显示,人黑色素瘤异种移植小鼠的血浆来源外泌体 表面PD-L1的表达 高于对照小鼠的。 c, 血浆外泌体PD-L1浓度与肿瘤大小成正相关。 d–f, ELISA显示循环外泌体PD-L1 能显著区分黑素瘤患者(n=44)和健康者(n=11): (d), 泌体PD-L1 (e) 总 PD-L1 (f) 胞外囊泡。 g, ROC曲线分析,显示外泌体PD-L1能区分转移性黑色素瘤患者与健康者。
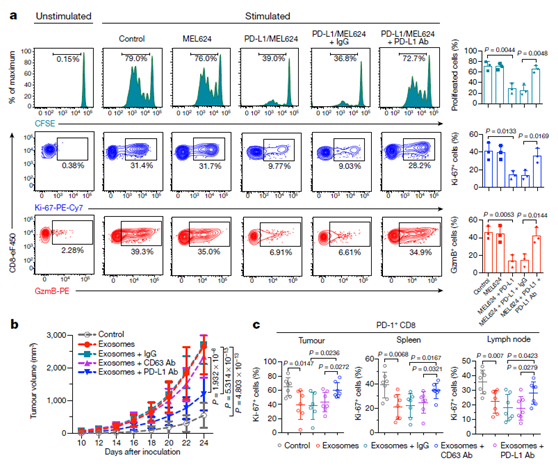
图3 外泌体 PD-L1抑制 CD8 T 细胞,在体内外促进黑素瘤进程 。
a,表达外源性PD-L1 的MEL624细胞分泌的外泌体,显著抑制 CD8+T细胞的增殖,细胞因子产生和细胞毒性(左上直方图显示,CFSE-标记的外周血CD8+T细胞;左中等高线轮廓图显示外周血CD8+T细胞Ki-67的表;左下显示外周血CD8+T细胞granzyme B的表达。b, 来自亲代B16-F10细胞的外泌体的注射促进了PD-L1(KD) B16-F10细胞肿瘤的生长,用抗PD-L1抗体预处理外泌体则抑制了这种作用,而IgG亚型或cd63阻断抗体没有这一效果。(b图为 PD-L1(KD)B16-F10肿瘤生长曲线)。c,注射外泌体后,肿瘤浸润的CD8 T淋巴细胞(TILs)的数量明显减少。
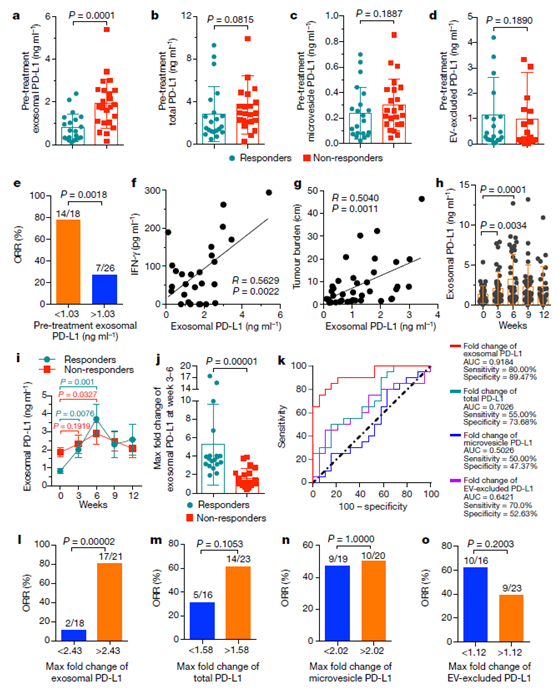
图4 循环外泌体PD-L1 水平显著区分应答pembrolizumab的患者(n=21)和非响应患者(n=23)。
a–d, 比较两种患者的PD-L1水平:(a)外泌体 PD-L1, (b) 总 PD-L1, (c) 微囊泡 PD-L1, (d) 去除胞外囊泡后检测到的PD-L1。e, 高、低PD-L1水平的循环外泌体预处理病人的客观缓解率(ORR,Objective Response Rate) 分析。f, g, 皮尔森相关系数分析显示,IFN-γ水平(f,n = 27)或肿瘤大小(g,n = 39)与黑色素瘤患者的血浆外泌体PD-L1水平都成正相关。H,I,j, pembrolizumab治疗后响应患者在6周内血浆外泌体PD-L1水平升高 (n = 39)。 K, I-O: ROC曲线和ORR分析显示,在治疗3 - 6周内外泌体PD-L1的最大差异倍数(响应患者的外泌体PD-L1水平与非响应患者的比)比其他PDL-1更能区分临床应答者与非应答者。






