circEPSTI1作为三阴性乳腺癌进展的预后标志物和介质
环状RNA(circRNA)是一类非编码RNA,其在调节基因表达和许多病理反应中起重要作用。然而,三阴性乳腺癌(TNBC)中circRNA的表达谱和功能尚未可知。近日,发表在《Theranostics》(IF=8.537)上的一篇名为《circEPSTI1 as a Prognostic Marker and Mediator of Triple-Negative Breast Cancer Progression》的文章研究了人类circRNA在TNBC组织中的表达谱,并鉴定出circEPSTI1(hsa_circRNA_000479)是显着上调的circRNA。该团队进行circRNA微阵列分析以筛选TNBC的circRNA表达谱,并进一步研究了circEPSTI1,通过敲低三种TNBC细胞系中的circEPSTI1观察了circEPSTI1对TNBC增殖,克隆形成和凋亡的影响。基于MRE分析和荧光素酶报告基因测定,发现circEPSTI1作为miRNA海绵和miRNA的共靶基因与miRNA结合,并在小鼠中进行异种移植实验以证实这些发现。同时,通过ISH评估了240名TNBC患者的circEPSTI1水平。结果显示,敲低circEPSTI1抑制TNBC细胞增殖并诱导细胞凋亡。体外和体内实验表明,circEPSTI1作为miRNA海绵与miR-4753和miR-6809结合,以调节BCL11A表达并影响TNBC的增殖和凋亡。高水平的circEPSTI1与TNBC患者的存活率降低相关。circEPSTI1-miR-4753/6809-BCL11A通过竞争性内源RNAs(ceRNA)机制影响三阴性乳腺癌的增殖和凋亡。此外,将circEPSTI1鉴定为TNBC患者存活的独立的预后标志物。
技术路线
结果
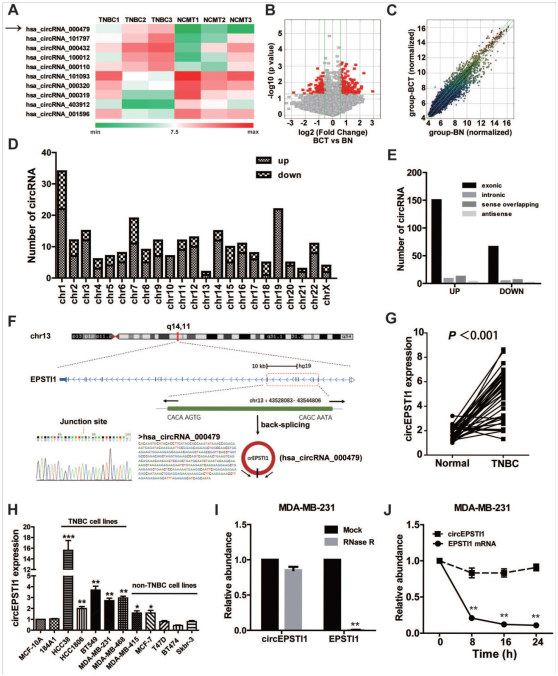
图1. TNBC中的差异环状RNA的鉴定。
(A)三对人TNBC癌组织和邻近正常组织中差异表达的circRNA的聚类热图。上调(红色)或下调(绿色)的circRNA分别呈现。(B)TNBC癌组织与邻近正常组织中circRNA表达比较的火山图。红点代表circRNA上调或下调了1.5倍,P值<0.05。(C)散点图用于评估TNBC癌组织和邻近正常组织之间circRNA表达的变化。绿线是倍数变化线。(D)差异表达的circRNA在染色体上的分布规则。(E)TNBC中差异表达circRNA的基因组起源。(F)EPSTI1基因和circEPSTI1的基因组位点。通过qRT-PCR检测circEPSTI1的表达,并通过Sanger测序验证。(G)通过qRT-PCR测定乳腺正常细胞系和乳腺癌细胞系中circEPSTI1的表达水平。倍数变化基于β-肌动蛋白进行标准化。(H)37对TNBC样本和相应的正常邻近组织中circEPSTI1的表达水平。(I)用RNase R处理MDA-MB-231细胞后,circEPSTI1和EPSTI1 mRNA的qRT-PCR分析。(J)放线菌素D处理后MDA-MB-231细胞中circEPSTI1和EPSTI1 mRNA的qRT-PCR分析。
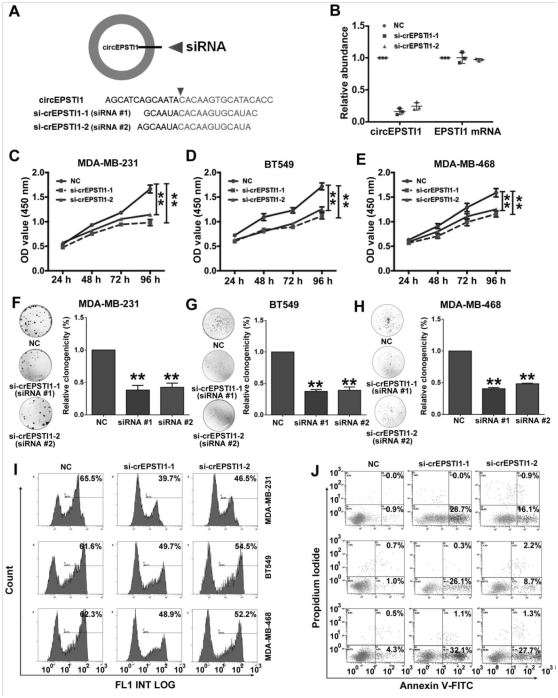
图2. circEPSTI1的沉默抑制TNBC生长和增殖并诱导细胞凋亡。
(A)circEPSTI1的siRNA特异性反向剪接点的位点示意图。(B)用两种siRNA处理后circEPSTI1和EPSTI1 mRNA表达的qRT-PCR分析。(C-E)用对照或circEPSTI1 siRNA转染的MDA-MB-231,BT549和MDA-MB-468细胞的CCK-8测定。(F-H)用对照或circEPSTI1 siRNA转染的MDA-MB-231,BT549和MDA-MB-468细胞集落形成的测定。(I)用对照或circEPSTI1 siRNA转染的MDA-MB-231,BT549和MDA-MB-468细胞中使用EdU评估DNA合成。(J)膜联蛋白V-FITC/碘化丙啶染色和FACS定量经特定处理后的MDA-MB-231,BT549和MDA-MB-468细胞中的凋亡细胞数。** P <0.01。
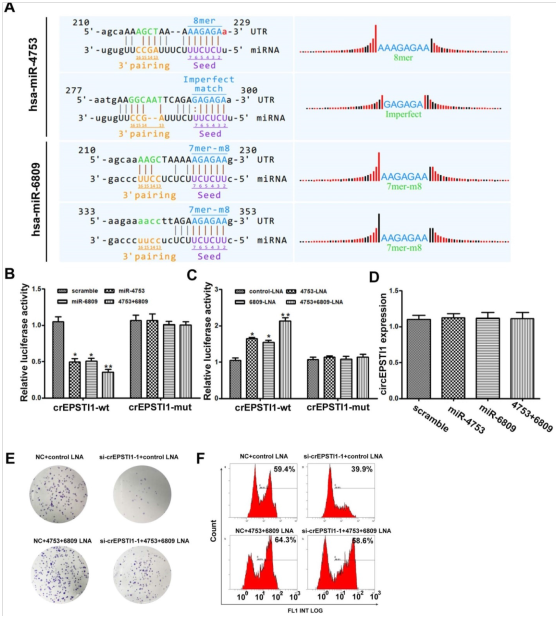
图3. circEPSTI1充当miR-4753和miR-6809的miRNAs海绵。
(A)circEPSTI1中miR-4753和miR-6809预测位点的示意图。(B-C)用加扰对照,miR-4753类似物,miR-6809类似物,miR-4753 + miR-6809类似物,对照-LNA,miR-4753-LNA,miR-6809-LNA或miR-4753 + miR-6809-LNA和含有circEPSTI1野生型或miR-4753和miR-6809结合位点突变结构的荧光素酶报告基因(circEPSTI1-mut)共转染的HEK 293T细胞的荧光素酶测定。* P <0.05;** P <0.01。(D)用加扰对照,miR-4753类似物,miR-6809类似物或miR-4753 + miR-6809类似物转染后circEPSTI1的qRT-PCR分析。(E)用NC+对照-LNA,si-crEPSTI1-1+对照-LNA,NC + miR-4753 + miR-6809-LNA或si-crEPSTI1-1 + miR-4753 + miR-6809-LNA转染的MDA-MB-231的集落形成的测定。(F)用NC+对照-LNA,si-crEPSTI1-1+对照-LNA,NC + miR-4753 + miR-6809-LNA或si-crEPSTI1-1 + miR-4753+ miR-6809-LNA转染的MDA-MB-231细胞的5-乙炔基-2'-脱氧尿苷(EdU)测定。
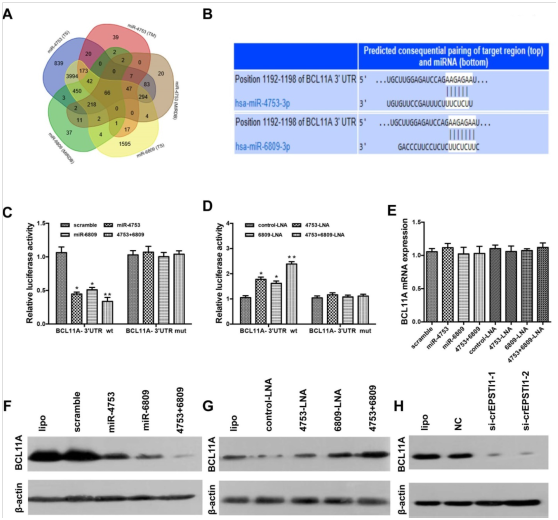
图4. BCL11A是miR-4753和miR-6809的直接靶基因,并且被circEPSTI1敲低所抑制。
(A)基于三种算法(TargetScan(TS),MIRDB和TARGETMINER TM)表示miR-4753和miR-6809的共靶基因重叠得Venn图。Venn图工具可从http://bioinformatics.psb.ugent.be/webtools/Venn/获得。(B)miR-4753和miR-6809在BCL11A mRNA的3'UTR上预测位点的示意图。(C-D)用加扰对照,miR-4753类似物,miR-6809类似物,miR-4753 + miR-6809类似物,对照-LNA,miR-4753-LNA,miR-6809-LNA或miR-4753 + miR-6809-LNA和含有BCL11A-3'UTR野生型或miR-475和miR-6809结合位点突变(BCL11A-3'UTR-mut)的荧光素酶报告基因结构共转染的HEK 293T细胞的荧光素酶测定。(E)用加扰对照,miR-4753类似物,miR-6809类似物,miR-4753 + miR-6809类似物,对照-LNA,miR-4753-LNA,miR-6809-LNA或miR-4753 + miR-6809-LNA转染后BCL11AmRNA的qRT-PCR分析。(F-G)通过Western杂交测定miR-4753 / miR-6809类似物或miR-4753 / miR-6809抑制剂对MDA-MB-231细胞中BCL11A蛋白表达的影响。(H)敲低circEPSTI1对MDA-MB-231细胞中BCL11A蛋白表达的影响。
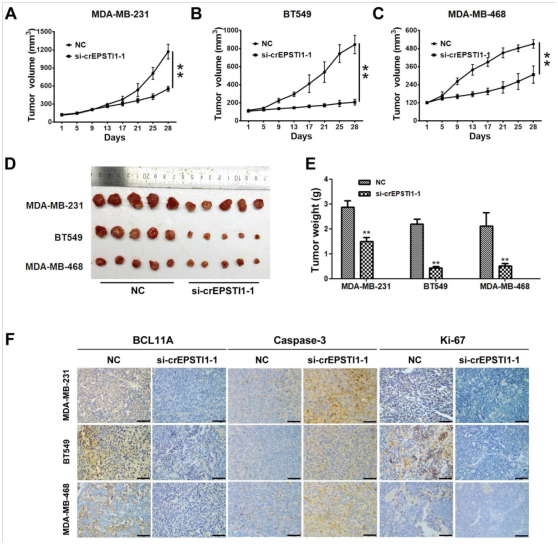
图5. circEPSTI1-miR-4753/6809-BCL11A影响TNBC体内生长和增殖。
将(A)MDA-MB-231,(B)BT549和(C)MDA-MB-468细胞皮下注射到裸鼠中并进行不同处理(即加扰或si-cEPSTI1-1)。绘制肿瘤的生长曲线。** P <0.01。(D)小鼠异种移植模型中的肿瘤。(E)异种移植肿瘤的重量。(F)通过免疫组化分析异种移植肿瘤,并呈现BCL11A,caspase-2和ki-67表达的典型图像。比例尺=50μm。
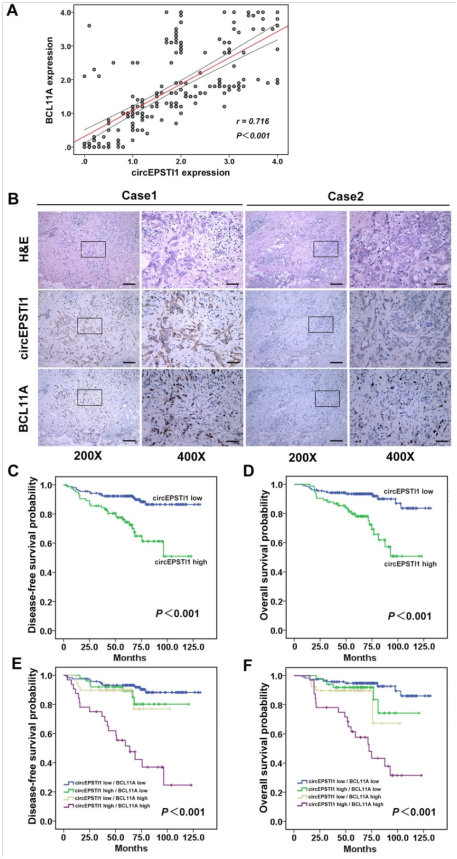
图6. circEPSTI1与BCL11A表达正相关,并充当TNBC的预后因子。
(A)TNBC组织微阵列数据分析(n = 240),证明了circEPSTI1与BCL11A的线性回归和显著Pearson相关性。(B)circEPSTI1的典型H&E和原位杂交图像和两个TNBC病例中的BCL11A表达的免疫组化图像(200× 比例尺=100μm;400× 比例尺=50μm;)。(C-D)高水平的circEPSTI1与DFS和OS减少相关(circEPSTI1 low n = 157;circEPSTI1 high n = 83)。(E-F)给出了circEPSTI1和BCL11A表达的四种可能组合的DFS和OS曲线。高水平的circEPSTI1和BCL11A与存活率降低相关(circEPSTI1 low/BCL11A low n = 119;circEPSTI1 high/BCL11A low n = 50;circEPSTI1 low/BCL11A high n = 39;circEPSTI1 high/BCL11A high n = 32)。






