核仁小 RNA(snoRNAs)研究
核仁小 RNA(snoRNAs)是一类广泛存在于真核生物细胞核仁的小分子非编码 RNA,长度60-300nt,能与核仁核糖核蛋白结合形成 snoRNPs 复合物[1]。在脊椎动物中编码核仁小 RNA 的基因主要存在于蛋白编码基因或非蛋白编码基因的内含子区域,并且经过进一步的转录后加工处理形成成熟的核仁小 RNA[2]。具有保守的结构元件,按结构可以分为三类:box C/D snoRNA、 box H/ACA snoRNA 和 MRP RNA(研究较少)。在核糖体 RNA 的加工过程中,前两类 snoRNAs 分别发挥两种修饰作用:核糖体 RNA 的 2 -O– 甲基化和假尿嘧啶化[3]。绝大多数 snoRNA 的宿主基因编码的蛋白或者转录本为核糖体的生物合成与功能所必须,且作为 5′末端寡嘧啶家族参与生长依赖的翻译调控。 snoRNAs 参与的生物学过程主要有 rRNA 的加工处理,RNA 剪接和翻译过程的调控以及氧化应激反应[4]。由于 snoRNA 被认为主要存在于核仁中,功能单一,之后的很长一段时间,snoRNA 的研究陷入低潮。然而,近几年,随着测序技术的发展,越来越多的数据表明 snoRNA 在肿瘤中被异常调控,还参与到遗传性疾病、造血、代谢以及癌症的过程中。
1. snoRNAs 的生物合成
snoRNAs 主要包含两个家族:C/D box snoRNAs 与 H/ACA box snoRNAs [5] (图 1)。大多数 snoRNAs 主要位于由 RNA 聚合酶 II 转录的基因的内含子区域。但 snoRNAs 也可以来源于长链非编码 RNA(lncRNA)的内含子区域。从内含子上脱离后,pre-snoRNAs进一步的被核酸外切酶处理去除两端的多余序列,进而形成成熟的 snoRNAs。snoRNAs内部的信号序列指导 snoRNAs 与相应蛋白结合形成 snoRNP 复合物来避免被酶切,进而发挥功能。snoRNP 复合物能够分为两类 C/D box snoRNP 和 H/ACA box snoRNP。C/D box snoRNP 包含四种进化上保守的,必需的蛋白质,即纤维蛋白(fibrillarin)/Nop1p、Nop56、Nop58/Nop5p 和 p15.5KD/ Snu13p,而 H/ACA box snoRNP 的结合蛋白包括进化保守的 Cbf5p(dyskerin)、Gar1p、Nhp2p 和 Nop10p。
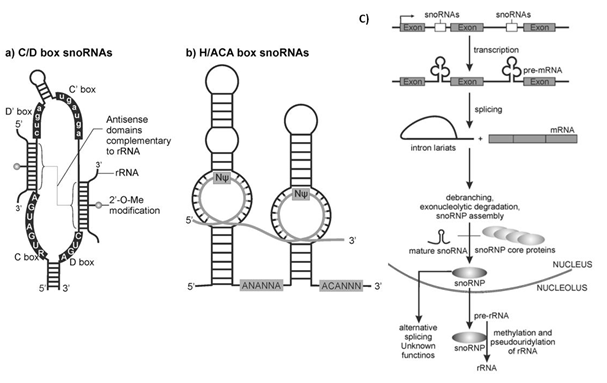
图1 box C/D snoRNA、 box H/ACA snoRNA结构以及生物合成(图片来源:Thorenoor, N. and O. Slaby (2015))
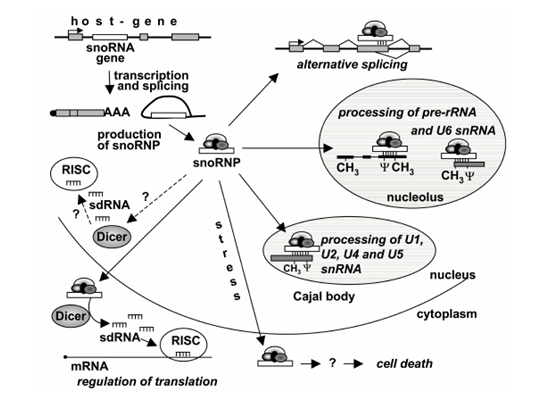
图2 snoRNAs的生物学功能(图片来源:Makarova, J. A., S. M. Ivanova, et al. (2013))
2. snoRNAs的生物学功能[6](图2)
1)snoRNAs 与核糖体 RNA 加工
在核糖体 RNA 的加工过程中,核糖体 RNA 的 2′-O–甲基化由 C/D box snoRNAs 来负责。 C/D box snoRNAs 包含有两个短的序列元件,即位于 5 " 末端的 box C(RUGAUGA R 代表 A 或 G)和 3" 末端的 box D(CUGA)。多数 box C/ D snoRNAs 基因的 5" 和 3" 末端都有 4 -5 nt 的反向重复序列,可以形成较为稳定的短茎结构,这一结构在 snoRNAs 的生物合成和核仁定位过程中起关键作用[7]。核糖体 RNA 的假尿嘧啶修饰主要是由 H/ACA box snoRNAs 来完成的。H/ACA box snoRNAs 具有保守的“发夹-铰链-发夹-尾”的二级结构。box H (ANANNA,N 代表任一核苷酸)位于单链形式的铰链区,ACA则一般位于 3" 末端上游 3 个核苷酸处。H/ACA box snoRNAs 的指导序列位于单个或者两个发夹内部的“假尿嘧啶化泡”内,它们可以与靶 RNA 上的被修饰位点两翼序列各形成 4-8nt 的互补配对。
2)snoRNA 与 mRNA 3’末端加工
在一项新的研究中,研究人员通过生化分析和大规模测序,发现 mRNA 3'末端加工复合体和部分 snoRNA 相互作用。在对其中的一种 snoRNA 富含 U/A 的 SNORD50A 进一步开展体外实验和体外实验,结果表明 SNORD50A 在 mRNA 3'末端加工中主要发挥着一种竞争性抑制的用,并最终影响 mRNA 水平的表达[8](图 3)。
3)snoRNAs 与应激反应
snoRNAs 有助于细胞应对应急反应。棕榈酸酯处理能够导致细胞中 SNORDs 32A, 33以及 35A 的表达水平也显著提高。细胞对棕榈酸酯产生抗性是由于抑制了 SNORDs 32A,33和35A 的表达,它们介导了由诱导剂引起的细胞死亡[9]。在缺氧条件下,SNORD14A和 SNORD83B 的表达水平得到显著提高[10]
4)snoRNAs 派生的小 RNAs
miRNA 在一系列调控过程中起着重要作用,如细胞存活和细胞增殖的调控, 由 snoRNAs 产生的 sno-miRNAs 产生的小 RNA 具有双重功能,同样的转录本可以作为 snoRNA 和 miRNA 的前体。ACA45 是第一个被报道能够被降解成短片段 snoRNAs,它是通过与 Ago 蛋白的相互作用被发现的,而 Ago 作为 miRNA RISC 复合物的成员,这就表明 ACA45 的进一步的加工处理是依赖于 Dicer 酶的。降解产生的 20-22nt 的短片段 RNA 的作用机制类似与 miRNA 抑制目的基因(CDC2L6)的表达[11]。很多研究揭示了 snoRNAs 可能参与抑癌基因 P53 的调控,snoRNA 来源的 miR-605 被报道能抑制 MDM2 蛋白合成,从而促进抑癌基因 P53 的表达(图 4)近期报道发现 11 个 C/D box snoRNAs 能够降解形成短片段 RNA 从而抑制靶基因的表达[12]。在最新的研究中 snoRNAs 进一步被加工成更小的 RNAs 被称为 sno 派生的 RNAs (sdRNAs),通过对来自 32 种癌症类型的 10262 例患者样本的~22 nt 大小的 smRNA-seq 数据集的综合分析,研究人员绘制了泛癌 sdRNAome 的图谱,结合多个临床相关特征上的特征,特别是癌症免疫和临床结果。大量的 sdRNAs 与肿瘤免疫微环境特征显著相关,如免疫抑制标志物、CD8+ T 细胞浸润、细胞溶解性 T 细胞活性、肿瘤血管组织等[13]。
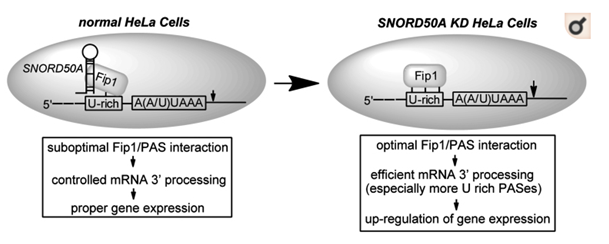
图3 snoRNA与mRNA 3’末端加工(图片来源:Huang, C., J. Shi, et al. (2017))
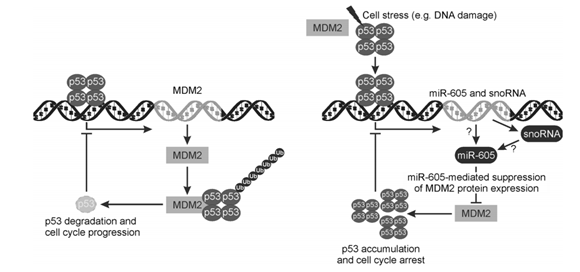
图4 microRNA和snorna介导的p53正反馈环(图片来源:Liao J, et al.. 2010.)
5)特殊的 Sno-lncRNA
在 2012 年由上海生化所陈玲玲课题组率先鉴定出来, Sno-lncRNA 是一类新型的长非编码 RNA,它们的序列中包含完整的 snoRNA 序列,并且该序列对 sno-lncRNA 的稳定性和亚细胞定位至关重要,研究表明 sno-lncRNA 长非编码 RNA SLERT 通过松弛 DDX21 的环形结构,从而促进 Pol I 转录 rRNA 的重要作用[14]。
6)snoRNAs 与肿瘤发生发展
snoRNAs 参与的癌症的分子病理学,在早年的研究中在非小细胞肺癌中多种 snoRNAs 呈现出不同的表达状态[15]。snoRNAsU50 2bp 纯合缺失突变与前列腺癌的发生发展有关[16]并且在乳腺癌中 U50 具有杂合缺失以及转录下调的特点[11]。通过基因组芯片技术检测到 SNORD33, SNORD66, SNORD73B, SNORD76,SNORD78, and SNORA42 六种 snoRNAs 在非小细胞肺癌(NSCLC)是表达上调的他们通常位于肺癌的频繁扩增的基因组区域[17]。snoRNAs 与肿瘤的关系也能够延伸到与它们相互作用的蛋白分子上。 Fibrillarin 是发育必须的,缺失 Fibrillarin 能够导致胚胎致死。在乳腺癌的研究中当高水平的 Fibrillarin 干扰应激激活 p53,snoRNA 通路被抑制时,肿瘤抑制因子 p53 可以作为 snoRNP 扰动的前哨,激活其介导生长抑制作用[18]。Dyskerin、NOP10以及 Nhp2p 的突变与上皮癌有关[19]。snoRNAs 以及 snoRNP 很可能是通过影响核糖体和蛋白的翻译来影响肿瘤的发生的,因为在癌细胞中翻译过程总是异常的。但是 snoRNAs 也可能通过降解的短片段 RNA 来发挥 miRNA 功能进而调节基因的表达来影响肿瘤的发生。最新的研究发现,一种管家型 snoRNA 分子是著名癌分子 K-RAS 的开关,研究人员调查了 12 种常见人类癌症,包括皮肤癌、乳腺癌、卵巢癌、肝癌和肺癌中,10-40%的肿瘤缺失一对称作为 SNORD50A/B 的 snoRNAs。在人类黑色素瘤和肺癌细胞中, SNORD50A/B 结合 KRAS 时,它会抑制 KRAS 蛋白结合一种称作为法尼基转移酶的活化分子的能力。法尼基转移酶改变 KRAS 蛋白使得它能够去到细胞膜等待外部生长及分裂信号[20]。2017 年研究者通过 RNA-seq 对比 Aes(癌基因)缺失前后转录组的变化,意外发现大量的 snoRNA 下调,而在过表达 Aes 后 snoRNA 表达量显著上升,这说明 Aes 能影响 snoRNA 的表达,敲除单个 snoRNA,rRNA 的甲基化显著降低,并且抑制白血病细胞的克隆形成能力[21]。
6)snoRNAs 作为癌症诊断和预后生物标志物
snoRNAs 在细胞中的功能是多样的,肿瘤特异表达的 snoRNAs 可能作为癌症相关的生物标志物。研究报道 snoRNAs 能够在外周血浆以及血清中稳定存在且可测,这使 snoRNAs 作为潜在的循环肿瘤生物标志物成为可能 [22] 。在非小细胞肺癌中 SNORD33,SNORD66 和 SNORD76 不仅在肿瘤中高表达并且在血浆中也检测到高表达,这使辨别非小细胞肺癌患者成为可能[23]。SNORA42 虽在组织相关疾病的预后检测效果较差,但可以预测疾病[24]。SNORD43, SNORD44 和 SNORD48 作为乳腺癌和头颈部鳞状细胞癌潜在的抑制剂[25]。SNORD113-1 在原发性肝细胞癌中表达下调并且在原发性肝细胞癌中作为抑癌基因发挥功能[26]。总之,snoRNAs 可以作为癌症诊断和预后的潜在的生物标志物。snoRNAs 作为癌症治疗的潜在靶点,例如,snoRA42 在肺癌中是高表达的,在肺癌细胞中选择性的沉默 snoRNAs42,细胞的增殖能力和活力明显下降。
7)snoRNAs与疾病
SNORD116的缺失是导致Prader Willi综合症发病的主要原因。SNORD115表达水平的变化导致了各种心理和行为畸变典型自闭症[27]。同时另外一项研究报道在病毒感染的细胞中一系列snoRNAs一方面snoRNAs可以作为受体抗病毒反应的调节者;另一方面,调控RNA的活性可以被病毒利用使其逃避天然免疫从而完成其生命周期[28]。在之前的研究中,C/D box snoRNAs 表达水平的变化也发生在孕妇酒精消耗引起的异常胎儿大脑发育的过程中,在此过程中SNORD115表达上调,SNORD116表达下调[29]。最新的研究者绘制了哺乳动物大脑snRNA和snoRNA表达图谱,发现哺乳动物大脑snRNA和snoRNA表达水平存在广泛差异。其中U1和SNORA29表达量在人脑中却发生了巨大变化[30]。
研究案例
1)“Germline Duplication of SNORA18L5 Increases Risk for HBV-related Hepatocellular Carcinoma by Altering Localization of Ribosomal Proteins and Decreasing Levels of p53” Gastroenterology 2018(IF=20.773)[26]
该研究是基于生殖系拷贝数变异(CNV)的全基因组关联分析(GWAS),通过对比1583例乙型肝炎病毒(HBV)相关的肝癌患者与1540例乙型肝炎病毒(HBV)相关的非肝癌患者,发现了一个低频重复染色体15q13.3与乙型肝炎病毒相关的肝癌患病风险密切相关(P=3.17×10–8;odds ratio, 12.02)。15q13.3的拷贝数与SNORA18L5在肝组织中的表达相关。过表达SNORA18L5的增加了小鼠肝癌细胞的增殖和移植瘤的生长;干扰SNORA18L5降低了肝癌的增殖和肿瘤的生长。SNORA18L5在HepG2和SMMC-7721细胞中的过表达可抑制p53依赖性细胞周期阻滞和凋亡。SNORA18L5的过表达导致核糖体生物合成活性增强,成熟的18S和28S rRNA水平升高,导致核糖体蛋白RPL5和RPL11停留在核仁中,从而阻止它们与MDM2结合。这导致了MDM2介导的p53泛素化和降解的增加。与非肿瘤肝组织相比,HCC组织中SNORA18L5水平升高,且患者生存时间缩短。该研究深入浅出的从中国人口全基因组的生殖拷贝数的突变入手进一步揭示了CNV的突变通过snoRNA的差异表达来影响乙型肝炎病毒(HBV)相关的肝癌。
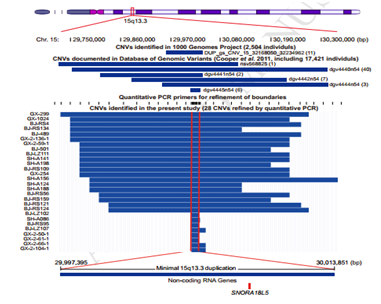
图5 15q13.3的拷贝数突变位点与SNORA18L5相吻合
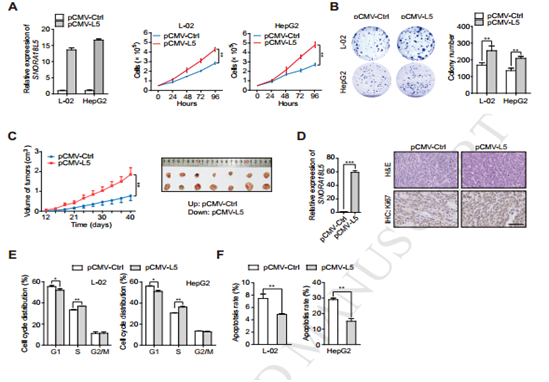
图6细胞与动物实验证明SNORA18L5与肿瘤细胞增殖的关系
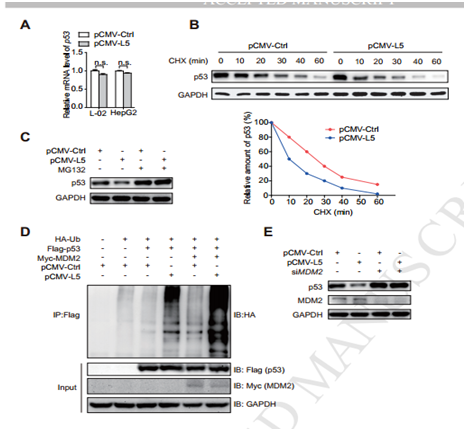
图7 SNORA18L5与MDM2以及抑癌基因P53
2)“AML1-ETO requires enhanced C/D box snoRNA/RNP formation to induce self-renewal and leukaemia”Nature Cell Biology 2017(IF:20.060) [21]
白血病发生需要增强由致癌基因引起的自我更新。其潜在的分子机制尚不完全清楚。本文确定C/D box snoRNAs和rRNA甲基化是白血病干细胞活性的关键决定因素。Aes基因在有融合基因AML1-ETO, PML-RARα和PLZF-RARα的白血病中高表达,但是其功能和机制一直是未知的。研究者通过老鼠模型和细胞系实验,发现Aes对肿瘤细胞的自我更新能力是至关重要的。研究者通过RNA-seq对比Aes(癌基因)缺失前后转录组的变化,意外发现大量的snoRNA下调,而在过表达Aes后snoRNA表达量显著上升,这说明Aes能影响snoRNA的表达。有趣的是,研究者利用CRISPR技术敲除snoRNA后,发现即使是敲除单个snoRNA,rRNA的甲基化显著降低,并且抑制白血病细胞的克隆形成能力。这说明,snoRNA不仅是一类受癌细胞调控的非编码RNA,更参与了癌症的发生发展。AES通过与RNA解旋酶DDX21相互作用诱导snoRNA/RNP形成。
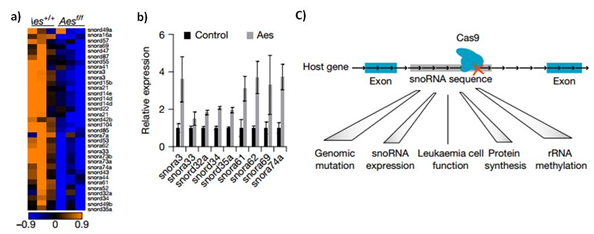
图8 Aes的缺失导致snoRNA的下调
3)“The noncoding RNAs SNORD50A and SNORD50B bind K-Ras and are recurrently deleted in human cancer” Nature genetics 2016 (IF=27.125) [20]
研究人员发现一对原以为只是充当细胞管家的RNA分子,在超过四分之一的常见人类癌症中缺失。研究人员比较了21种不同癌症类型中的5,473个肿瘤基因组及周围正常组织的基因组。研究人员发现在12种常见人类癌症,包括皮肤癌、乳腺癌、卵巢癌、肝癌和肺癌中,10-40%的肿瘤缺失一对称作为SNORD50A/B的snoRNAs。在人类黑色素瘤和肺癌细胞中删除SNORD50A/B时,细胞更快速地分裂,显示出更多的癌性状。
通过人类蛋白微阵列检测到SNORD50A/B能直接结合到KRAS蛋白,当SNORD50A/B结合KRAS时,它会抑制KRAS蛋白结合一种称作为法尼基转移酶(farnesyltransferase)的活化分子的能力。法尼基转移酶改变KRAS蛋白使得它能够去到细胞膜等待外部生长及分裂信号。SNORD50A与SNORD50B缺失能增加GTP结合的数目,激活K-Ras,以及增加法尼基转移酶结合到K-Ras并且促进K-Ras异戊二烯化,这些均揭示了K-Ras的突变与SNORD50A与SNORD50B缺失起协同作用。
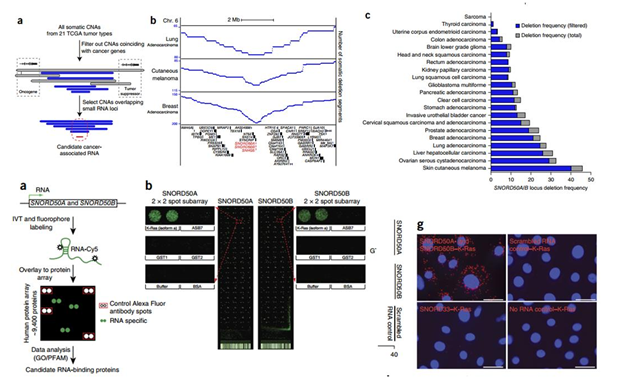
图9 多数据库分析SNORD50A/B在肿瘤中的缺失以及SNORD50A/B与KRAS蛋白的直接结合
参考文献
1.Esteller, M., Non-coding RNAs in human disease. Nat Rev Genet, 2011. 12(12): p. 861-74.
2. Kiss, T., et al., Biogenesis and intranuclear trafficking of human box C/D and H/ACA RNPs. Cold Spring Harb Symp Quant Biol, 2006. 71: p. 407-17.
3. Panse, V.G. and A.W. Johnson, Maturation of eukaryotic ribosomes: acquisition of functionality.Trends Biochem Sci, 2010. 35(5): p. 260-6.
4. Williams, G.T. and F. Farzaneh, Are snoRNAss and snoRNAs host genes new players in cancer? Nat Rev Cancer, 2012. 12(2): p. 84-8.1826(1): p. 121-8.
5.Thorenoor, N. and O. Slaby (2015). "Small nucleolar RNAs functioning and potential roles in cancer." Tumour Biol. 36(1): 41-53.
6.Makarova, J. A., S. M. Ivanova, et al. (2013). "New Functions of Small Nucleolar RNAs." Biochemistry 78(6): 638-650.
7. Thorenoor, N. and O. Slaby, Small nucleolar RNAs functioning and potential roles in cancer.Tumour Biol, 2015. 36(1): p. 41-53.
8. Huang, C., J. Shi, et al. (2017). "A snoRNA modulates mRNA 3′ end processing and regulates the expression of a subset of mRNAs." Nucleic Acids Research 45(15): 8647-8660.
9. Liu, Z.H., et al., Small ncRNA expression and regulation under hypoxia in neural progenitor cells.Cell Mol Neurobiol, 2011. 31(1): p. 1-5.
10. Ender, C., et al., A human snoRNAs with microRNA-like functions. Mol Cell, 2008. 32(4): p. 519-28.
11. Brameier, M., et al., Human C/D box snoRNAss with miRNA like functions: expanding the range of regulatory RNAs. Nucleic Acids Res, 2011. 39(2): p. 675-86.Cell Mol Neurobiol, 2011. 31(1): p. 1-5.
12. Michel, C.I., et al., Small nucleolar RNAs U32a, U33, and U35a are critical mediators of metabolic stress. Cell Metab, 2011. 14(1): p. 33-44.
13. Chow, R. and S. Chen (2018). "Sno-derived RNAs are prevalent molecular markers of cancer immunity." Oncogene.
14. Xing, Y.-H., Yao, R.-W., Zhang, Y., Guo, C.-J., Jiang, S., Xu, G., … Chen, L.-L. (2017). SLERT Regulates DDX21 Rings Associated with Pol I Transcription. Cell, 169(4), 664–678.e16.
15.Liao, J., et al., Small nucleolar RNA signatures as biomarkers for non-small-cell lung cancer. Mol Cancer, 2010. 9: p. 198.
16. Dong, X.Y., et al., Implication of snoRNAs U50 in human breast cancer. J Genet Genomics, 2009.36(8): p. 447-54.
17. Dong, X.Y., et al., SnoRNAs U50 is a candidate tumor-suppressor gene at 6q14.3 with a mutation associated with clinically significant prostate cancer. Hum Mol Genet, 2008. 17(7): p. 1031-42.
18. Mei YP, Liao JP, Shen J, Yu L, Liu BL, Liu L, et al. Small nucleolar RNA 42 acts as an oncogene in lung tumorigenesis. Oncogene.2012;31:2794–804
19. Su, H., T. Xu, et al. (2014). "Elevated snoRNA biogenesis is essential in breast cancer." Oncogene 33(11): 1348-1358.
20. Siprashvili, Z., D. E. Webster, et al. (2016). "The noncoding RNAs SNORD50A and SNORD50B bind K-Ras and are recurrently deleted in human cancer." Nature Genetics 48(1): 53-58.
21.Zhou, F., Y. Liu, et al. (2017). "AML1-ETO requires enhanced C/D box snoRNA/RNP formation to induce self-renewal and leukaemia." Nat. Cell Biol. 19(7): 844-855.
22. Mannoor, K., J. Liao, and F. Jiang, Small nucleolar RNAs in cancer. Biochim Biophys Acta, 2012.
23. Mei, Y.P., et al., Small nucleolar RNA 42 acts as an oncogene in lung tumorigenesis. Oncogene,2012. 31(22): p. 2794-804.
24. Gee, H.E., et al., The small-nucleolar RNAs commonly used for microRNA normalisation correlate with tumour pathology and prognosis. Br J Cancer, 2011. 104(7): p. 1168-77.
25. Xu, G., et al., Small nucleolar RNA 113-1 suppresses tumorigenesis in hepatocellular carcinoma.Mol Cancer, 2014. 13: p. 216.
26. Cao, P., Yang, A., Wang, R., Xia, X., Zhai, Y., & Li, Y., et al. (2018). Germline duplication of snora18l5, increases risk for hbv-related hepatocellular carcinoma by altering localization of ribosomal proteins and decreasing levels of p53. Gastroenterology, 155(2).
27. Nakatani, J., et al., Abnormal behavior in a chromosome-engineered mouse model for human 15q11-13 duplication seen in autism. Cell, 2009. 137(7): p. 1235-46.
28. Cullen, B.R., MicroRNAs as mediators of viral evasion of the immune system. Nat Immunol, 2013.14(3): p. 205-10.
29. Laufer, B.I., et al., Long-lasting alterations to DNA methylation and ncRNAs could underlie the effects of fetal alcohol exposure in mice. Dis Model Mech, 2013. 6(4): p. 977-92
30. Zhang, B., Han, D., Korostelev, Y., Yan, Z., Shao, N., & Khrameeva, E., et al. (2016). Changes in snorna and snrna abundance in the human, chimpanzee, macaque and mouse brain. Genome Biology & Evolution,8(3), 840-850.






