EXO1核酸酶活性在Exo1D173A小鼠基因组维持、免疫应答和肿瘤抑制中的作用
外切酶1 (EXO1)是一种多效进化保守的DNA外切酶,参与多种DNA修复途径、复制、抗体多样化和减数分裂。目前有研究发现EXO1在不同的DNA修复过程中同时具有支架和酶的功能,并表明EXO1在DNA代谢过程和疾病中具有更加复杂的作用。该研究发表于2022年7月发表在《NUCLEIC ACIDS RESEARCH》,IF:19.160
技术路线:
主要研究结果:
1. 构建核酸酶死亡的Exo1D173A小鼠
为了创建失活核酸酶死亡的EXO1突变,作者通过CRISPR/Cas9技术在C57BL/6雌性小鼠分离的受精卵中产生了一个新的携带EXO1D173A突变的敲入小鼠 (称为Exo1DA)。EXO1D173残基在裂变和出芽酵母以及小鼠和人类中都是进化保守的(图1A, B)。此外,对分解后的EXO1晶体结构的结构建模显示,残留物EXO1D173嵌入外切酶活性位点,并与DNA片段直接接触,这预测了EXO1核酸酶活性位点的显著异常是由于EXO1D173A突变的结果(图1C)。然而,这种扰动并不会影响蛋白质折叠和稳定性、DNA结合或MMR蛋白相互作用,这是由不同的结构域依赖性所证明的(图1B, C)。

图1 在小鼠中建EXO1突变模型
2. 在典型DDR中,EXO1的催化活性高于支架功能
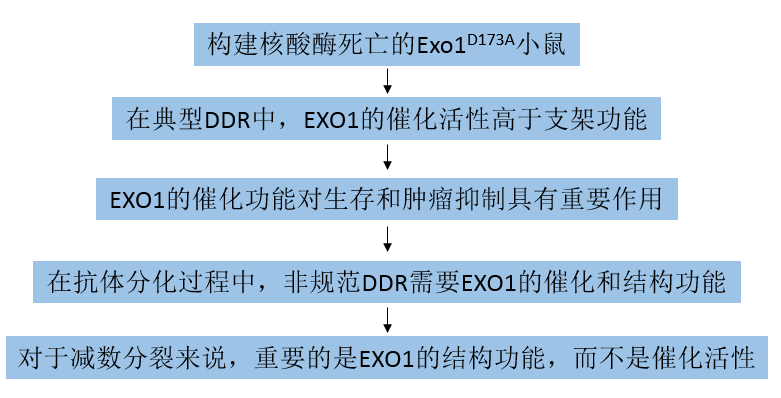
为了测定MMR在体内功能的完整性,将Exo1+/+、Exo1DA/DA和Exo1 - /-小鼠与BigBlue小鼠杂交,分析所有三个队列中肝脏和脾脏基因组DNA中cII报告基因的突变积累。结果显示,Exo1−/−和Exo1DA/DA突变小鼠的突变率均比Exo1+/+小鼠高2-3倍,从而证实了Exo1的催化作用对于哺乳动物细胞体内经典的无错误DNA错配修复至关重要(图2A)。为了研究EXO1在DSBR中的作用,从Exo1+/+、Exo1DA/DA和Exo1 - /-小鼠中建立了原代小鼠胚胎成纤维细胞(MEF),并量化了中期扩散中的染色体断裂(图2B)。然后,研究了过度磷酸化RPA (S4/S8-pRPA)和γH2AX的频率和灶内共定位,它们是PI3家族的DNA损伤激活蛋白激酶在DSBs上的反应,如ATM/ATR(图2C),其中Exo1−/−和Exo1DA/DA MEFs均显示激活的pRPA-S4/S8和γH2AX的共定位显著降低(图2C)。这些结果表明,CPT治疗导致DSB切除受损,并提示EXO1在有丝分裂细胞中DSBR过程中的催化活性起着关键作用。另外,与Exo1+/+ MEFs相比,Exo1−/−和Exo1DA/DA p53缺陷MEFs对MNNG处理的抗性增加,尽管在Exo1DA/DA突变体中表现得稍弱,但这表明在两种Exo1突变背景下,DDR信号传导效率低下(图2D)。这些结果表明,EXO1的核酸酶活性有助于MMR介导的DDR信号转导。
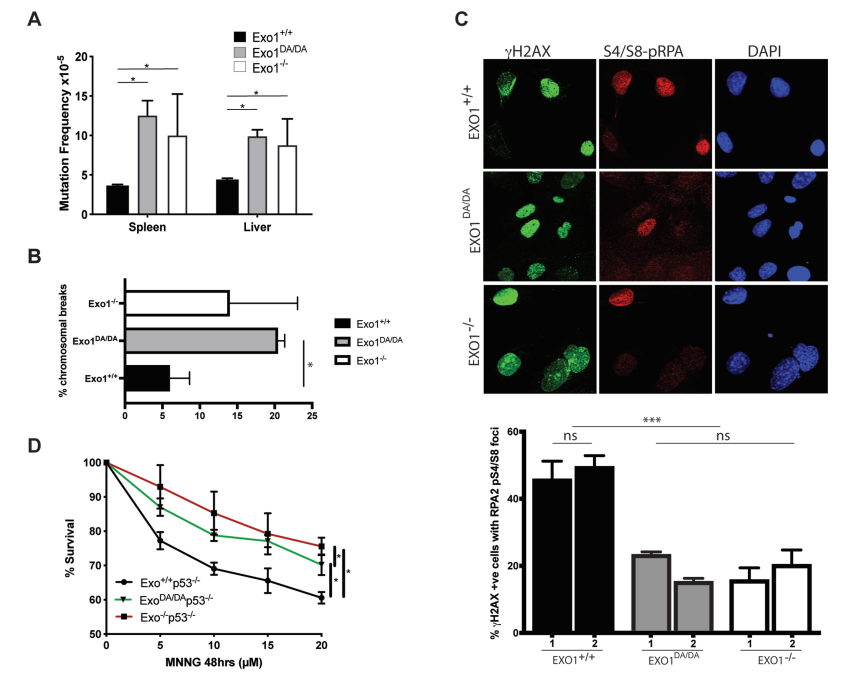
图2典型DDR需要EXO1体内的核酸酶活性
Exo1+/+小鼠在24月龄时有50%的小鼠存活,但Exo1−/−和Exo1DA/DA小鼠在16月龄时有50%的小鼠死亡,其存活率也有类似的下降(图3A)。Exo1−/−和Exo1DA/DA小鼠的加速死亡率原因是由于发病率相当的癌症易感性增加(图3B)。大多数Exo1DA/DA小鼠在6 - 22月龄期间死于淋巴瘤(58%,n = 14/24)(图3C, D)。Exo1−/−的肿瘤谱与Exo1DA/DA小鼠的肿瘤谱基本相同(图3C, D)。综上所述,这些结果表明完整的核酸酶活性对EXO1肿瘤抑制功能至关重要。
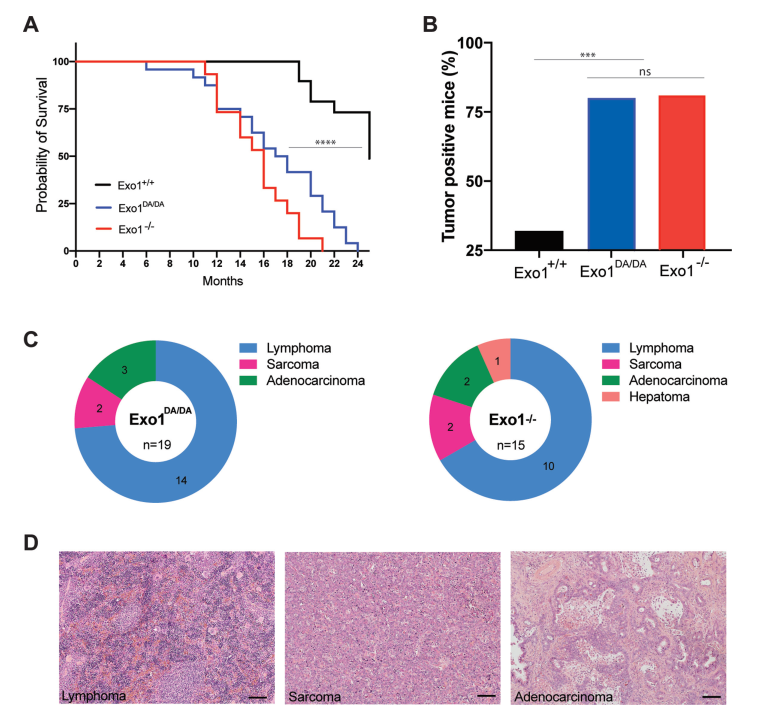
图3 EXO1核酸酶死亡突变体在肿瘤发生中的作用
4. 在抗体分化过程中,非规范DDR需要EXO1的催化和结构功能
为了描述EXO1结构和/或催化功能在SHM过程中的精确贡献,检查到EXO1+/+ (n = 7)、Exo1DA/DA (n = 8)和EXO1−/−(n = 3)队列中VH186.2重链可变区在初级免疫反应中的错误修复(图4A和B)。在Exo1−/−和Exo1DA/DA小鼠中,A:T和Pol热点位点的突变显著减少,但在G:C和AID热点位点的其余突变不仅受到限制,而且增加(图4A)。与完全缺失相比,突变的EXO1DA蛋白存在时,A:T位点易出错修复的后一种缺陷没有那么显著(图4A),这表明EXO1DA /DA B细胞中可能仍然存在一些中间支架功能。在两种Exo1受损模型中,虽然可以观察到A:T突变在VH186.2区域的传播减少,特别是在Pol热点区域,但Exo1−/−小鼠表现出更明显的表型改变,其仅剩的少量A:T突变分布在CDR2周围(图4B)。另一方面,在Exo1−/−和Exo1+/+小鼠中,CDR中G:C位点突变的总体分布和偏好保持不变,甚至在非热点G:C位点上有所增加(图4B)。总之,免疫球蛋白基因的体内SHM分析表明,Exo1的结构和酶功能共同作用,在AID诱导的U:G错配周围提供足够的易出错的MMR。
LPS和IL-4在体外诱导IgM到IgG1亚型转换(图4C)。与Exo1+/+组相比,两个Exo1突变组对IgG3和IgG1的CSR效果均显著降低(图4C和D),这表明Exo1核酸酶活性对CSR至关重要。Exo1DA/DA细胞中的Su-Sγ3连接与Exo1+/+或Exo1−/−细胞中的Su-Sγ3连接不同(图4E)。综上所述,这些结果似乎表明,虽然EXO1核酸酶活性有助于在CSR过程中促进微同源性介导的aNHEJ的末端切除机制,但在完全缺乏EXO1的情况下,一种催化死亡蛋白可能会干扰其他可能参与aNHEJ过程并部分补偿的因素。
图4 破坏EXO1或其核酸酶活性会损害抗体的多样性
5. 对于减数分裂来说,重要的是EXO1的结构功能,而不是催化活性
在我们所有的基因型队列中,MLH1和CDK2定位于交叉位点,CDK2另外定位于端粒(图5)。这些交叉标记仍然与SYCP3、染色体核心和/或端粒相关,其频率和强度在Exo1+/+、Exo1DA/+和Exo1DA/DA小鼠中是不可区分的(图5),表明正常的减数分裂进展通过前期I期。此外,通过分析和量化中期扩散,结果表明交叉染色体和二价染色体的数量在所有组中也具有可比性(图5)。综上所述,这些结果表明,在减数分裂过程中,EXO1核酸酶活性是可有可无的,而非其结构功能。
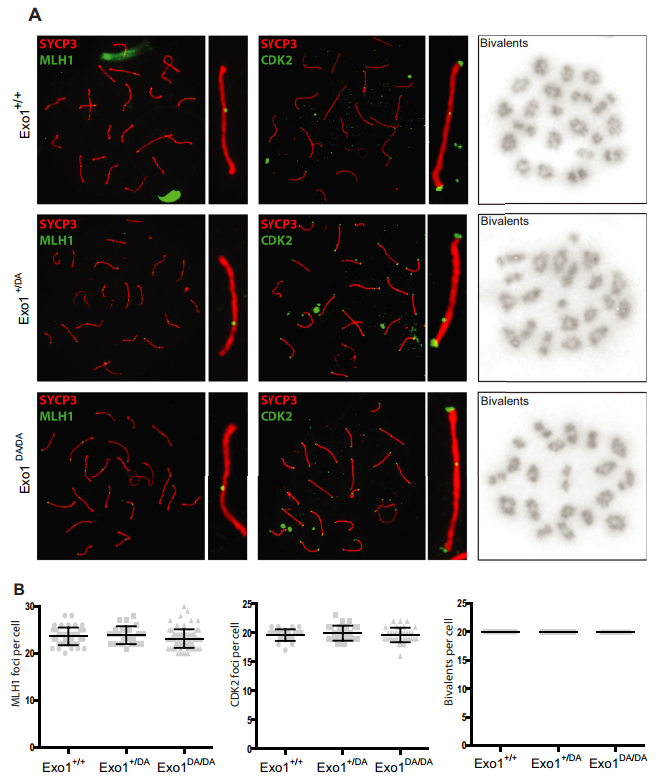
图5在精子发生过程中的减数分裂中,EXO1核酸酶活性是可有可无的
结论:
该研究表明EXO1根据其参与的过程和DNA修复过程的复杂性,在基因组维护中实现3层活性。一层主要依赖于EXO1的核酸酶功能,如典型的MMR和DSBR。另一层主要依赖于支架功能,如减数分裂,最后一层依赖于核酸酶和支架功能在B细胞非典型修复过程中的协同作用,以实现抗体多样化。
参考文献:
Wang S, Lee K, Gray S, Zhang Y, Tang C, Morrish RB, Tosti E, van Oers J, Amin MR, Cohen PE, MacCarthy T, Roa S, Scharff MD, Edelmann W, Chahwan R. Role of EXO1 nuclease activity in genome maintenance, the immune response and tumor suppression in Exo1D173A mice. Nucleic Acids Res. 2022:gkac616.






