外泌体来源的miR-130a通过靶向在血管内皮细胞中的C-MYB激活胃癌的血管生成
迁移是胃癌预后不良的重要原因。血管生成与肿瘤侵袭和迁移密切相关。癌症来源的外泌体在肿瘤微环境的建立中起重要作用。来自天津医科大学肿瘤医院的巴一、应国光团队在MOL THER(IF=7.008)在线发表了题为“Exosome-Derived miR-130a Activates Angiogenesis in Gastric Cancer by Targeting C-MYB in Vascular Endothelial Cells”。他们通过连续差速离心分离外泌体,并通过透射电子显微镜验证它们。用下游细胞功能实验评估人类静脉内皮细胞的生物学行为的变化。通过实时qPCR和蛋白质印迹确定miRNA靶基因的RNA和蛋白质水平。采用小鼠异种移植模型评估外来体衍生的miR-130a与体内肿瘤生长之间的相关性。我们证明外泌体通过在体内和体内靶向c-MYB将miR-130a从胃癌细胞递送到血管细胞中以促进血管生成和肿瘤生长。包装在癌细胞分泌的外泌体中的miR-130a可作为血管生成的驱动因子。因此,miR-130a可能是监测胃癌活性的潜在生物标志物。此外,抑制这些外泌体的表达或阻断其传播可能是一种新的胃癌抗血管生成治疗策略。
技术路线:
主要结果:
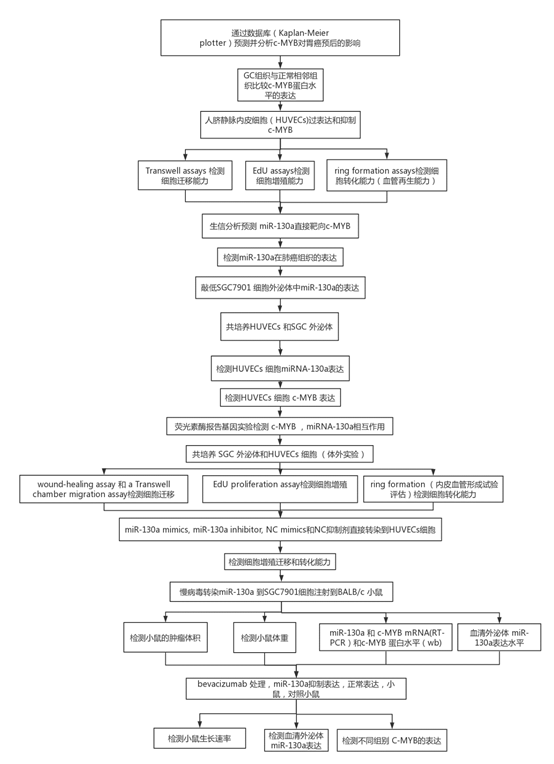
1 C-MYB表达水平与胃癌预后呈正相关,与正常的癌旁组织相比,C-MYB蛋白在胃癌组织中下调,与对照组相比,过表达c-MYB的HUVEC表现出降低的迁移,增殖和血管再生能力。 然而,MYB siRNA转染组中增强了HUVEC的生物学能力。c-MYB是作为miR-130a的预测的直接靶标,并且miR-130a在GC组织中上调。
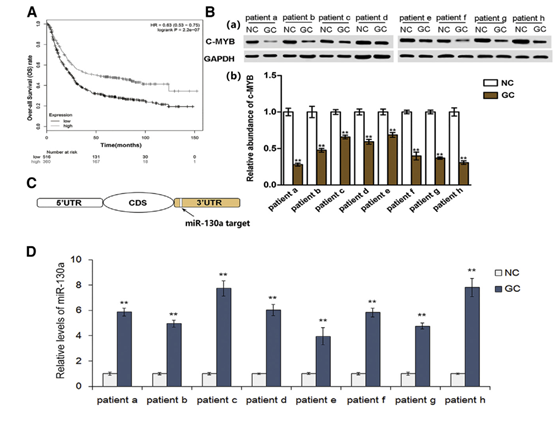
图1
(A)与c-MYB表达相关的GC的存活曲线。 p <0.001。 (B)蛋白质印迹分析(a)GC组织中c-MYB表达(n = 8)和相应的定量分析(b)。 (C)预测c-MYB mRNA的30UTR内miR-130a的结合位点。 (D)GC组织中miR-130a水平的qRT-PCR分析(n = 2)。 ** p <0.01。
2 外泌体将miR-130a转运到HUVECs并抑制c-MYB表达。
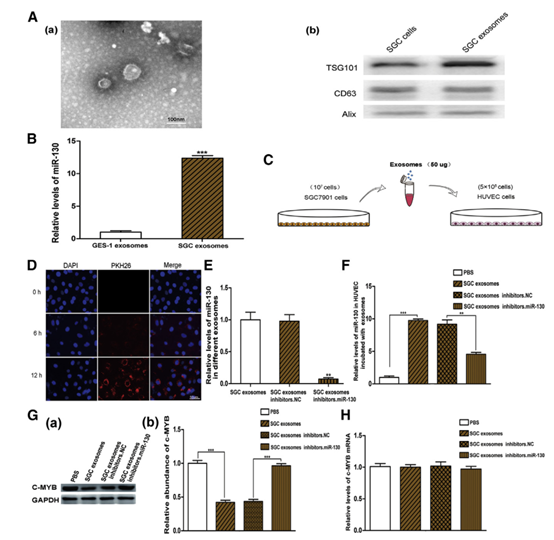
图2
(A)电子显微镜扫描(a)外泌体分离的7901细胞和蛋白质印迹分析(b)外泌体富集蛋白CD63和miRNA功能的关键蛋白,TSG101和Alix(n = 3)。 (B)通过qRT-PCR分析(n = 3)测定从GES-1细胞和SGC 7901细胞分离的外来体中miR-130a的水平。 (C)实验设计的示意图。 (D)HUVEC中荧光标记的外泌体内化的共聚焦显微镜图像。(E)分别在SGC外泌体,miR-130a敲除外泌体和NC外泌体中的miR-130a的qRT-PCR测定(n = 3)。 (F)通过qRT-PCR检测用不同外泌体预处理的HUVEC中的miR-130a水平(n = 3)。 (G)分别用SGC外泌体,miR-130a敲除外泌体和NC外泌体处理的HUVEC中的C-MYB表达(a),以及相应的定量分析(b)。 (H)用不同外泌体(n = 3)处理的HUVEC中c-MYB mRNA的相对水平。
3 c-MYB是miR-130a的直接靶标。
图3
(A)在c-MYB mRNA的3’UTR内预测的miR-130a的结合位点。 (B)miR-130a直接识别c-MYB 3 ’UTR。 (C和D)qRT-PCR分析用miR-130a类似物(C)(n = 3)和抑制剂(D)(n = 3)转染的HUVEC的相对miR-130a水平。(E)Western印迹分析( a)用miR-130a类似物和抑制剂(n = 3)处理的HUVEC中的c-MYB表达和相应的定量分析(b)。(F)qRT-PCR分析用miR-130a类似物和抑制剂处理的HUVEC中c-MYB mRNA水平的(n = 3)。 ** p <0.01。
4 体外证明SGC外泌体来源miR-130a具有促进血管生成的作用。
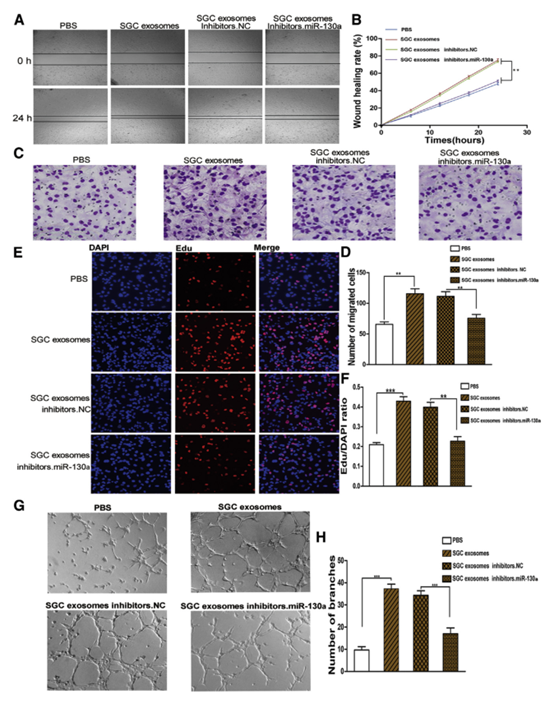
图4
(A)划痕试验测定证明SGC外源富集的miR-130a增加HUVEC迁移(n = 3)。 (B)(A)的定量分析。 (C)验证SGC外泌体衍生的miR-130a通过transwell测定增强HUVEC的迁移能力(n = 3)。 (D)(B)(n = 3)的定量分析。 (E)EdU分析显示SGC外泌体促进HUVEC的增殖(n = 3)。 (F)(E)的定量(n = 3)。 (G)通过与SGC外泌体共孵育(n = 3)增强HUVEC中环形成的能力。 (H)(G)的定量(n = 3)。 ** p <0.01和*** p <0.001。
5 miR-130a可以直接促进HUVECs的生物学功能。
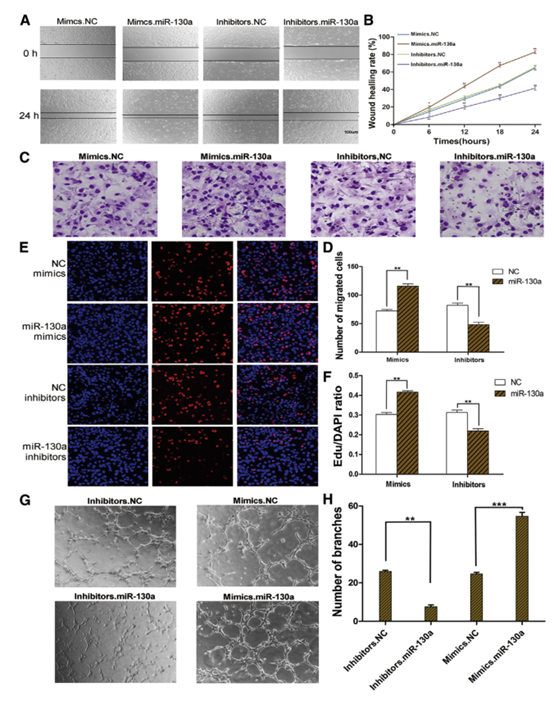
图5
(A)划痕试验显示miR-130a促进HUVEC的迁移(n = 3)。 (B)(A)(n = 3)的定量分析。(C)通过transwell测定验证miR-130a介导的细胞迁移(n = 3)。 (D)(C)的定量分析(n = 3)。 (E)EdU测定证明miR-130a增强HUVEC的增殖(n = 3)。 (F)(E)的定量分析(n = 3)。 (G)miR-130a增加HUVEC中环形成的能力(n = 3)。 (H)定量分析(G(n = 3)。
6 体内验证外泌体来源的miR-130a在血管生成和肿瘤生长中的作用。
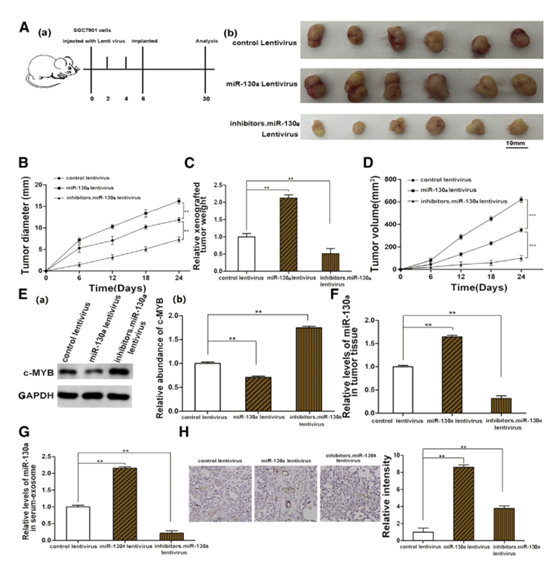
图6
(A)流程图(a)描绘了从肿瘤植入小鼠切除的肿瘤组织的体内实验设计和形态(b)( n = 6)。 (B-D)异种移植肿瘤直径(B),重量(C)和体积(D)(n = 6)的定量分析。(E)C-MYB表达(a)在植入的肿瘤中(n = 6)和相应的定量(b)。 (F)植入肿瘤中miR-130a的qRT-PCR分析(n = 6)。 (G)从肿瘤植入小鼠的血清中分离的外来体中的miR-130a的水平(n = 6)。 (H)使用CD31抗体(n = 6; CD31广泛用于证明内皮组织的存在和评估肿瘤血管生成)和相应的定量(b)的石蜡包埋的肿瘤组织的免疫组织化学分析(a)。






