LncRNA通过自噬保护机制促进癌症发生相关研究策略
有缺陷的自噬被认为有助于包括癌症等许多疾病的发病机制。PVT1(plasmacytoma variant translocation 1 ,)是一种致癌的长非编码RNA,已被鉴定为胰腺导管腺癌的预后生物标志物,但PVT1如何在胰腺导管腺癌(PDA)自噬调节中起作用尚不清楚。近日在MOL CANCER(IF=7.776)发表了题为“LncRNA PVT1 triggers Cyto-protective autophagy and promotes pancreatic ductal adenocarcinoma development via the miR-20a-5p/ULK1 Axis”。研究人员通过定量实时聚合酶链反应(qRT-PCR)和原位杂交(ISH)检测PVT1表达水平。进行蛋白质印迹或qRT-PCR以评估ULK1蛋白质或mRNA水平。在共聚焦显微镜下通过自噬通量检测和在透射电子显微镜(TEM)下的自噬泡液研究来探索自噬。 PVT1在自噬和PDA发育中的生物学作用是通过功能获得和功能丧失测定来确定的。我们发现PVT1水平与PDA癌组织中的ULK1蛋白平行。 PVT1通过在体外和体内靶向ULK1促进细胞保护性自噬和癌细胞生长。此外,高PVT1表达与不良预后相关。此外,他们发现PVT1作为“海绵体”调节miR-20a-5p,从而影响ULK1的表达和胰腺导管腺癌的发展。他们的研究表明,“PVT1 / miR-20a 5p / ULK1 /自噬”途径调节胰腺导管腺癌的发展,可能是开发胰腺导管腺癌治疗策略的新靶点。
技术路线:
主要结果:
1 ULK1蛋白水平和人PDA组织的PVT1表达正相关。
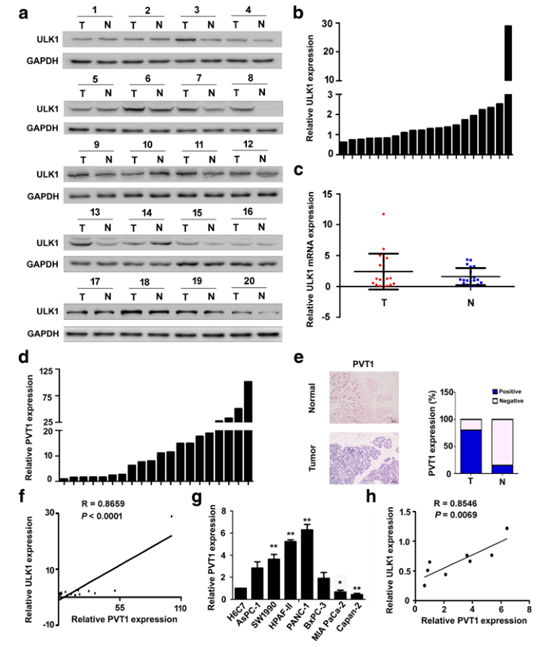
图1 ULK1蛋白水平与人PDA组织中PVT1蛋白水平正相关。
a Western blot分析PDA组织及相应的邻近非肿瘤胰腺标本(n=20)中ULK1蛋白的表达(n=20)。b a的定量。c 20个PDA组织中ULK1 mRNA水平与对应的邻近非肿瘤胰腺标本相比无统计学意义。d 基于qRT-PCR的20例PDA患者PDA组织中PVT1的表达。e 基于ISH分析的PDA组织中PVT1的表达以及不同组中PVT1阳性样本的百分比。f 20个PDA组织中PVT1 mRNA表达水平与ULK1蛋白表达水平呈正相关。g qRT-PCR检测PDA细胞系中PVT1 mRNA水平。h PDA细胞系中PVT1 mRNA表达量与ULK1蛋白表达量呈正相关。
2 体外验证PVT1通过上调ULK1蛋白诱导自噬。
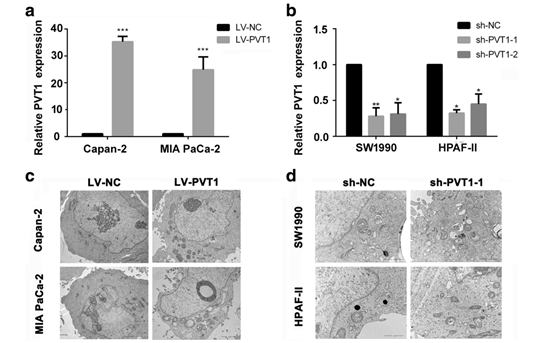
图2 PVT1对PDA细胞自噬的调控中起作用。
a PVT1在Capan-2和MIA PaCa-2细胞中通过特异性慢病毒转染过表达. b在SW1990和HPAF-II细胞中,特异性sh-RNAs明显抑制b PVT1水平。c透射电镜观察PVT1在Capan-2和MIA PaCa-2细胞中超微结构是否上调。d有或没有下调PVT1在SW1990和HPAF-II细胞中的超微结构变化。
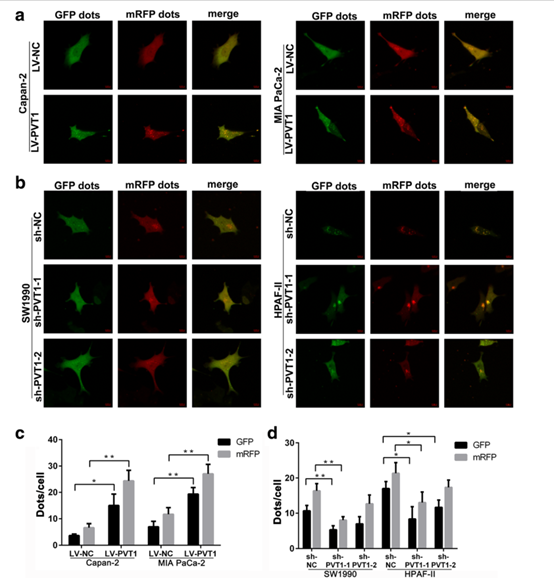
图3 有或无PVT1调节的GFP-LC3的点状检测。
a, b pvt1过表达细胞(Capan-2和MIA PaCa-2)中GFP-LC3 (a)和pvt1 -下调细胞(SW1990和HPAF-II) (b);PVT1过表达细胞(Capan-2和MIA PaCa-2)中GFP LC3的c、d定量(c)和PVT1下调细胞(SW1990和HPAF-II) (d)。同时,PVT1的下调降低了GFP-LC3点状的数量。
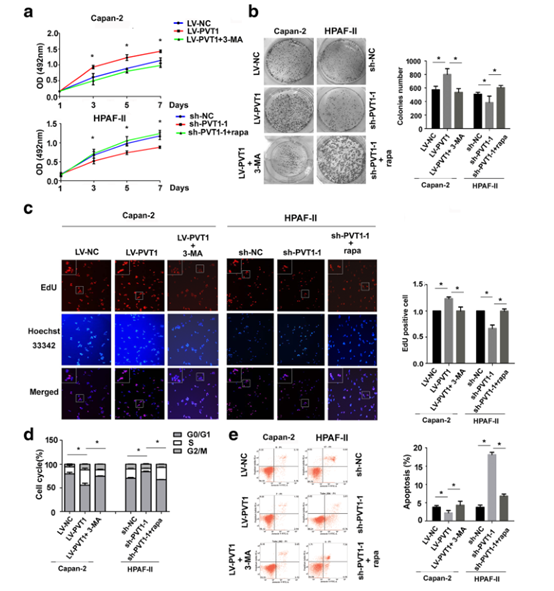
图4 PVT1在体外细胞保护自噬和PDA细胞生长中起重要作用。
a MTS测定表明PVT1的上调增强了Capan-2细胞中的细胞生长。在与自噬抑制剂(3-MA)温育后观察到生长受损。同时,PVT1的下调抑制了HPAF-II细胞中的细胞生长。用自噬诱导剂治疗后发生生长恢复(下); b克隆形成试验表明,增加的PVT1表达促进了Capan-2细胞的细胞增殖。然而,3-MA减少了PVT1过表达细胞中的细胞增殖。PVT1表达降低抑制了HPAF-II细胞中的细胞增殖。自噬诱导剂处理后观察到细胞生长的挽救; c EdU测定细胞增殖; d在Capan-2细胞中过表达PVT1后,有丝分裂S期细胞的百分比增加。与3-MA孵育后发生百分比降低。 PVT1的表达减少减少了HPAF-II细胞中的S期细胞。自噬诱导剂诱导自噬后发生S期挽救; e在Capan-2细胞中上调PVT1后,抑制细胞凋亡。
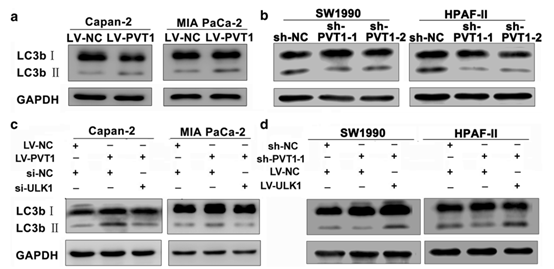
图5 PVT1通过调节ULK1实现自噬。
a在有或没有PVT1上调的Capan-2和MIA PaCa-2细胞中LC3b的WB分析。 b PVT1下调后LC3b II表达降低; c在PVT1稳定表达的Capan-2和MIA PaCa-2细胞中LC3b的WB分析,敲低 ULK1后检测到LC3b II表达的抑制; d在PVT1-knowndown SW1990和HPAF-II细胞中恢复ULK1表达后,LC3b II表达被挽救。
3 体内验证PVT1水平对PDA肿瘤生长产生影响。
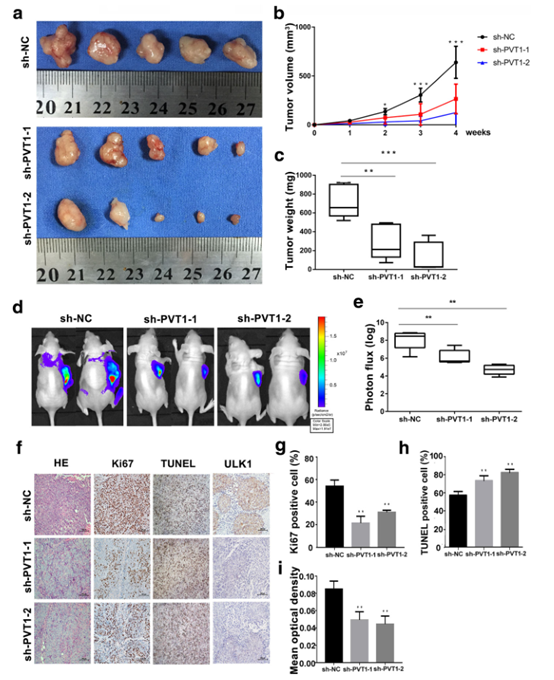
图6 抑制PVT1抑制体内PDA的生长。
a HPAF-II细胞中PVT1的下调抑制了体内4周后肿瘤的生长(每组n= 5)。b、c生长曲线(b)和肿瘤重量(c)。d、ePVT1表达降低明显降低PDA肿瘤生长;采用IVIS皮下注射pvt1 -沉默HPAF-II细胞后,异种移植瘤的典型图像(d)和光子内流(e)。f HE染色、TUNEL染色、Ki67、ULK1免疫组化染色; Ki67 (g)、TUNEL (h)和ULK1 (i)的定量。
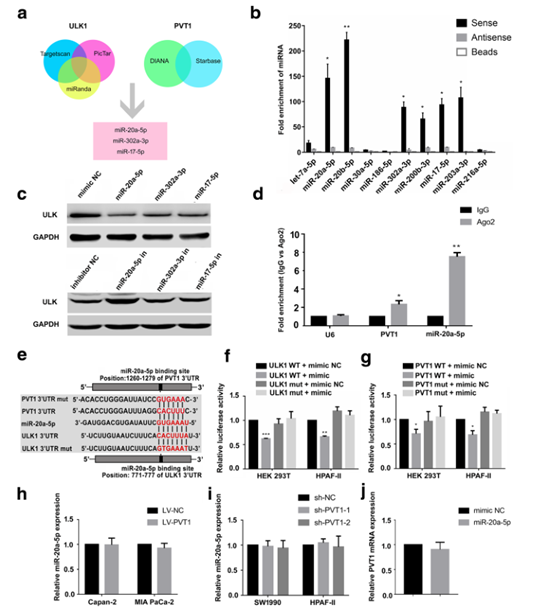
图7 PVT1通过吸附miR-20a-5p调节ULK1表达。
a软件预测靶向PVT1 3'UTR和ULK1 3'UTR的microRNA。b PVT1 pull down。cWB分析有或没有过表达或抑制靶miRNA(miR 20a-5p,miR-302a-3p,miR-17-5p)的HPAF-II细胞中ULK1表达。d进行RIP测定和qRT-PCR,检测HPAF-II细胞中AGO2抗体对PVT1和miR-20a-5p的富集。e使用TargetScan 预测miR-20a-5p和PVT1结合位点,使用Starbase预测ULK1 3’UTR 序列中miR-20a-5p结合位点。f双荧光素酶测定显示,共转染psiCHECK-ULK1-WT和miR-20a-5p时, g荧光素酶报告基因测定显示,用psiCHECK-PVT1-WT和miR-20a-5p共转染; h,miR-20a-5p的qRT-PCR分析。细胞中PVT1表达的增加(h)细胞中PVT1表达的降低(i); j miR-20a-5p的过表达对PVT1表达水平没有贡献。
4 PVT1在PDA中的表达及其与患者预后呈负相关。
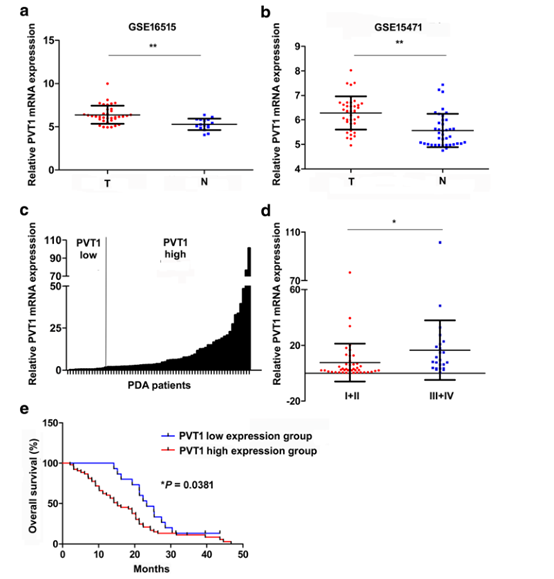
图8 PVT1在PDA中上调,与PDA进展相关并预测预后。
a,b PDA患者中PVT1的GSE16515(a)和GSE15471(b)数据表达谱。 c PVT1在68例PDA患者中的表达。 d与I + II期患者(n = 44)相比,III + IV期患者(n = 24)PVT1表达上调。e PVT1的高表达预示着68名PDA患者的预后不良。






