高分文章揭示,CAFs外泌体miRNA介导肿瘤耐药
顺铂耐药是晚期头颈部肿瘤(HNC)的一大挑战,为攻克晚期头颈部肿瘤(HNC)的难关,了解顺铂耐药的潜在机制成为了当务之急。
2019年1月14日,上海交通大学医学院附属第九人民医院在《Genome Biology》杂志上发表了题为“Exosomal miR-196a derived from cancerassociated fibroblasts confers cisplatin resistance in head and neck cancer through targeting CDKN1B and ING5”的文章,IF=13.21。
这项研究揭示了CAF衍生外泌体miR-196a赋予 HNC顺铂耐药的原理,并为miR-196a可能作为HNC中顺铂耐药的预测因子和潜在治疗靶点提供了理论基础。
背景:顺铂耐药是晚期头颈部肿瘤(HNC)的一大挑战。临床迫切需要了解顺铂耐药的潜在机制,并制定有效的策略。然而,肿瘤间质如何调控HNC生长和耐药尚不清楚。
结果:我们发现癌相关成纤维细胞(CAFs)对顺铂具有固有的耐药性,并通过将将功能外泌体miR-196a从CAFs传递到肿瘤细胞,从而在调控HNC细胞的存活和增殖方面发挥积极作用。然后,外泌体miR-196a结合新的靶细胞CDKN1B和ING5,赋予HNC细胞顺铂耐药性。CAFs损耗的外泌体或外泌体miR-196a功能性地恢复HNC的顺铂敏感性。重要的是,我们发现miR-196a 包装成CAF衍生外泌体可能是由异质性核核糖核酸蛋白A1 (hnRNPA1)介导的。此外,我们还发现,高水平的血浆外泌体miR-196a在临床上与较差的总体生存率和化疗耐药性相关。
结论:本研究发现,CAF衍生外泌体miR-196a通过靶向CDKN1B和ING5赋予 HNC顺铂耐药,这提示我们miR-196a可能作为HNC中顺铂耐药的预测因子和潜在治疗靶点。
研究结果:

Fig. 1 HNC衍生的CAFs对顺铂具有天然的耐药特性。
a 免疫荧光染色,α-SMA FAP, FSP1 在NFs和CFAs 的表达(比例尺,20μm)。 b 免疫印迹分析α-SMA、FAP和FSP1在六个配对NFs和CAFs的蛋白质含量 。c NFs、CAFs和HNC细胞有无被10μM顺铂治疗8天,并且测量细胞生存能力获得细胞生存和规范化的百分比控制细胞。d NFs、CAFs和HNC细胞有无被10μM 顺铂治疗24 h,并且检测细胞生存能力来计算在顺铂治疗下增殖细胞的百分比。e在10μM顺铂治疗8天的条件下,存活的CAFs的百分比(CAF3)和有顺铂耐药性HN4-res细胞,表现出相似的保留扩散率。 f, g蛋白质印记检测NFs、CAFs、CAL 27、sc -25、HN4、HN4-res细胞中MRP2、ATP7B、CTR1、XIAP、ERCC1、ERCC4、GSTK1、Bcl-2蛋白水平。并对频带强度进行评估。(ns, 无显著性差异; *p < 0.05; **p < 0.01; ***p<0.001; ****p < 0.0001)
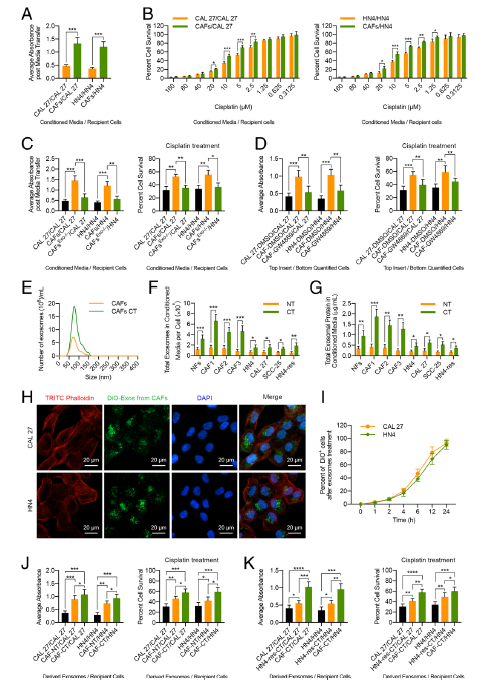
Fig. 2 CAF衍生的外泌体增加HNC细胞增殖和顺铂耐药。
a分别在CAF -CM和对照CM中培养CAL 27 和 HN4细胞6天,观察细胞存活率。b分别在CAF -CM和对照CM中培养CAL 27和HN4细胞6天,然后进行MTT检测这些细胞的顺铂反应。c,在对照CM、ca -CM或外泌体缺失的ca -CM中分别在对照CM、CAF-CM或者外泌体损耗的CAF-CM中培养c27和HN4细胞6天,并检测细胞存活率。采用MTT法检测这些细胞对顺铂的耐受性。d, 将HNC细胞与DMSO处理的HNC细胞、DMSO处理的 CAFs或GW4869处理的CAFs共培养6天,然后评估HNC细胞的存活率。采用MTT法测定顺铂治疗后共培养HNC细胞的存活率。e采用NanoSight粒子追踪分析CAFs或顺铂治疗的CAFs的粒度分布和数量 f采用NanoSight粒子追踪分析NFs, CAFs, 和有或没有接受顺铂(10 μM)治疗的 HNC 细胞的数量。 g来自NFs、CAFs,和有或没有接受顺铂(10μM)治疗的HNC细胞中CM的核外蛋白质浓度。 h用来自CAFs的 DiO外泌体示踪(25 μg/mL)液培育CAL 27和 HN4细胞24 h,并使用共焦显微镜(比例尺,20μm)检测绿色的外泌体信号。 i流式细胞检测分析按照规定时间在来自CAFs的 DiO外泌体示踪(25 μg/mL)液中培育的Dio阳性CAL 27 or HN4 cells细胞。 j 用来自HNC细胞, CAFs, 或者顺铂(10 μM)治疗的CAFs的外泌体(25 μg/mL) 处理HNC细胞 6天。检测细胞活力,并进行MTT检测,以鉴定这些细胞的顺铂反应。k 用来自HNC 细胞,顺铂(10 μM)治疗的HN4-res细胞,或者 顺铂治疗的(10 μM) CAFs 的外泌体(25 μg/mL) 处理HNC细胞6天。用MTT法测定这些细胞的存活率和存活率。(NT, 没有顺铂治疗; CT, 顺铂治疗; ns, 无显著差异; *p < 0.05; **p < 0.01; ***p<0.001; ****p < 0.0001)
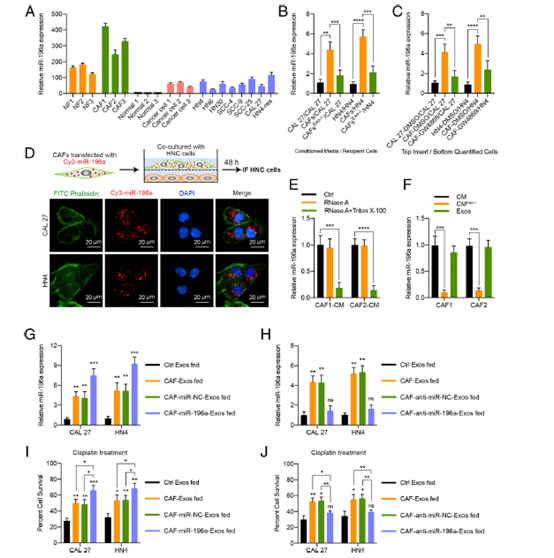
Fig. 3 miR-196a从CAFs外体转移到HNC细胞。
a采用real-time PCR技术分析miR-196a在NFs、CAFs、正常口腔上皮细胞(冠名正常)、原发性癌细胞和HNC细胞系中的表达。 b 将CAL27和HN4细胞分别在对照CM、CAF-CM或外泌体损耗的CAF -CM中培育24 h, 使用real-time PCR检测细胞中miR-196a的表达水平。c 将CAL 27和 HN4细胞与DMSO-处理的HNC 细胞, DMSO处理的CAFs,或者GW4869处理的CAFs共培养24 h,然后使用 real-time PCR检测miR-196a在HNC细胞中的表达水平。 d 被 Cy3标记的miR-196a (Cy3-miR-196a) 暂时性转染的CAFs与CAL 27或HN4细胞共培养48 h。用荧光显微镜来检测HNC细胞内的红色荧光信号(比例尺,20μm)。 e 使用Real-time PCR分析miR-196a在被RNase A (2mg/mL)单独处理或与Triton X-100 (0.1%) 联合处理 20分钟的CAF-CM t内的表达。f Real-time PCR分析miR-196a在来源于CAFs的外泌体、外泌体损耗的CM和整个CM中的表达。g被来源于HNC细胞 (Ctrl Exos),CAFs, 或者有或没有被miR-196a模仿 转染的CAFs 外泌体(25 μg/mL)培育24h后用real-time PCR检测miR-196a在CAL 27和 HN4细胞内的表达。 h被来源于HNC细胞 (Ctrl Exos) ,CAFs, 或者有或没有被anti-miR-196a转染的CAFs 外泌体 (25 μg/mL) 培育24h后用real-time PCR检测miR-196a在CAL 27和 HN4细胞内的表达。 i, j and the cisplatin response in these cells was determined with MTT assays. 用指定的外泌体(25 μg/mL)处理CAL 27和HN4细胞6天,用MTT检测这些细胞的顺铂反应。(ns, 无显著性差异; *p < 0.05; **p < 0.01; ***p<0.001; ****p < 0.0001)
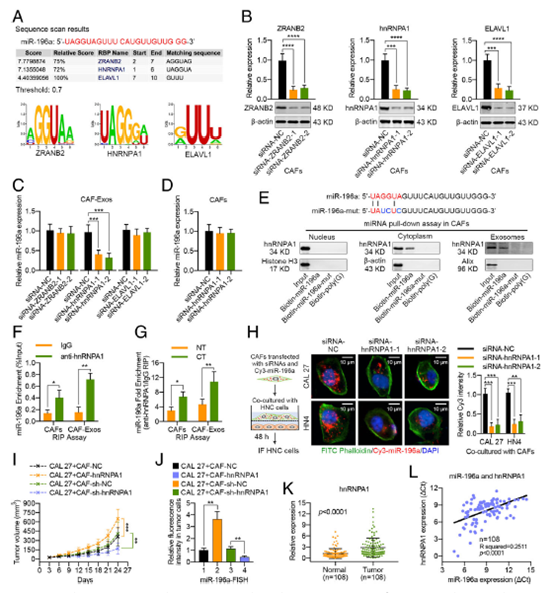
Fig. 4 hnRNPA1蛋白介导miR-196a包装成CAF衍生的外泌体。
a 通过RBPDB分析预测miR-196a序列与RBP 基序之间的特异性相互作用(阈值0.7)。 b转染特异性siRNAs 48 h后,ZRANB2、hnRNPA1和ELAVL1在CAFs中的表达水平的蛋白印记和real-time PCR结果显示。 c用real-time PCR检测特定siRNAs 靶向转染ZRANB2、hnRNPA1或ELAVL1的CAFs外泌体中miR-196a的表达。 d Real-time PCR分析显示miR-196a在hnRNPA1沉默的CAFs中表达。e蛋白印记对于 hnRNPA1在由细胞核miRNA下调、细胞质、外泌体CAFs裂解物以及生物素化指示的miR-196a或突变miR-196a衍生的样品中的表达分析;生物素化聚(G)作为阴性对照。 f 用 anti-hnrnpa1抗体(或IgG作为对照)对细胞或体外溶出物进行RIP检测。real-time PCR检测免疫沉淀样品中miR-196a水平,并报告其相对于输入样品的百分比(%输入)。 g RIP法测定经顺铂处理或不经顺铂处理的CAFs细胞质或外体裂解物中miR-196a相对于IgG的hnRNPA1富集。h 在同时被Cy3-miR-196a 和 特定的 siRNAs 靶向hnRNPA1转染的CAFs 中共培养CAL 27和HN4细胞48 h。用荧光显微镜是检测HNC细胞中的红色荧光信号(比例尺,10μm)。 i用混合的CAL 27细胞加hnRNPA1、sh-NC或sh-hnRNPA1转染的CAFs进行裸鼠皮下异种移植,显示肿瘤生长曲线和肿瘤体积。 j FISH法检测miR-196a在异种移植瘤中的分布情况,并检测miR-196a在肿瘤细胞中的表达情况。 k 108对HNC样本及邻近正常组织中hnRNPA1 mRNA表达水平。HNC组织中miR-196a表达与hnRNPA1表达的l相关性分析(n = 108) (NT, 未经顺铂治疗; CT, 顺铂治疗; *p< 0.05; **p < 0.01; ***p < 0.001; ****p < 0.0001)
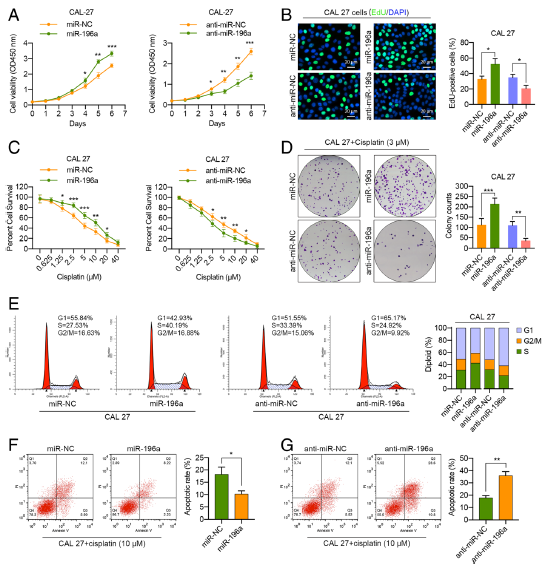
Fig. 5 miR-196a通过促进G1/S的过渡和凋亡抗性来调控HNC细胞的增殖和存活。
a miR-196a或anti-miR-196a转染48 h后,用CAL 27细胞进行细胞增殖检测。 b miR-196a或anti-miR-196a转染48 h后,具有代表性的显微图和包含edu合并细胞的定量。 c MTT法检测miR-196a或anti-miR-196a转染48 h的CAL 27细胞,然后在指定浓度下顺铂处理72 h。 d顺铂(3μM)治疗条件下被miR-196a和anti-miR-196a转染的CAL 27细胞的平板集落形成试验。 e转染48 h后,流式细胞仪分析miR-196a或anti-miR-196a转染的CAL 27细胞的细胞周期分布。f, g在miR-196a和anti-miR-196a转染的CAL 27细胞转染48 h后,使用流式细胞术分析顺铂(10μM)诱导的细胞凋亡。(*p < 0.05; **p < 0.01; ***p < 0.001)
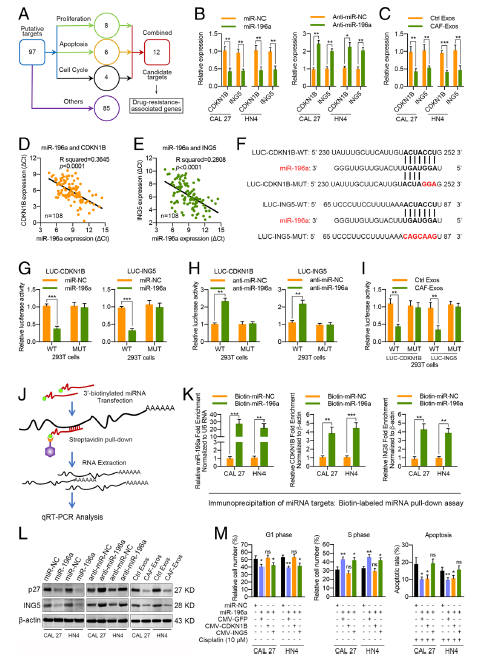
Fig. 6 CDKN1B和ING5是HNC细胞外泌体miR-196a的直接靶细胞。
a基因本体论分析miR-196a预测候选靶基因示意图。 b miR-196a或anti-miR-196a转染 48 h后,CDKN1B和ING5 mRNA在CAL 27和HN4细胞中的表达。 c在HNC 细胞 (Ctrl Exos) 和 CAFs分泌.的外泌体 (25 μg/mL)内培育48h后CAL 27 and HN4细胞内的CDKN1B 和ING5 mRNA水平 d, e HNC组织中miR-196a表达与CDKN1B或ING5表达的相关性分析(n = 108)。 f 预测CDKN1B和ING5基因3’UTRs中miR-196a靶序列。g miR-196a和荧光素酶报告基因共转染293T细胞后,CDKN1B或ING5报告基因的相对活性。h anti-miR-196a 对293T细胞内CDKN1B或ING5报告基因荧光素酶活性的影响。i f CAF衍生外泌体 (25 μg/mL) 对293T细胞内CDKN1B或ING5报告基因荧光素酶活性的影响。j显示miRNA靶细胞免疫沉淀程序的图表。 k 靶转录本与miR-196a的相互作用。用生物素化的miRNC或miR-196a 转染CAL 27或HN4细胞48 h。通过real-time PCR和 规范化的β-actin分析 CDKN1B和ING5 mRNA在被biotin-miR-196a下拉的材料中的水平。 l. p27 and ING5 expression in the indicated cells miR-196a 或 anti-miR-196a转染,或用CAF衍生外泌体 (25 μg/mL)培育的CAL 27和 HN4细胞24h。用蛋白质印记检测指定细胞内p27和ING5表达。 m转染48 h后,被miR-NC, 加上控制向量的 miR-196a r, 加上CDKN1B质粒的miR-196a, 或者加上ING5 质粒miR-196a的转染的HNC细胞细胞周期和顺铂诱导细胞凋亡分析的结果。(ns, 无显著性差异; *p < 0.05; **p < 0.01; ***p < 0.001)
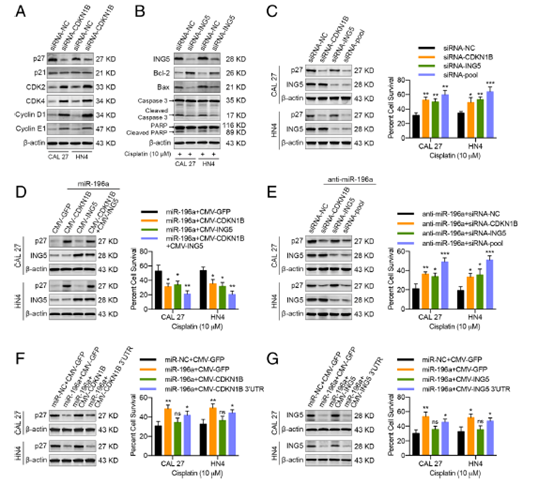
Fig. 7 miR-196a通过下调CDKN1B和ING5,加速HNC细胞对顺铂的耐药。
a 蛋白质印迹检测显示CDKN1B特异性转染siRNA 48 h后,CAL l27和HN4细胞中p27、p21、CDK2、CDK4、Cyclin D1和Cyclin E1的蛋白水平。 b蛋白质印迹检测显示ING5特异性转染siRNA 48 h后,CAL 27和HN4细胞中ING5、Bcl-2、Bax、全长Caspase 3、裂解的Caspase 3、全长PARP和裂解的PARP的蛋白水平。 c 左图: transfection with siRNAs specific for CDKN1B or ING5. 蛋白质印迹检测显示siRNAs特异性转染CDKN1B或ING5 48小时后,CAL 27和HN4细胞中p27和ING5的蛋白水平。 右图:如图所示,MTT法显示转染48小时后CAL 27和HN4细胞顺铂反应。 d 左图:蛋白质印迹检测显示同时转染miR-196a和外源性表达载体(CDKN1B或ING5) 48 h后,CAL 27和HN4细胞中p27和ING5的蛋白水平。.右图:如图所示,转染48小时后,CAL 27和HN4细胞的顺铂反应。e左图:蛋白质印迹检测显示转染anti-miR-196a和针对于CDKN1B或ING5的 siRNAs 48 h后,CAL 27和HN4细胞中p27和ING5的蛋白水平。右图:如图所示,转染48小时后,CAL 27和HN4细胞的顺铂反应。f 左图: 蛋白质印迹检测显示转染miR-196a和外源性表达载体(CDKN1B或CDKN1B 3’UTR) 48 h后,CAL 27和HN4细胞中p27蛋白水平。 右图: 如图所示,转染48小时后,CAL 27和HN4细胞出现顺铂耐药性。G左图:蛋白质印迹检测显示被miR-196a和外源性表达载体(ING5或ING5 3’UTR) 转染48 h后,CAL 27和HN4细胞中ING5的蛋白水平。右图:如图所示,转染48小时后,CAL 27和HN4细胞出现顺铂耐药性。 (ns,无显著性差异; *p < 0.05; **p < 0.01; ***p < 0.001)
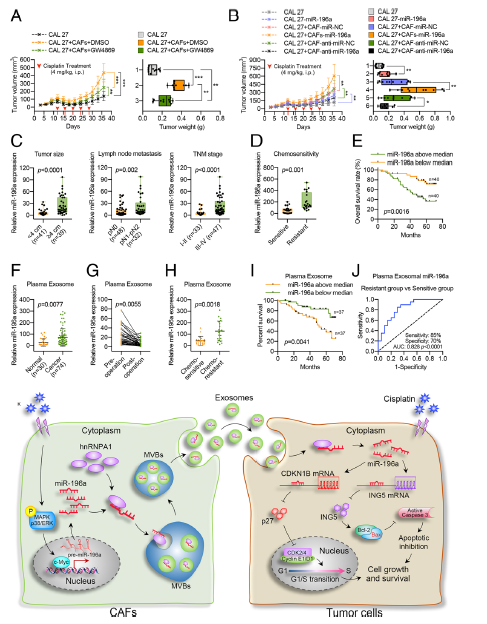
Fig. 8 CAF 衍生的外泌体miR-196a在体内增强HNC细胞对顺铂的耐药性
a用有或无CAFs的CAF 27细胞建立异种移植小鼠模型。小鼠腹腔注射顺铂(4mg/kg,每4天注射一次),加或不加GW4869 (2 mg/kg,每2天注射一次)。显示肿瘤生长曲线、肿瘤体积和肿瘤重量。 b稳定转染或不转染miR-196a的CAL 27细胞,稳定转染miR-196a或anti-miR-196a的CAFs细胞。裸鼠皮下移植预转染的CAL 27细胞或CAFs。小鼠腹腔注射顺铂5次(4mg/kg,每4天一次)。显示肿瘤生长曲线、肿瘤体积和肿瘤重量。 c miR-196a水平上调与HNC组织中肿瘤大小增加、淋巴结转移和晚期肿瘤分期有关。 d Real-time PCR分析显示miR-196a在化疗敏感患者(n = 20)和化疗耐受患者(n = 20)的HNC组织中的表达。 e Kaplan-Meier总体生存分析。与低miR-196a表达的患者相比,高miR-196a表达的患者总体生存率明显较低。 f 采用real-time PCR技术检测HNC患者和健康献血者血浆外体miR-196a水平。 g HNC患者术前和术后匹配血浆中miR-196a的Real-time PCR分析(n = 40)。 h 对化疗敏感(n = 20)和化疗耐受(n = 20)患者血浆中miR-196a核外表达的Real-time PCR分析。i Kaplan-Meier法分析74例HNC患者的总生存率,根据治疗前血浆中miR-196a的外泌体中位水平,分为高miR-196a组和低miR-196a组。 j, 血浆外体miR-196a表达的ROC曲线分析,用于区分化学耐受组(n = 20)和化学敏感组(n = 20)。AUC,曲线下面积。 k一个说明CAF衍生的外泌体miR-196a对HNC细胞增殖和顺铂耐药的调节作用的模型。 (*p< 0.05; **p < 0.01; ***p < 0.001; ****p< 0.0001)






