肝癌转移的引路人——lncRNA AY
关于lncRNA与癌症之间的研究是近年来的热点,对于常见的癌症如肝癌、胃癌等,研究者们投入了大量的时间和精力,研究其生长、转移,侵袭的机制,以期找到治愈它们的有效办法。今天小编就给大家带来了今年三月,Dr. Liang Yang等人在杂志《Theranostics》上发表的题为“LncRNA AY promotes hepatocellular carcinoma metastasis by stimulating ITGAV transcription”的一篇文章,IF=8.063。 文章介绍了作者如何一步步证明lncRNA AY通过诱导ITGAV转录的染色质修饰作为先导因子促进HCC转移的,同时指出lncRNA AY是HCC患者转移或预后不良的潜在分子标志,这对HCC的治疗有着重要的临床意义。
实验结果:
1.LncRNA AY927503在HCC细胞中高表达
研究者使用ArrayStar lncRNA芯片V2.0比较硫脂处理的HCC细胞和对照细胞的lncRNA图谱,观察到了一组全面的差异表达的lncRNA。
在53对肝癌和邻近的非肿瘤(NT)标本队列中,肝癌组织的AY表达明显高于癌旁NT组织(P<0.001,图1A,a&b)。在另一组80例HCC患者中,原位杂交分析显示HCC组织中每个细胞的AY信号明显高于邻近NT组织(P<0.01,图1B,a)。与T1和T2期患者相比,T3和T4期HCC患者的AY信号增加(P<0.05,图1B,b)。随访患者(n=64)的生存分析显示,低AY表达的患者比高AY表达的患者存活时间长(P=0.034,图1B,c&d)。肿瘤大小(>3 cm)的患者AY水平高于小肿瘤患者(P<0.05,图1B,e)。有血管肿瘤栓阻的患者AY水平高于无肿瘤栓阻的患者(P<0.05,图1B,f)。分析来自肿瘤基因组图谱(TCGA)肝癌数据库的数据可以得出,肝癌组织与其配对NT组织相比,AY表达升高(P<0.001,N=248,图1C,a)。Kaplan-Meier生存分析显示,高AY水平与肝癌患者的总生存率差密切相关(N=180,P=0.0014,图1C,b)。AY在乳腺(N=837)、肾脏(N=448)、肺(N=488)和肝组织中广泛表达,AY在肿瘤中的表达高于正常组织(图1D)。AY在MHCC97H(高转移潜能)HCC细胞中的表达明显高于MHCC97L(低转移潜能)HCC细胞(P<0.05,图1E,a)。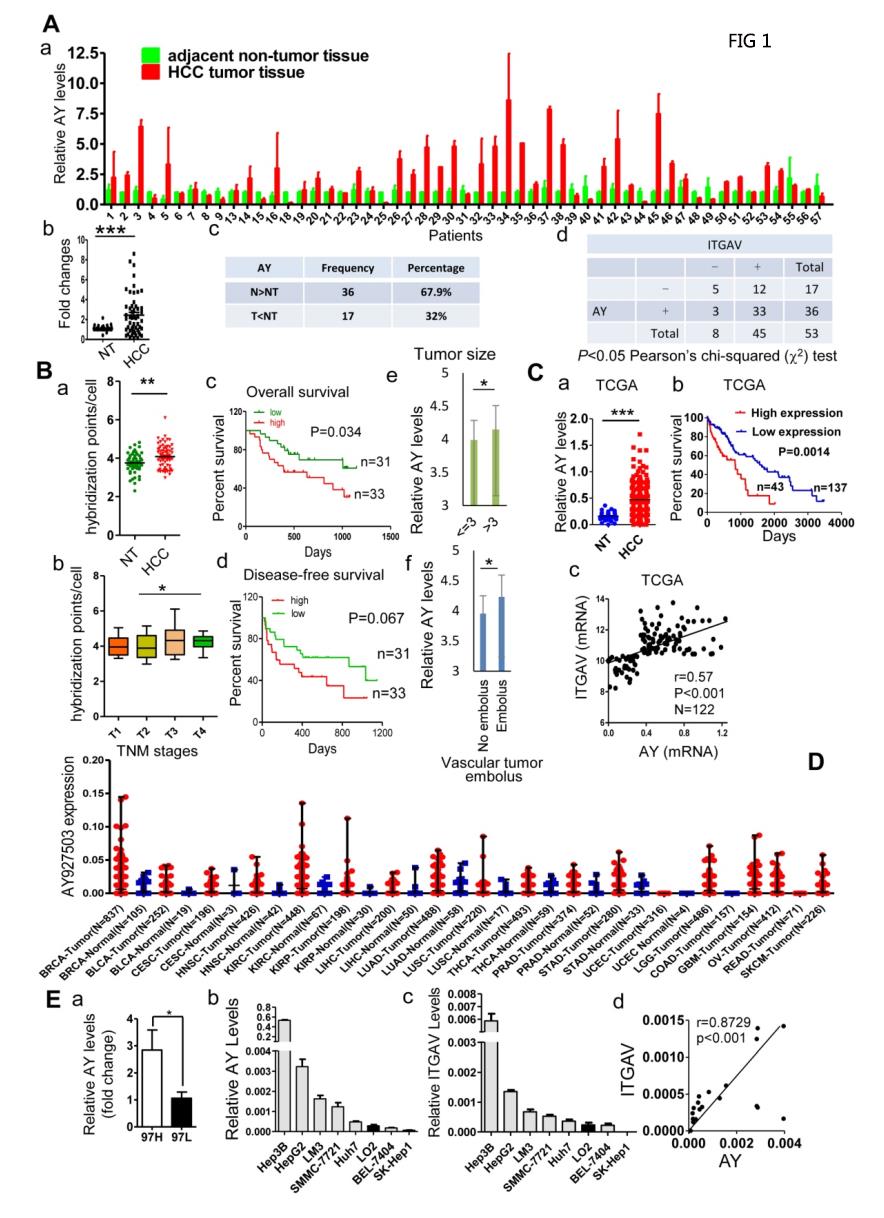
2.AY促进ITGAV表达
已证明硫脂通过整合素αVβ3上调ITGAV促进肝癌的转移。分析7种肝癌细胞株和人肝细胞LO2细胞株中AY和ITGAV的表达水平。AY在Hep3B、HepG2、LM3、SMMC-7721、Huh7、LO2、BEL-7404和SK-Hep1细胞中的表达谱与ITGAV相似,可发现AY和ITGAV表达水平之间存在密切的正相关(皮尔逊相关系数r=0.8729,图1E,b-d)。分析53例HCC患者组织标本中AY和ITGAV mRNA的表达水平,53例HCC组织中有36例显示AY水平明显高于邻近NT组织(P<0.01,图1A,c)。在36个样本中,33个也表达高水平的ITGAV。17个HCC样本中有5个AY水平低于邻近NT组织,ITGAV水平也较低(图1A,d)。皮尔逊卡方(χ2)检验结果显示,AY和ITGAVmRNA表达水平之间存在显著相关性(P<0.0 5)。TCGA数据分析显示AY和ITGAV表达水平密切相关(N=122,P<0.0001,图1C,c)。在过度表达AY的HCC细胞中,ITGAV mRNA水平几乎增加了两倍,但敲除AY使ITGAV mRNA水平急剧降低(图2A)。在过度表达AY的HCC细胞中,ITGAV蛋白水平也增强,并且与对照细胞相比,AY敲除细胞中的ITGAV蛋白水平显着降低(图2B)。免疫荧光分析显示,在过度表达AY的肝癌细胞中,ITGAV和整合素αVβ3在细胞表面的表达明显增加,而在AY敲除细胞中则下降(图2C)。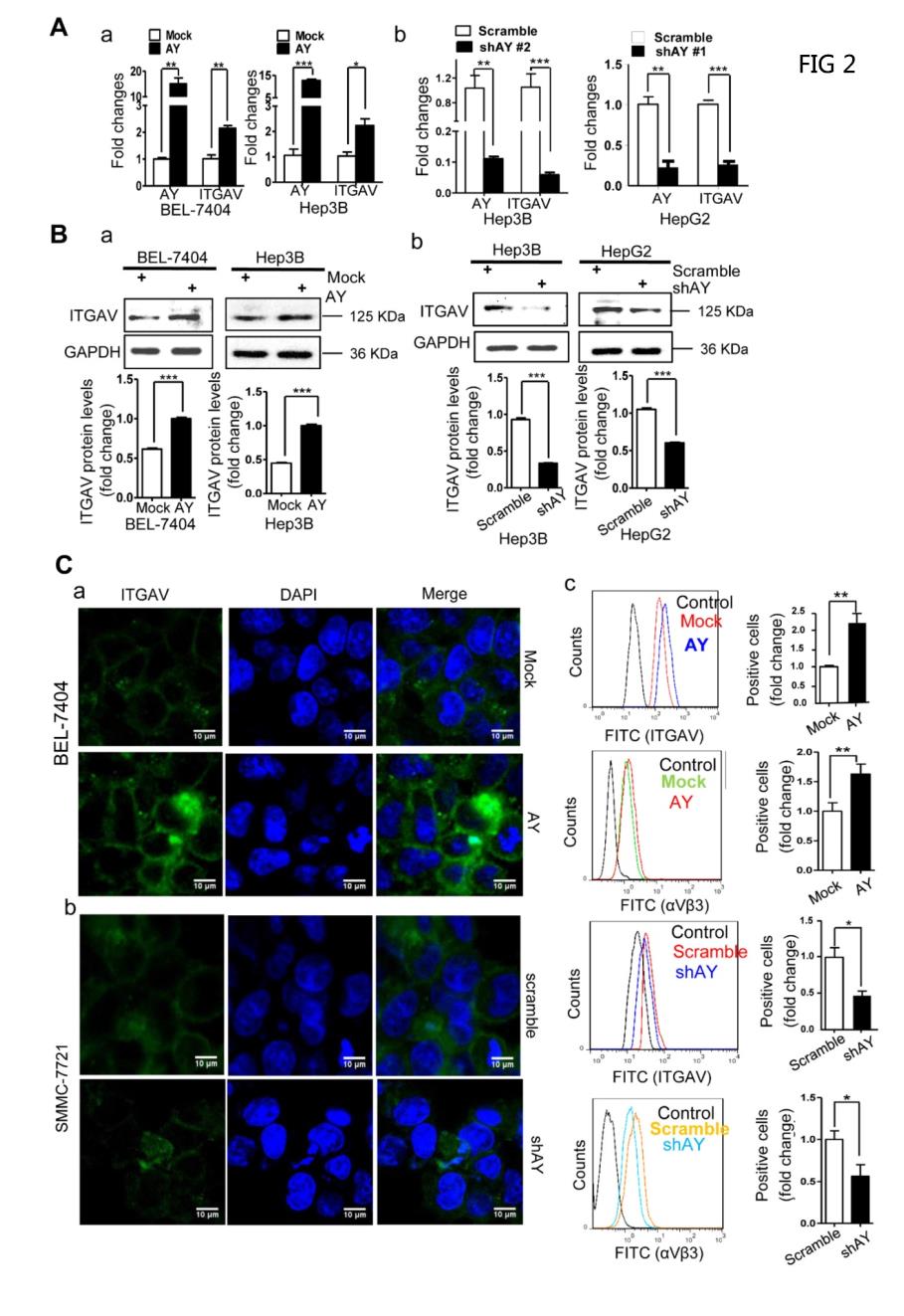
3.AY促进肝癌细胞的转移相关行为
血管生成是肿瘤转移的重要因素,与整合素αVβ3相关,研究者进行管腔形成实验来研究AY在血管生成中的作用。过表达AY的人脐静脉内皮细胞(HUVECs)显示明显多于模拟细胞的分支点(血管生成的指标)(P<0.01,图3A)。敲除ITGAV可消除AY在HUVECs中的血管生成作用且使分支点减少到低于对照组的数目。ITGAV的过表达能恢复HUVECs的分枝能力。在转染AY的细胞中形成的菌落数量明显多于模拟细胞。与扰乱对照相比,沉默AY的细胞中的菌落数量明显减少(图3B,a)。AY的过表达显著增加了细胞活力(图3B,b),敲除ITGAV消除这种AY效应。在Hep3B细胞中,敲除AY显著降低了细胞活力,转染ITGAV或AY构建挽救了细胞活力(图3B,b)。
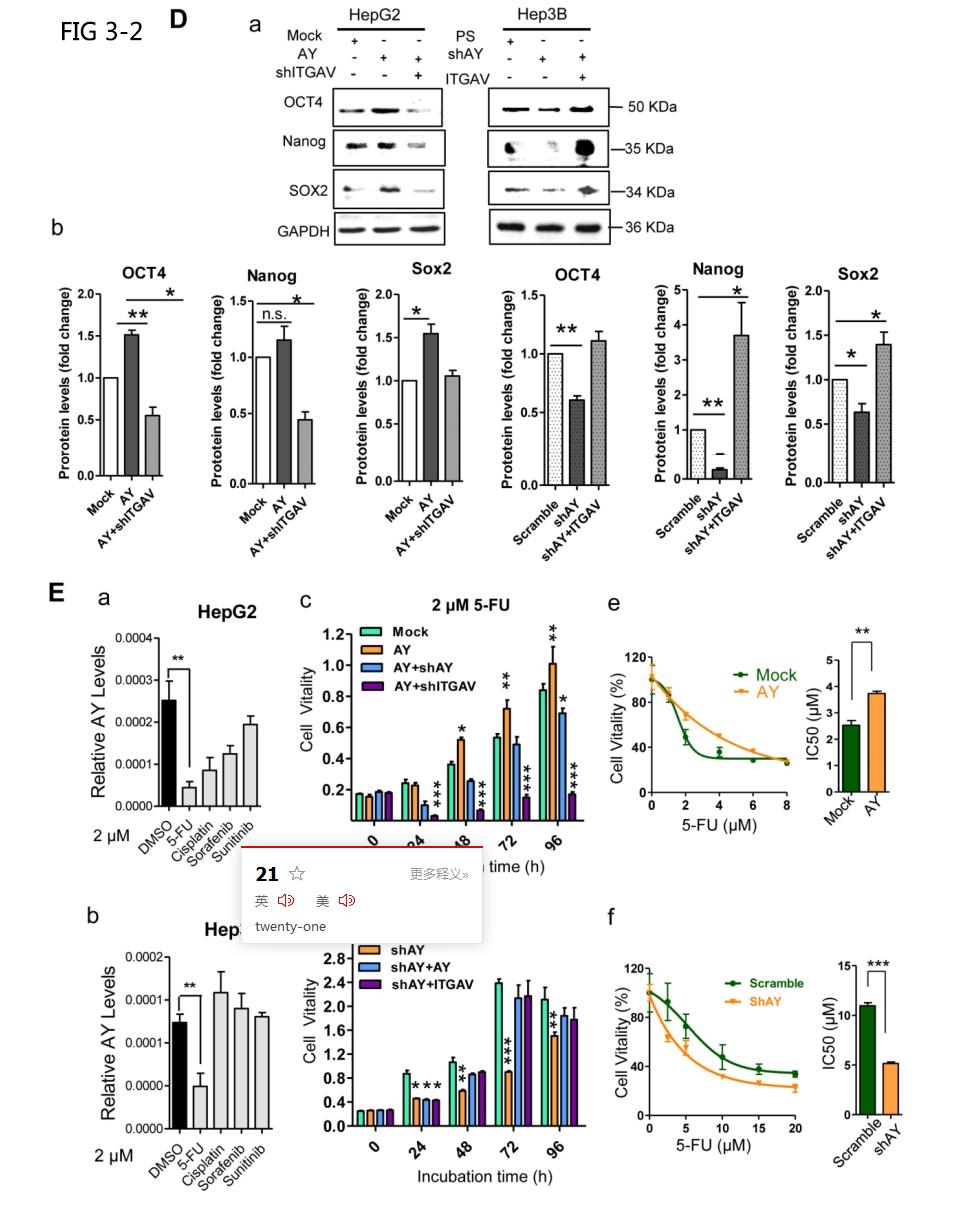
EMT是HCC中使肿瘤细胞迁移和转移的重要过程。AY显著降低E-cadherin的表达水平,并提高N-cadherin、ZEB1或Twist的水平(图3C,a&b)。这些AY效应被ITGAV敲低所消除。相反,敲除AY促进E-cadherin,但抑制N-cadherin,vientin,ZEB1和Twist表达,ITGAV过表达逆转了这一效应(图3C,a&b)。AY的过表达增强了干细胞标志物OCT4和SOX2的表达,这种效应被ITGAV敲低所消除(图3d,a&b)。AY沉默则情况相反。2μM 5-氟尿嘧啶(5-FU)处理的细胞与对照细胞相比,AY表达明显降低(P<0.0 1,图3E,a&b);与模拟组相比,2μM 5-FU处理的细胞活力因AY的过表达而显著增强,因ITGAV的沉默而降低(图3e,c)。AY敲除显著抑制了5-FU处理的Hep3B细胞的细胞活力,但AY或ITGAV的过表达在48小时后完全恢复了细胞活力(图3E,d)。过量表达AY的HepG2细胞的5-FU半数抑制浓度(IC50)明显高于对照细胞。 敲除AY可显著降低5-FU在Hep3B细胞中的IC50(图3E,e&f)。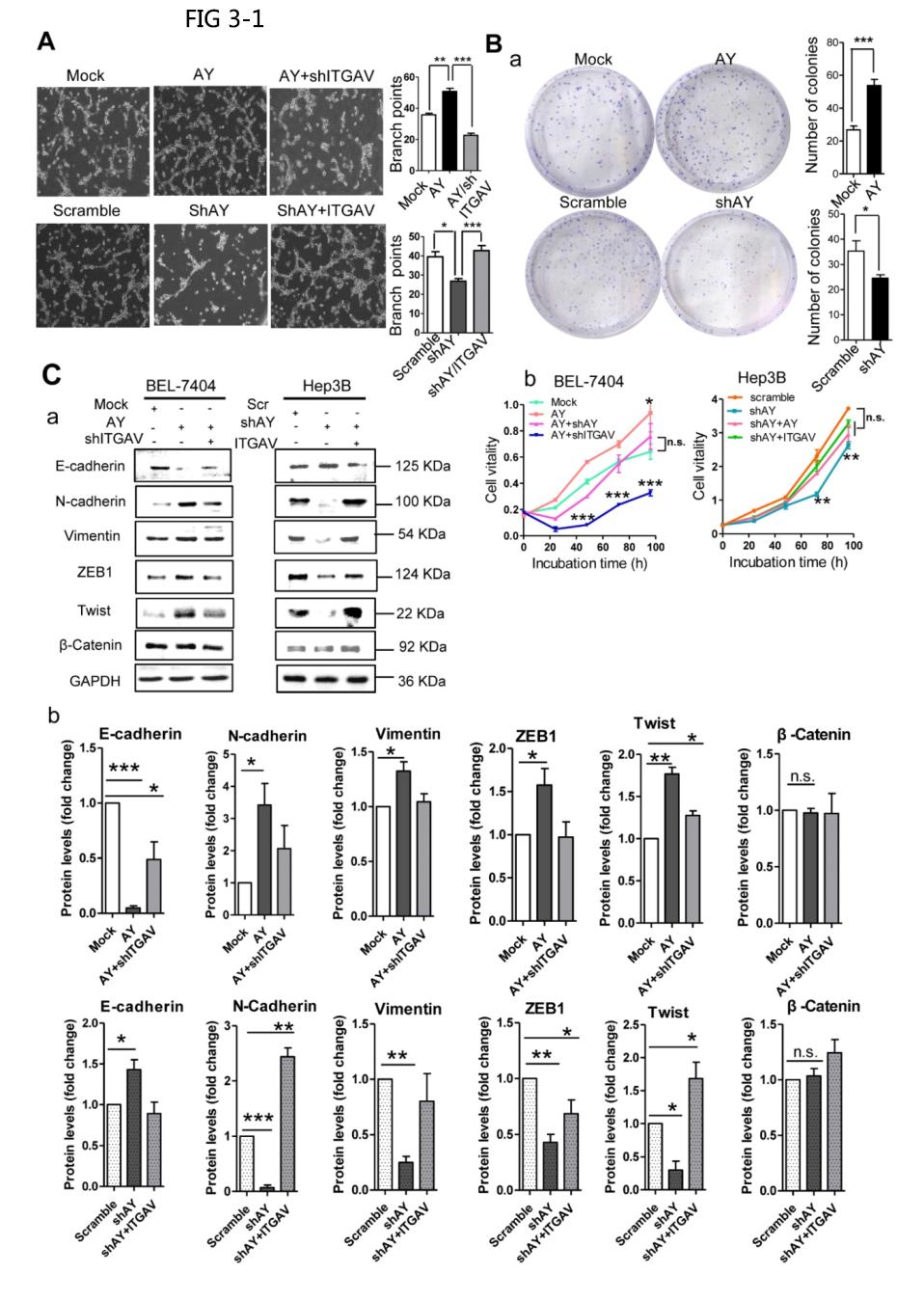
4.AY促进HCC转移
利用肿瘤异种移植,研究lncRNA AY在体内对肿瘤生长和转移的影响。基于AY和ITGAV水平,选择稳定的AY过表达(AY4)和对照(M6)细胞进行肿瘤异种移植实验(图4A)。将AY4或M6细胞(5×106细胞)皮下注射给4周龄雌性BALB/c裸鼠(n=10/组),观察肿瘤大小,发现AY组的肿瘤明显大于对照组(图4B)。AY组的AY和ITGAVmRNA水平高于对照组,并且ITGAV和整合素αVβ3(图4C,a和b)的染色比对照组强。AY组肿瘤组织阳性CD31(血管内皮细胞标记物)染色高于对照组(图4D,a)。在AY组的Matrigel-plug中也观察到比对照组更多的CD31阳性细胞(图4D,b)。AY组肝和肺转移灶也明显多于对照组(图4E)。在AY组肝转移组织中ITGAV染色比对照组更强烈(图4F)。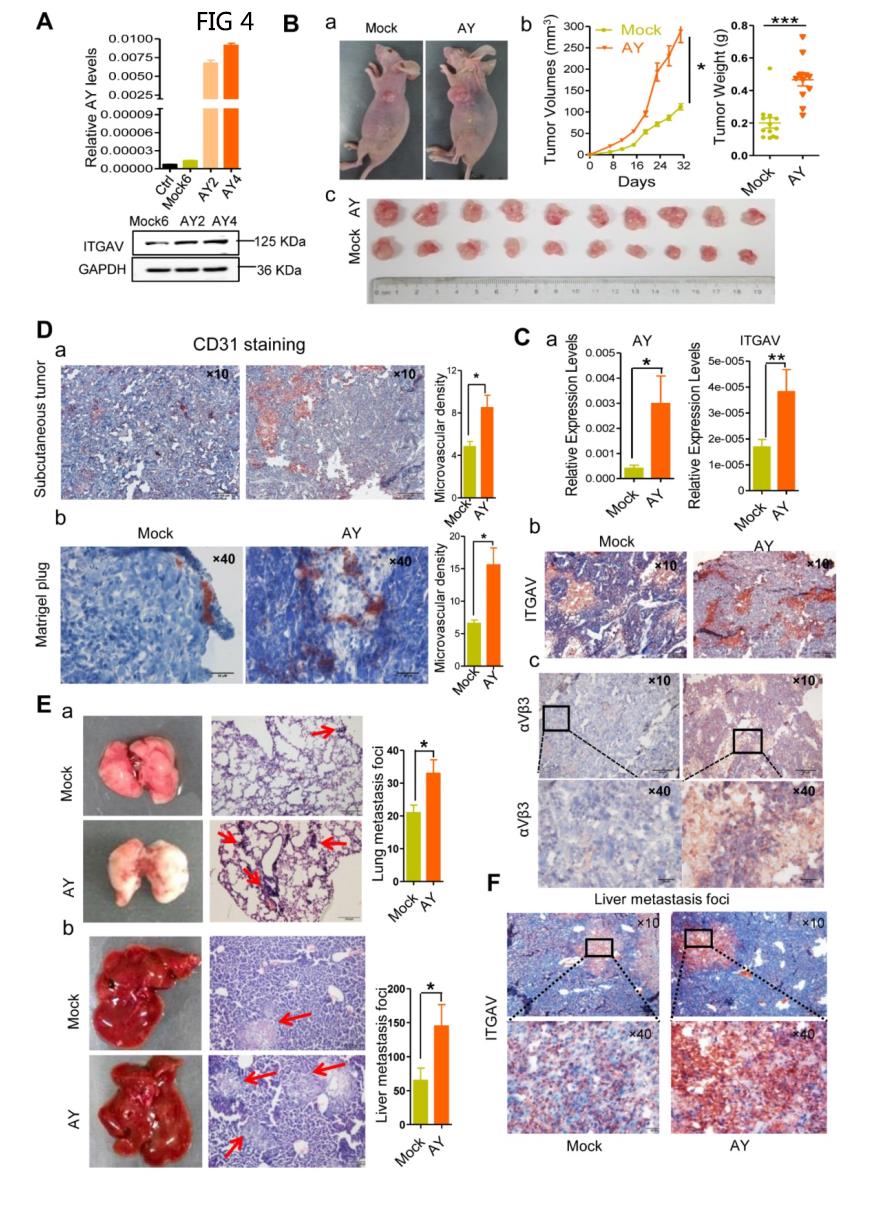
5.AY增强ITGAV基因转录
在HCC细胞中进行原位杂交分析,观察到AY定位在细胞核或细胞质中(图5A,a)。通过RNA纯化(Chirp)分离染色质的实验,以使用生物素化的AY来拉低超声剪切的基因组DNA,发现ITGAV启动子是AY复合体的一部分(图5B),这表明AY与ITGAV启动子相互作用。使用全长ITGAV启动子(-1295至+207)进行荧光素酶报告分析,以研究AY对ITGAV启动子活性的影响(图5A,b)。AY过表达显著刺激了SMMC7721(P<0.001),HEK293T(P<0.001)和HeLa(P<0.001)细胞的ITGAV启动子活性(图5A,c),这些细胞中的AY敲除显著降低了ITGAV启动子的活性(图5A,d)。全长AY不增强酪氨酸羟化酶(TH)或pGL3启动子活性(图5C,d),这表明AY特异性调节ITGAV启动子活性。
AY结构域缺失实验(图5D)发现突变体5(1-671)和4(1-522)显示增强的ITGAV启动子活性,类似于全长AY(图5C,a&b),但突变体2(1−371)和1(1−298)在HEK293T和SMC-7721细胞中均未显示出增强的ITGAV启动子活性。突变体3(1−401)表现出部分刺激效应。这些结果表明,AY的371-522结构域对于AY对ITGAV启动子活性的调控具有重要作用。突变体AYΔ371-522缺乏371-522结构域,没有显示AY诱导的ITGAV启动子活性(图5C,c)。单独过表达AY的371-522片段或AY∆371-522 序列均不能刺激 ITGAV启动子的活性和转录。只有当全长AY过表达时,才在BEL-7404和SMMC-7721细胞中检测到ITGAV的表达(图5E,a&b)。ITGAV蛋白表达也观察到类似的结果(图5E,c)。此外,无论是AY∆371-522还是AY371-522都不能单独促进伤口闭合率(图5E,d)。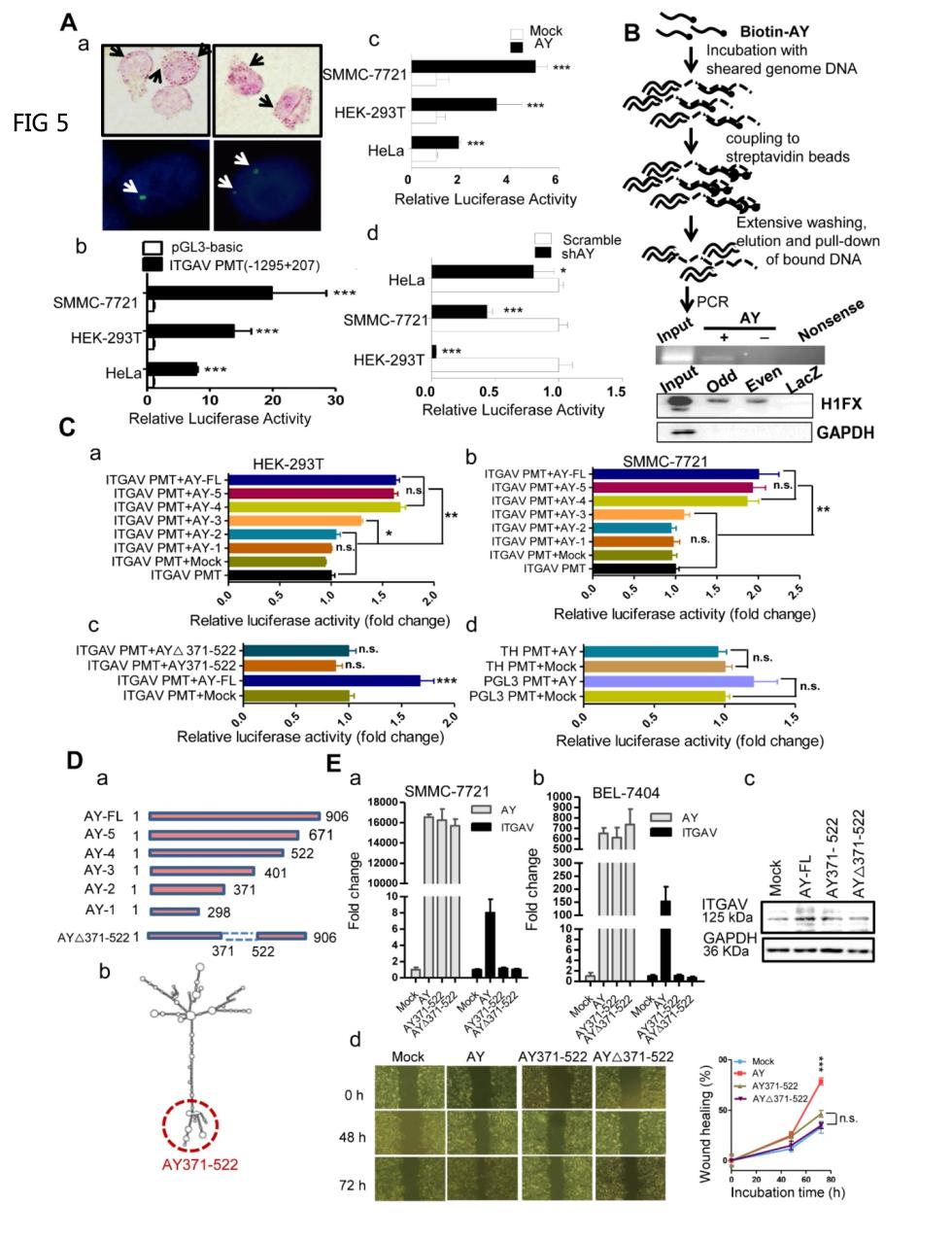
6.AY与链接蛋白H1FX相互作用
RNA免疫沉淀(RIP)和RNA下拉分析显示AY与已知对ITGAV表达重要的因素(8,9,21)之间没有显著的相互作用。在这两种方法中,没有发现AY与ZNF282的相互作用(数据未显示)。通过质谱和高通量蛋白质芯片实验,筛选与AY相关的蛋白质。通过质谱和蛋白芯片分析鉴定组蛋白1FX(H1FX)和Ig kappa链C区(IGKC)。IGKC被排除在进一步的分析之外。RNA下拉试验显示AY和H1FX之间存在直接相互作用(图6A,a)。在由奇数或偶数AY探针池拉下的复合体中也观察到H1FX(图5B)。在其他六个组蛋白H1变异体中,H1.2、H1.3和H1.4与AY在复合物中沉淀,但H1.0、H1.1和H1.5没有(图6A,a)。H1FX、H1.2、H1.3和H1.4也与AY371−522结构域相互作用(图6A,b)。在AY缺失突变体AY∆371−522中,共沉淀复合体中H1FX水平明显降低,但与包含全长AY的沉淀相比,H1.2,H1.3或H1.4水平保持不变。结果表明AY(371−522)的中心结构域与H1FX相互作用。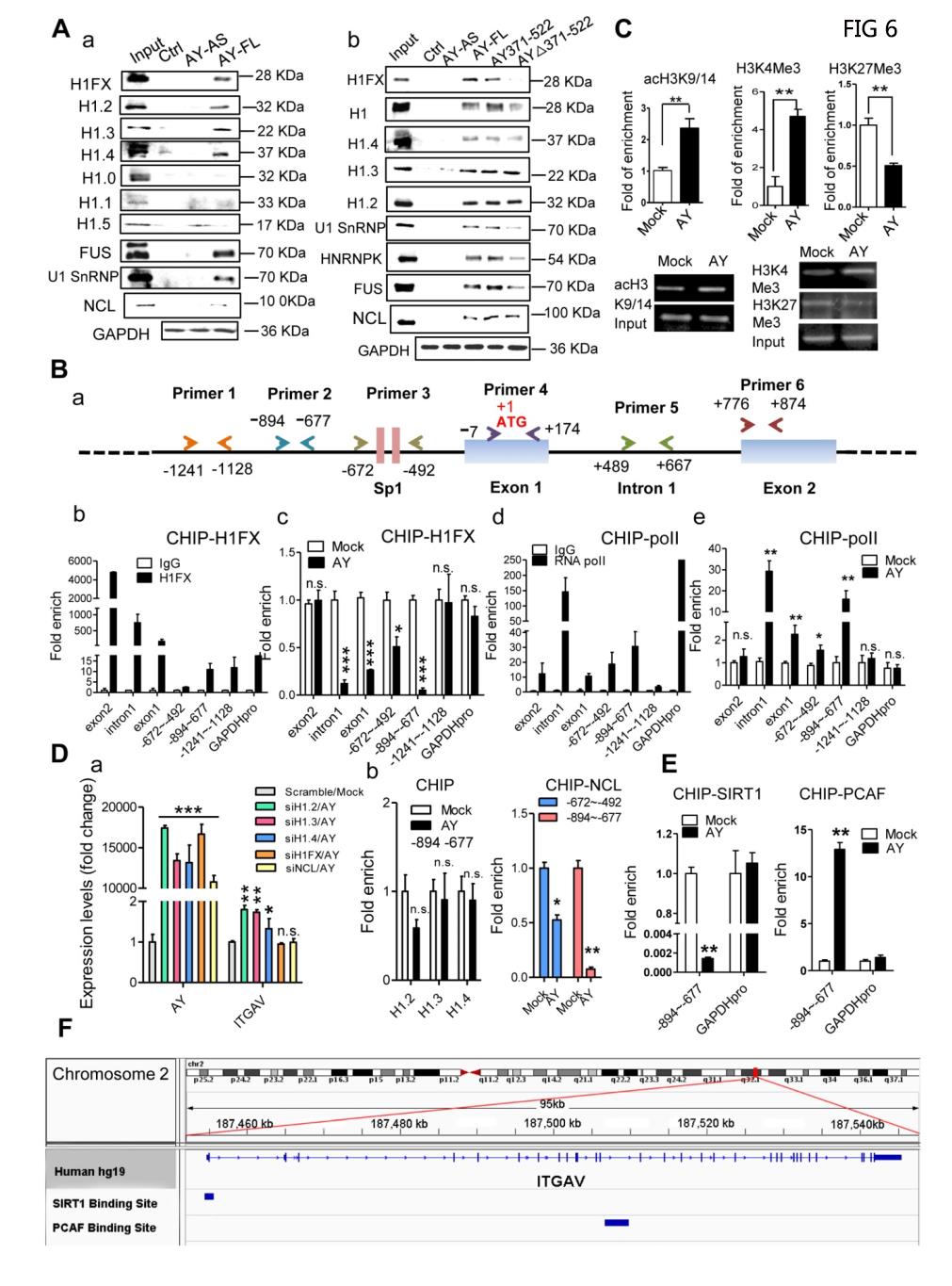
7.AY与H1FX结合诱导染色质重构
使用五对引物通过染色质免疫沉淀分析测试了ITGAV启动子的H1FX占有率(图6B,a)。H1FX不仅在-1241到-677之间占据了ITGAV启动子区域(图6B,b),而且在内含子1和外显子1和2上也被观察到。
RNA聚合酶II(Pol 11)占据了内含子1和上游区域从-894到-492(图6B,d)。Ay过表达显著增加了pol II在上游区域的占有率,但内含子1和上游区域从-894到-492的H1FX占有率显著降低(图6B,c&e)。启动子上H3K27me3(一种含有三甲基化赖氨酸27残基的组蛋白H3)占有率降低(图6C)。AY显著增强了ITGAV启动子上H3K4me3和acH3K9/14的占有率(图6C)。H1FX沉默消除了AY过表达对ITGAV启动子的刺激(图6D,a)。H1.2,H1.3或H1.4的沉默对ITGAV的表达没有任何影响,由于AY过表达,它们在ITGAV启动子上的占有率没有改变(图6D,a&b)。这些结果表明AY与H1FX相互作用诱导ITGAV启动子上的核心组蛋白修饰。
8.AY诱导的核心组蛋白修饰排斥H1FX结合
连接组蛋白与DNA/核小体的结合是由组蛋白伴侣蛋白实现的。通过质谱,发现组蛋白1伴侣核仁蛋白(NCL)是AY复合物的一部分。核糖核酸下拉试验显示NCL与全长AY和突变的AY(AY371-522,AY∆371-522)相互作用(图6A)。AY的过表达显著降低了ITGAV启动子上NCL的富集(从-894到-492)(图6D,b)。NCL的沉默也减弱了AY对ITGAV转录的刺激作用(图6D,a)。AY的异位表达显著增强了组蛋白乙酰基转移酶PCAF(acH3K9/14的组蛋白乙酰基转移酶)的占有率,但减少了组蛋白去乙酰化酶SIRT1在ITGAV启动子区域-894到-677的富集(图6e)。来自芯片序列的数据确实表明SIRT1和PCAF被结合在ITGAV位点上(图6F)。结果表明,AY招募组蛋白修饰酶并诱导区域组蛋白修饰,从而排斥NCL/H1FX结合并激活ITGAV启动子。






