circTRIM33-12与肝细胞癌之间的联系大揭秘
近年来,环状RNA(circRNA)在包括肝癌在内的癌症的发生过程中发挥着重要的调控作用。然而,大多数环状RNA在肝细胞癌(HCC)中的作用仍不清楚。
今天小编带大家了解近期发表于Molecular Cancer上的一篇关于环状RNA circTRIM33-12通过海绵化MiR-191抑制肝癌的发展的文章Circular RNA circTRIM33-12 acts as the sponge of MicroRNA-191 to suppress hepatocellular carcinoma progression。

肝细胞癌是全球癌症相关死亡的第三大原因。HCC的临床特点是侵袭性强,预后差,治疗机会有限。目前肝细胞癌最常见的治疗方式是手术治疗,但多焦点发展和远处转移的特点使大多数肝细胞癌不能手术治疗;因此,进一步了解HCC发展的分子机制至关重要。本文通过一系列实验评估了circTRIM33-12在HCC发展中的作用,进而证明环状RNA circTRIM33-12通过海绵化MiR-191抑制肝癌的发展。
技术路线:
研究者的实验思路如下:

结果:
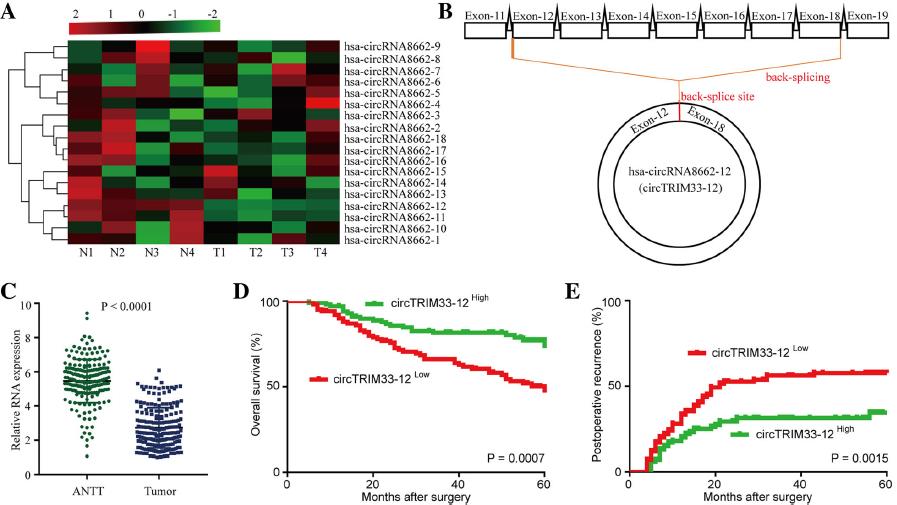
1.TRIM33来源的circTRIM33-12在HCC中的调节
TRIM33是一种肿瘤抑制因子,可以通过不同的机制抑制包括HCC在内的多种癌症的肿瘤细胞进展和肿瘤发生。先前研究报道TRIM33在HCC中的下调是由TRIM33启动子CpG的高甲基化引起的,表明circRNA来源的TRIM33在HCC细胞中表达可能下调。因此,我们推测来源circRNA的TRIM33有可能在HCC细胞中发挥抑癌作用。为了研究TRIM33来源的circRNA在HCC组织中的表达,我们使用qRT-PCR分析了四对HCC组织样本。我们发现,在18个circRNAs中,有4个HCC肿瘤组织中circTRIM33-12的表达显著且持续下降(图1a)。因此,我们将重点放在circTRIM33-12(circRNA源自TRIM33的12和18外显子)的表达和作用上(图1b)。为了进一步探讨circTRIM33-12在HCC患者中的表达对预后的影响,我们使用qRT-PCR对200例HCC及邻近组织中circTRIM33-12的表达水平进行了定量分析(图1c)。结果显示,与来自同一患者的邻近组织的circTRIM33-12表达水平相比,58%(116/200)的HCC组织的circTRIM33-12表达水平显著降低。选取200例HCC组织中circTRIM33-12的中间相对表达量作为肿瘤分离的分界点。Kaplan-Meier生存分析显示,circTRIM33-12表达水平低的患者临床预后较差(图1d和e)。这些数据提示HCC细胞中circTRIM33-12表达的减少与患者预后不良有关,提示circTRIM33-12表达的减少可能参与了HCC的进展。
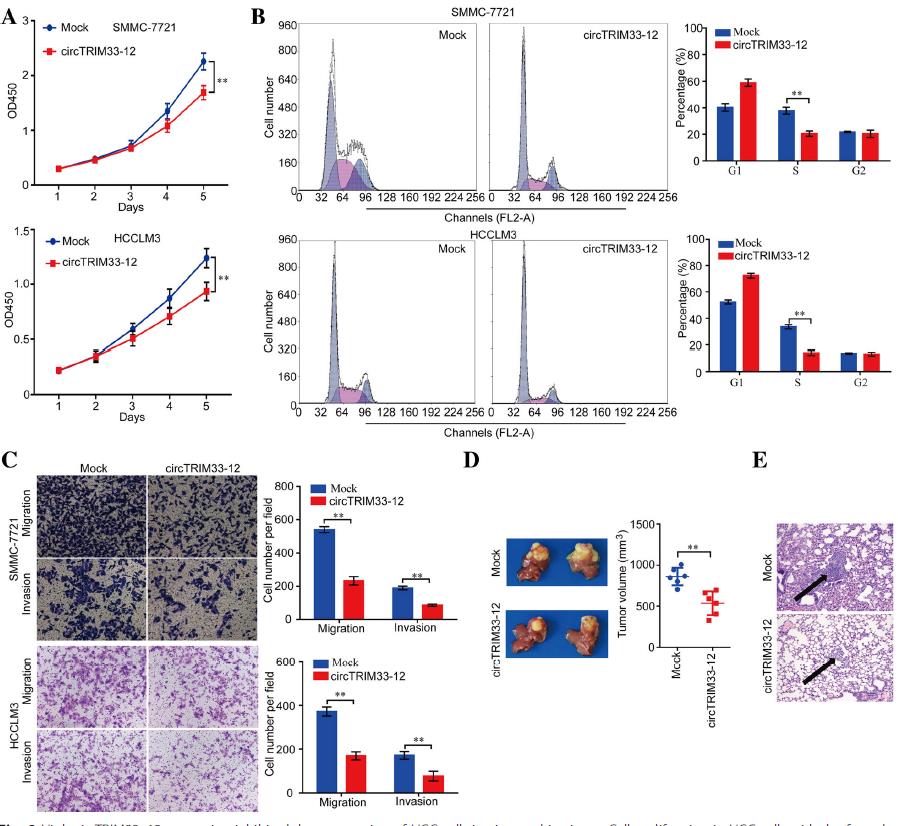
2.circTRIM33 12抑制肝癌细胞的增殖和侵袭
接下来,研究circTRIM33-12在HCC进展中的生物学功能。CCK-8测定、细胞周期实验、迁移和侵袭实验显示,过表达circTRIM33-12后,SMMC-7721和HCCLM3细胞的生长和转移受到显著抑制(图2a-c)。为了进一步探讨circTRIM33-12在体内的作用,我们应用过表达circTRIM33-12 的SMMC-7721细胞和模拟对照细胞建立原位植入肝内HCC模型。circtrim33-12过表达组与模拟对照组相比,SMMC-7721异种移植原位生长4周后,肿瘤的规格更小(图2d)。与这些预期一致,与SMMC-7721异种移植的模拟对照组相比,circtrim33-12过表达组的肺组织转移结节减少(图2e)。
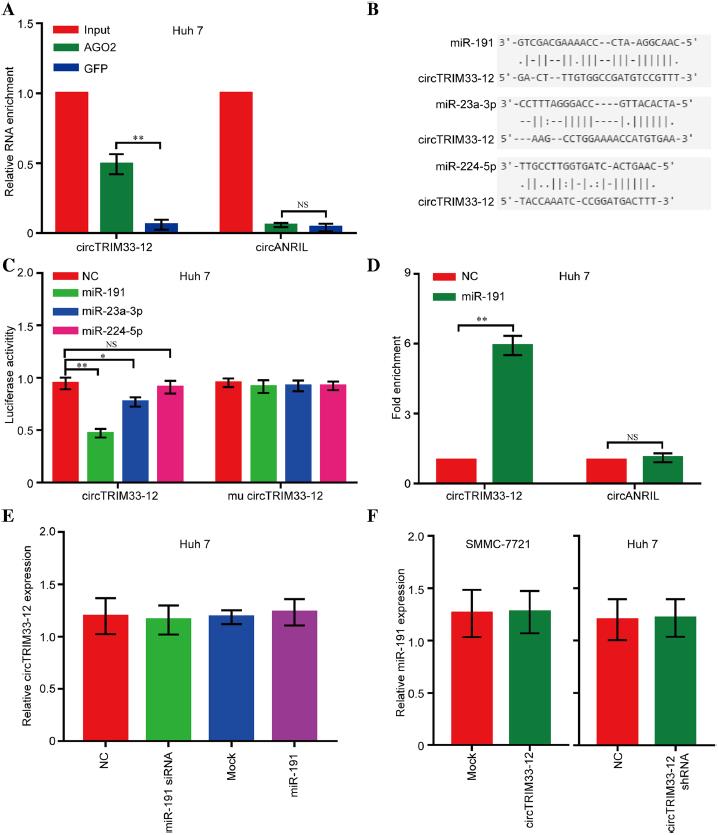
3.circTRIM33-12可以通过海绵化miR-191发挥作用
鉴于环状RNA已被证明在癌细胞中充当miRNA海绵的作用,我们探讨了circTRIM33-12是否能在HCC进展中与某些miRNA结合。
首先,我们用抗AGO2抗体在Huh 7细胞中进行RIP。结果显示,环状RNA circTRIM33-12被AGO2抗体显著富集(图3a),表明circTRIM33-12可能是AGO2与miRNAs结合的平台。接下来,我们使用StarBase v2.0目标预测工具找到11个可能与circTRIM33-12结合的miRNAs。根据最近的研究,这些miRNAs中有3个作为致癌基因,包括miR-23a-3p、miR-191和miR-224-5p。为了进一步鉴定与circTRIM33-12结合的miR-23a-3p、miR-191和miR-224-5p,我们构建了含有荧光素酶基因的circTRIM33-12表达质粒载体,并将质粒载体转染到Huh 7细胞中。转染后,我们观察到3个miRNAs,尤其是miR-191,荧光素酶活性水平降低(图3b和c)。此外,使用生物素标记的miR-191模拟物进行的pull-down实验结果显示,与阴性对照相比,circTRIM33-12显著富集(图3d)。然而,在HCC Huh 7细胞中miR-191模拟表达增加或减少后,circTRIM33-12并没有显示出明显的变化(图3e),而在HCC SMMC-7721或Huh 7细胞中,当circTRIM33-12表达被强制表达或敲除后,miR-191均未表现出显著变化(图3f)。这些结果表明,circTRIM33-12和miR-191可能不会相互降解。这些实验表明circTRIM33-12可能通过海绵化miR-191发挥作用。
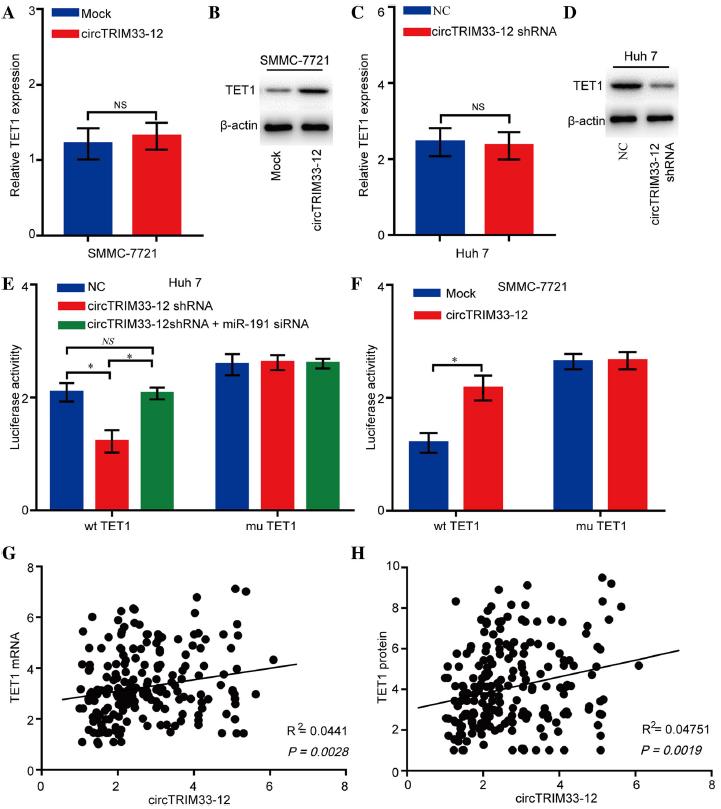
4.circTRIM33 12通过海绵化miR-191上调TET1表达
已有研究报道miR-191在人类癌症中直接靶向多种基因,包括TET1、TIMP3、SATB1和DIECR1。然而,我们没有检测到这些mRNAs在转染miR-191模拟物的Huh 7细胞或转染miR-191 siRNA的SMMC-7721细胞中显著表达。有趣的是,除了TET1蛋白的表达外,我们也没有检测到在miR-191过表达/敲减细胞中这些蛋白显著表达。为了进一步证实circTRIM33-12对TET1表达的影响,我们用circTRIM33-12质粒转染SMMC-7721细胞,用qRT-PCR和western blotting检测TET1 mRNA和蛋白水平。结果表明,circTRIM33-12的异位表达显著增加TET1蛋白表达(图4a和图4b)。相反,circTRIM33-12的击倒的显著降低TET1蛋白质表达(图4c和图4d)。荧光素酶活性测定表明,circTRIM33-12的击倒可以有效降低wt的荧光素酶活性,而miR-191对Huh 7细胞中circTRIM33-12敲除引起的荧光素酶活性的抑制作用可以通过抑制miR-191恢复(图4e和f)。此外,强迫表达circTRIM33-12可以有效提高wt细胞的荧光素酶活性(图4f)。最后,我们使用qRT-PCR和IHC检测了200例HCC患者组织中TET1的表达。在HCC患者中,circTRIM33-12与TET1呈显著正相关(图4g和图h)。
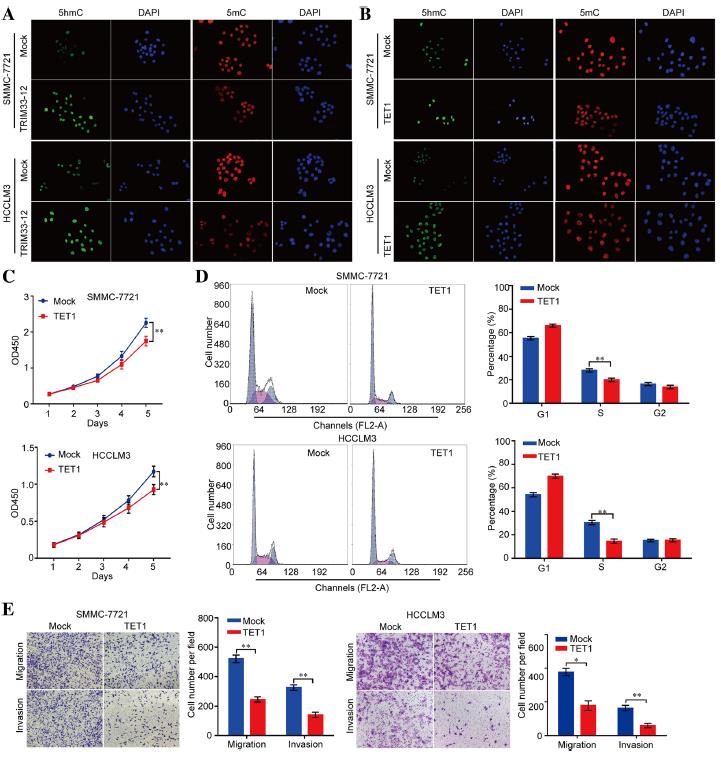
5.circTRIM33 12和TET1负责调控5hmC的表达
为了检测改变的circTRIM33-12或TET1表达是否可以在HCC细胞中调控DNA甲基化水平,我们首先比较了mock、circTRIM33-12 或TET1过表达的SMMC-7721和HCCLM3细胞的中的5mC和5hmC表达情况。我们发现在circTRIM33-12和TET1过表达的细胞中5 hmc的表达水平显著增加(图5a和图5b)。生长曲线显示,与模拟组相比,TET1显著抑制细胞增殖(图5c)。此外,在细胞周期实验中,与模拟组相比,TET1减少了S期的细胞数量(图5d)。通过体外迁移和侵袭实验,探讨TET1是否抑制肿瘤细胞的迁移和侵袭能力。发现除circTRIM33-12外,与模拟组相比,TET1显著抑制SMMC-7721细胞的迁移和侵袭(图5e)。这些数据证明circTRIM33-12可以通过海绵化miR-191抑制HCC进展,从而通过circTRIM33-12 /miR-191/TET1轴抑制miR-191致癌效应。
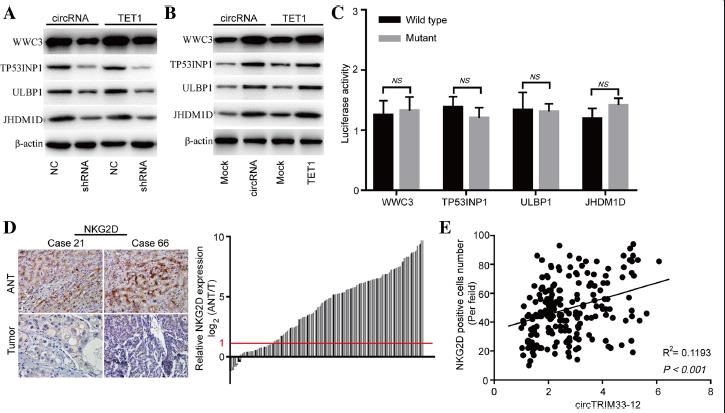
6.TET1负调控癌基因表达,与免疫逃避有关
为了研究circTRIM33-12是否通过miR-191/TET1轴发挥其生物学功能,我们检测了在circTRIM33-12或TET1敲减和过表达的HCC细胞中WWC3、TP53INP1、ULBP1和JHDM1D的表达。结果显示circTRIM33-12或TET1的沉默均显著降低了HCC Huh 7细胞中WWC3、TP53INP1、ULBP1和JHDM1D的mRNA和蛋白表达水平(图6a)。此外,过表达circTRIM33-12或TET1可提高HCC SMMC-7721细胞中WWC3、TP53INP1、ULBP1和JHDM1D的mRNA和蛋白表达水平(图6b)。为了验证WWC3、TP53INP1、ULBP1和JHDM1D mRNAs的3 ' UTR是否为miR-191在HCC细胞中的靶基因,我们采用荧光素酶报告基因检测。将WWC3、TP53INP1、ULBP1和JHDM1D的3 ' UTR序列克隆到荧光素酶报告载体中。miR-191模拟物在3 ' UTR序列转染的Huh 7细胞中不抑制荧光素酶活性(图6c)。这些结果表明,在HCC细胞中,WWC3、TP53INP1、ULBP1和JHDM1D mrna并不是miR-191的靶点。
激活受体自然杀伤组2D(NKG2D)及其配体成员在介导癌症的免疫反应的NK细胞、γδ+ T细胞和CD8+T细胞中发挥重要作用。NKG2D可以识别人类体内八种不同的配体,包括ULBP1。阻止癌症进展的重要机制之一是对癌细胞的免疫监测,其中NK细胞和CD8+ T细胞起着至关重要的作用。为了进一步探讨circTRIM33-12与免疫逃避的关系,我们检测了200例HCC组织和匹配的非肿瘤组织中NKG2D的表达。与邻近非肿瘤组织相比,HCC组织中NKG2D阳性细胞数量显著减少(156/200;2倍)(图6d)。散点分析显示circTRIM33-12表达与HCC组织中NKG2D阳性细胞数量呈正相关(R2 = 0.1193;P < 0.001;图6 e)。这些结果表明circTRIM33-12可能通过海绵化miR-191保护TET1发挥其抗肿瘤作用。
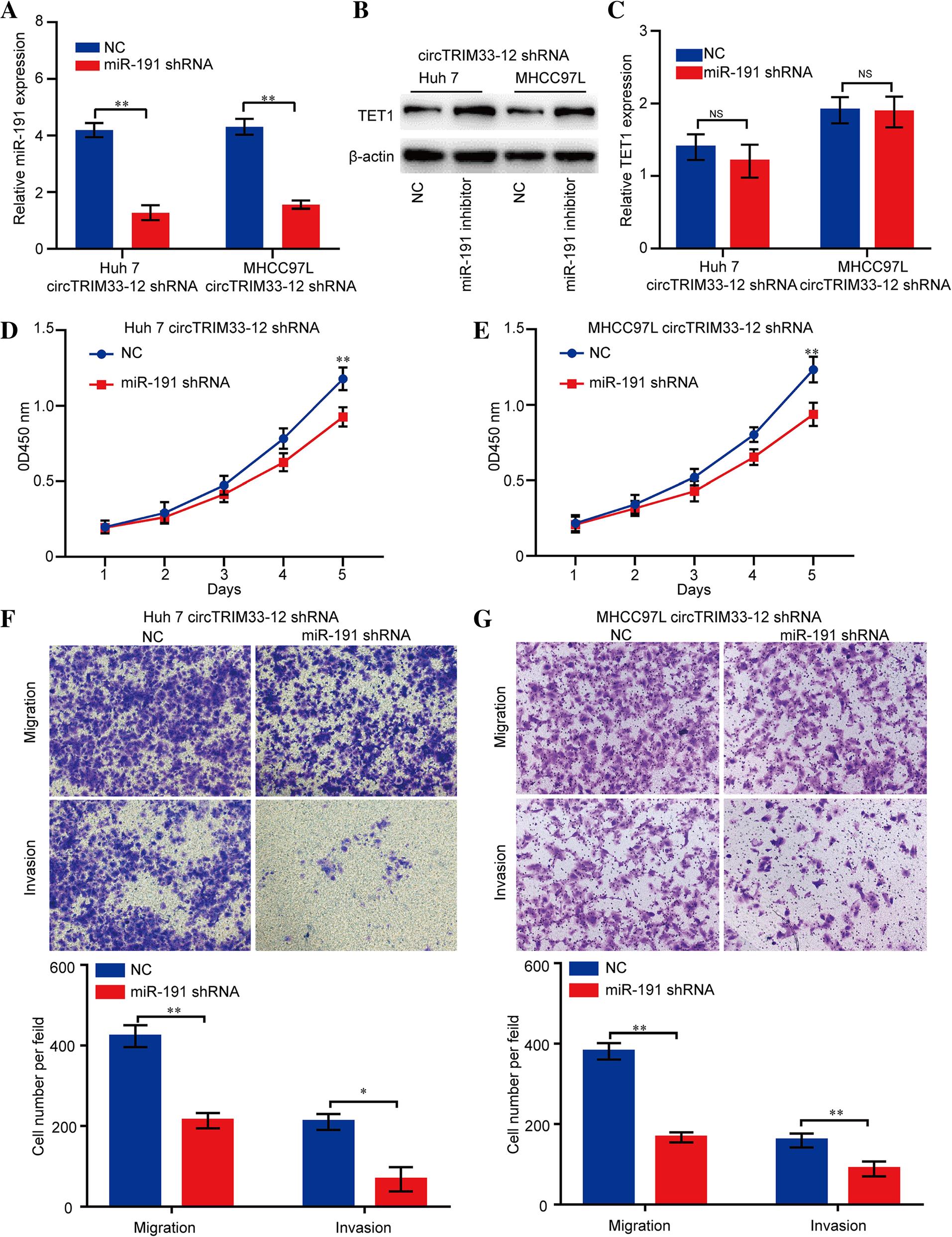
7.miR-191的沉默逆转了circTRIM33-12的下调,并诱导了HCC细胞的进展
接下来我们探讨miR-191的沉默是否影响circTRIM33-12敲减的HCC细胞的增殖、迁移和侵袭。通过qRT-PCR检测沉默效率(图7a)。正如预测,miR-191的沉默上调TET1蛋白的表达,但不上调circTRIM33-12敲减的Huh 7 MHCC97L细胞系中mRNA的表达(图7b和图7c)。此外,在CCK-8和迁移实验中,miR-191的沉默显著抑制Huh和MHCC97L细胞系的增殖、迁移和入侵的能力(图7d)。总之,这些结果表明,circTRIM33-12通过circTRIM33-12 /miR-191/TET1轴抑制HCC细胞的进展。