Zfp217介导m6A mRNA甲基化协调转录和转录后调控促进脂肪形成分化
关于m6A RNA甲基化的研究,已经成为当下火热的研究领域。m6A修饰酶出现异常表达将会引起一系列疾病,包括肿瘤、神经性疾病、胚胎发育迟缓等。近期Nucleic Acids Research上发表了一篇题名为:Zfp217介导m 6 A mRNA甲基化协调转录和转录后调控促进脂肪形成分化。文章发现锌指蛋白(Zfp217)将基因转录与m6A mRNA甲基化修饰结合,以促进脂肪形成。 Zfp217通过激活m6A去甲基酶FTO的转录来调节m6A mRNA甲基化。并且Zfp217的降低损害了3T3L1细胞的脂肪形成分化并导致m6A甲基化修饰的整体增加。此外,Zfp217与YTHDF2的相互作用对于FTO维持其与各种mRNA上的m6A位点的相互作用是至关重要的,因为Zfp217的缺失导致FTO降低并增加m6A水平。

技术路线:
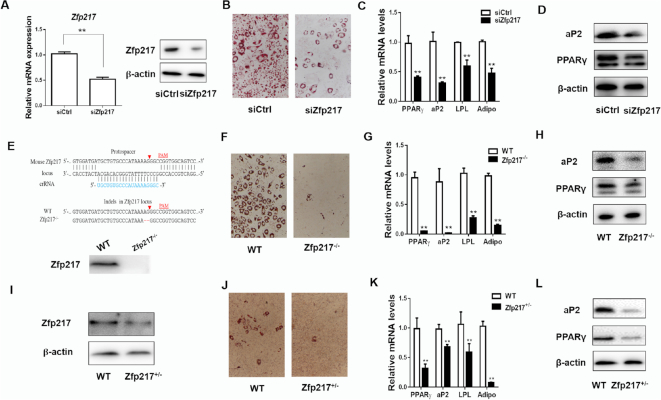
1.Zfp217的缺失会阻碍脂肪分化
首先使用siRNA减少Zfp217 mRNA和蛋白的表达, Zfp217敲低显着阻断脂肪形成,表现为油红O染色水平降低以及关键脂肪形成基因PPARγ,aP2,LPL和脂联素的低表达。使用CRISPR / Cas9技术完全删除Zfp217基因,消除了3T3L1细胞中的脂肪形成。还使用来自Zfp217单倍体不足的小鼠的胚胎成纤维细胞(MEF- Zfp217+/−)检查了Zfp217减少对脂肪形成的影响。
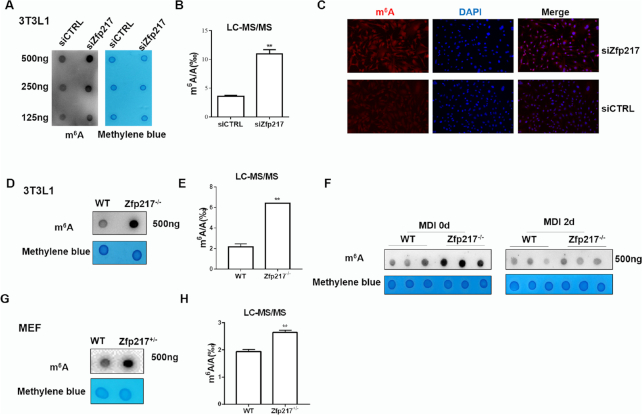
2.Zfp217抑制增强脂肪生成过程中的m6A修饰
为了鉴定Zfp217在3T3L1细胞中的功能,通过斑点印迹和LC-MS / MS定量检测mRNA中的m6A修饰。与对照组相比,使用siRNA和CRISPR / Cas9的细胞显示,Zfp217表达降低细胞中m6A甲基化水平全面增加.m6A免疫染色还揭示了在Zfp217敲低细胞中更高水平的m6A修饰。此外,为了确定Zfp217在脂肪生成过程中调节m6A修饰中的作用,在2天MDI诱导后通过斑点印迹检测m6A水平。对照组和Zfp217缺失细胞之间存在差异,这可能意味着Zfp217-m6A途径在脂肪形成中的早期功能。与野生型相比,MEF-Zfp217 +/-中的m6A修饰也显着增加。总之,这些结果表明Zfp217对于细胞m6A RNA甲基化是重要的。
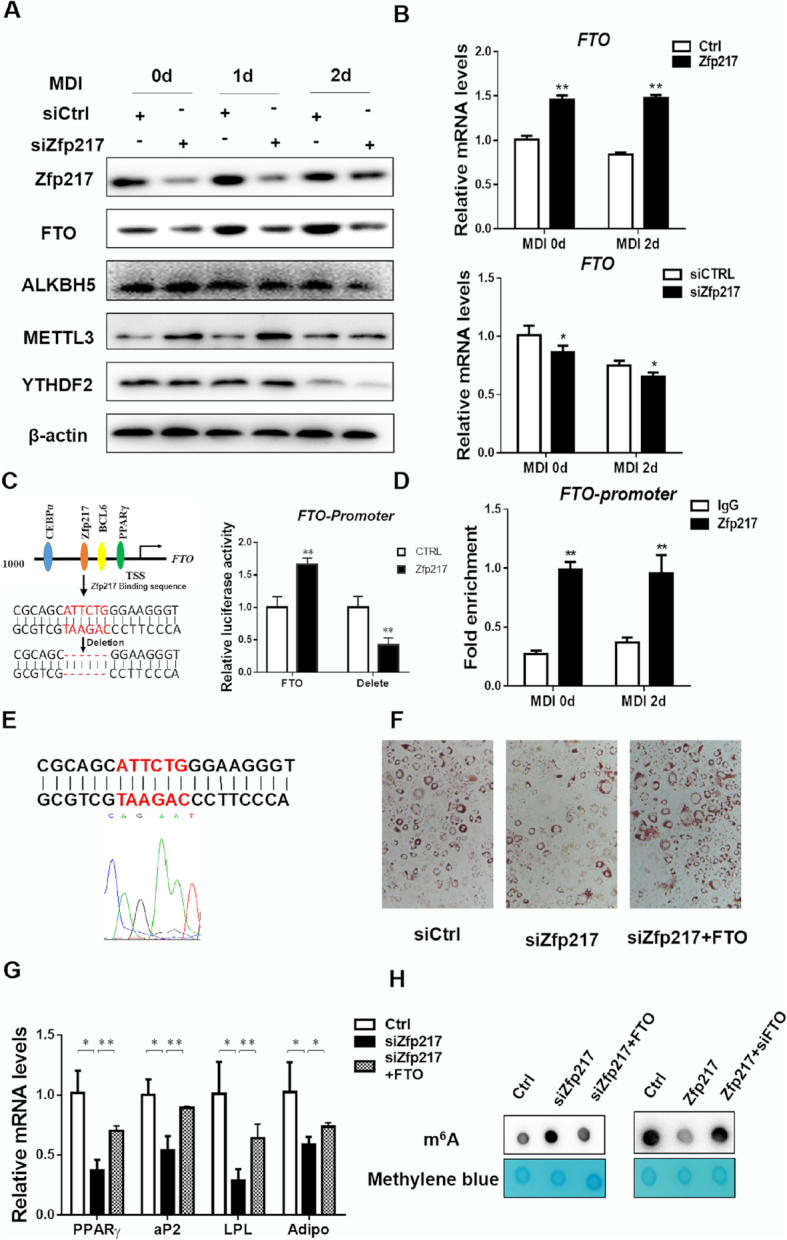
3.Zfp217直接激活FTO的转录
Zfp217是如何抑制m6A mRNA甲基化?为了阐明Zfp217在调节m6A修饰中的作用,检测了m6A甲基化中涉及的关键蛋白的表达。Zfp217的敲低显着增加了METTL3的蛋白质表达并降低了FTO的表达。表明FTO和METTL3都可能在Zfp217相关的m6A修饰中起作用。随后,FTO的mRNA水平通过Zfp217在3T3L1细胞中的过表达或敲低调节,而METTL3水平未改变。此后,参考验证Zfp217是否可以调节FTO作为转录因子的表达。利用生物信息学方法我们推断FTO是Zfp217的靶基因。接下来,使用双荧光素酶显示系统来验证Zfp217增强FTO的启动子活性,而FTO启动子中Zfp217结合序列的缺失抑制它,表明Zfp217在FTO上的直接调节。因此,Zfp217在FTO启动子区的定位也通过使用Zfp217特异性抗体的ChIP-QPCR测定来确认。通过基因序列分析,准确的结合DNA序列与FTO的基因组序列完全一致。与这些观察结果一致,发现FTO通过Zfp217缺失来挽救脂肪生成的抑制,并且一致地增加PPARγ,aP2,LPL和Adiponection的基因表达。m6A可能是Zfp217-FTO依赖性调节脂肪形成方式的主要靶点。这些数据证明了Zfp217作为转录因子,与FTO基因的启动子结合以增强脂肪生成,这可能是在脂肪生成过程中一种调节m6A修饰的方式。
4.Zfp217正向调节参与脂肪生成的上皮转录组
为了描述Zfp217在脂肪生成中作用,在对照和Zfp217敲除3T3L1细胞中进行RNA测序,MDI处理0和2天,并鉴定了12 188和11 566个差异表达基因,分别为0和2天。与野生型相比, Zfp217缺失细胞中绝大多数(1431)基因上调,MDI处理0 d组与2d显着重叠,同时也鉴定了941个下调基因。通过GO分析,发现下调的基因主要与细胞周期,RNA加工和脂质生物合成进展有关,表明Zfp217参与RNA加工和脂质代谢的适当调节。为了阐明Zfp217调节m6A修饰的机制,采用MeRIP-seq测序分析MDI处理0和2天对照组和Zfp217敲除3T3L1细胞中m6A mRNA甲基化情况。发现GGACU高度富集的并且始终表示为最佳序列基序。接下来试图研究关键的m6A位点是否受Zfp217缺失的影响。结果表明,5'UTR和3'UTR中m6A位点的相对密度高于其他区域。而且Zfp217缺失增加了MDI0 d的m6A富集0 d,而不是2 d,这意味着这些转录本具有Zfp217敲除依赖性方式。
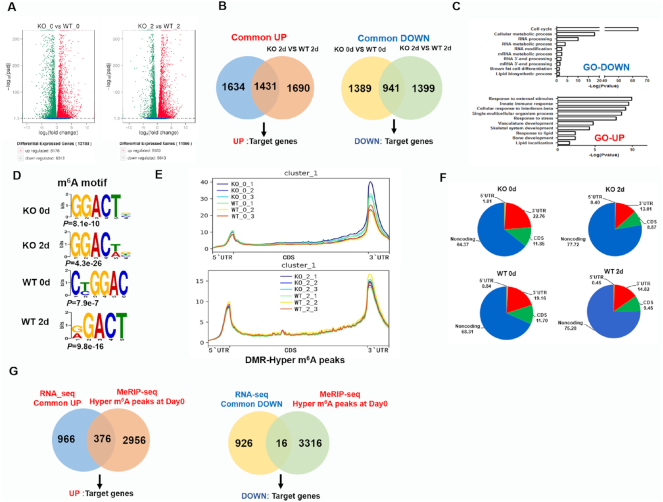
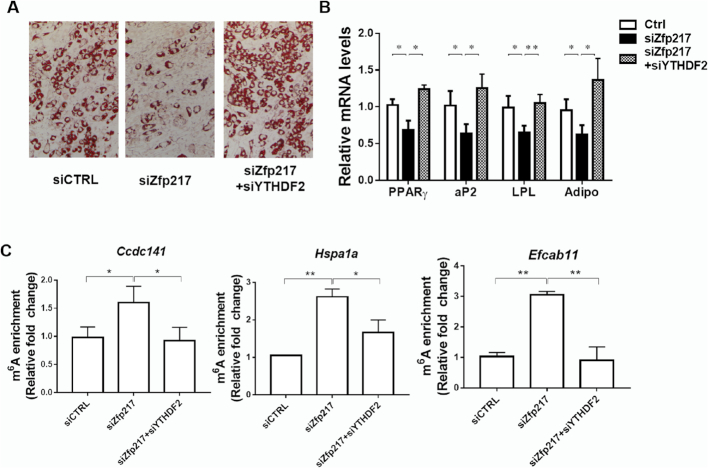
选择了一些其他关键目标用于进一步实验,来自UP组的Ccdc141,来自DOWN组的Efcab11,来自参考文献的Hspa1a,观察到RNA-seq数据的显着变化。接下来,为了验证RNA-seq和MeRIP-seq的结果,选择这些基因用于QPCR和MeRIP-QPCR分析。他们用RNA-seq显示相似的基因表达谱,并且MeRIP-QPCR显示在Zfp217缺失后这些转录物上的m6A修饰增加。此外,为了验证这些靶基因的作用,siRNA对Ccdc141,Hspa1a和Efcab11的功能丧失影响表现出脂肪生成水平的降低。总之,我们的数据揭示了这种正相关关系。在脂肪形成过程中Zfp217敲除后mRNA表达与m6A mRNA甲基化之间的关系。
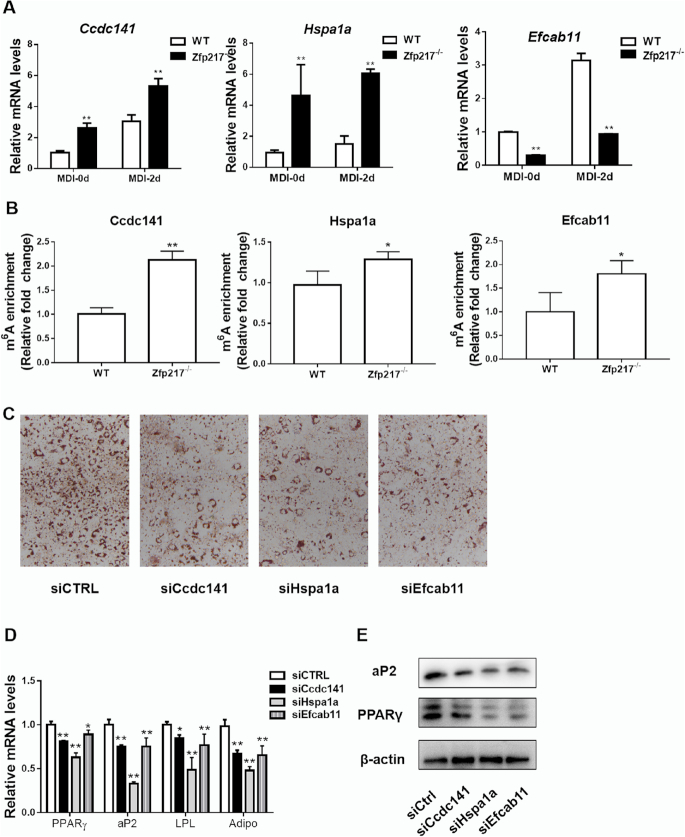
5.Zfp217与YTHDF2相互作用以维持FTO的m6A去甲基化活性
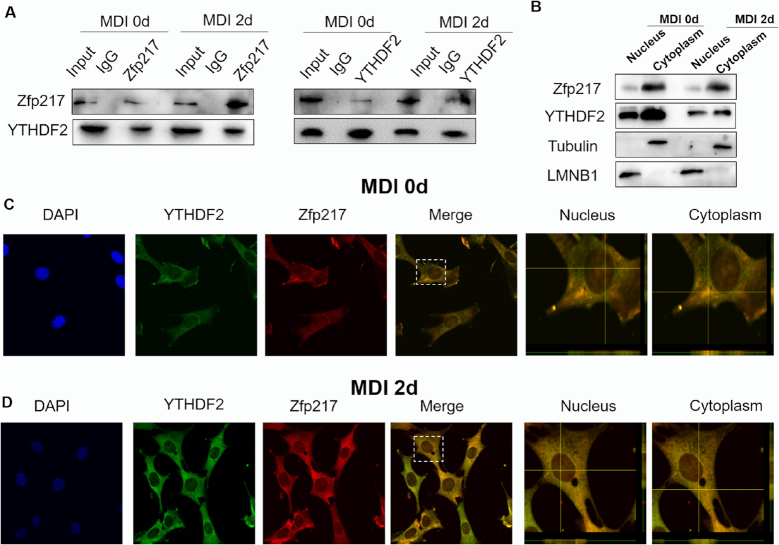
为了进一步探索Zfp217促进脂肪生成的分子机制,进行了免疫沉淀实验,通过Co-IP验证了Zfp217和YTHDF2之间的特异性相互作用,以及3T3L1(有无MDI处理)和HEK293T细胞中内源蛋白和Flag标记蛋白的反向Co-IP实验。因此,这两种蛋白质都是分布在3T3L1和HEK293T全细胞中,Zfp217在细胞质中的表达多于细胞核。共聚焦显微镜检查,以监测内源性Zfp217和YTHDF2的细胞定位。有趣的是,使用共聚焦Z分析在细胞核和细胞质中观察到YTHDF2和Zfp217的共定位,这可能表明YTHDF2在Zfp217依赖性脂肪细胞生成中的特定功能。
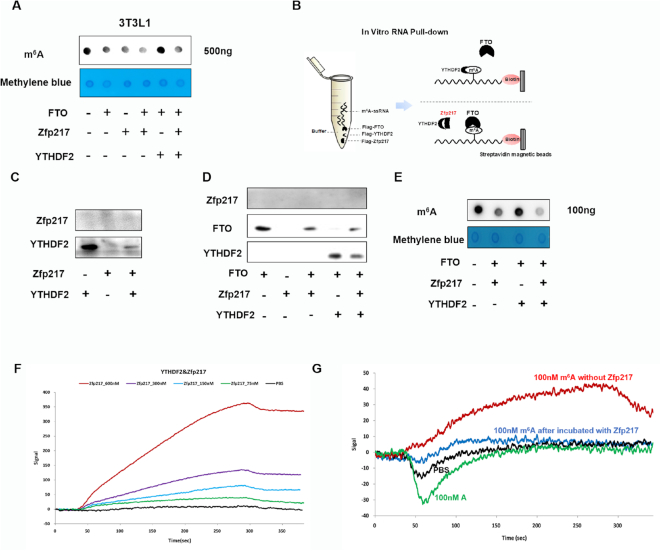
我们进一步全面分析了YTHDF2和Zfp217与FTO相互作用的生物学功能。正如预期,FTO和Zfp217的过表达显示较低的m6A水平,YTHDF2阻断FTO的去甲基化酶活性以增加m6A水平,而Zfp217作为调节剂使平衡倾向于去甲基化。体外m6A RNA pull-down试验证实了FTO和YTHDF2之间的直接竞争,靶向Hspa1a的m6A ssRNA。显然,Zfp217不与RNA结合,而是干扰YTHDF2位置并拯救FTO以结合RNA。结合体外RNA下拉和斑点印迹测定以评估FTO的m6A去甲基化活性,还证实Zfp217螯合YTHDF2以维持FTO的m6A去甲基化活性。为了确定Zfp217是否在体外与YTHDF2直接相互作用,我们进行了LSPR。结果清楚地表明Zfp217以剂量依赖性方式直接与YTHDF2相互作用。结合YTHDF2后,Zfp217组织含m6A的ssRNA与YTHDF2结合。
6.YTHDF2的敲低挽救了对Zfp217消耗介导的脂肪生成的抑制
为了进一步研究Zfp217如何通过m6A修饰调节靶基因的潜在分子机制,关注YTHDF2并验证其在Zfp217介导的脂肪生成中的作用。YTHDF2的敲低挽救了Zfp217缺陷细胞中的脂肪形成,而YTHDF2敲低后基因的m6A修饰较低,表明YTHDF2在Zfp217介导的脂肪生成起关键作用。
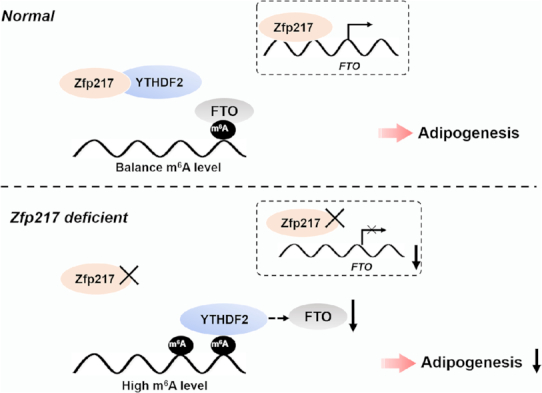
总之,这些结果确定Zfp217以YTHDF2依赖性方式平衡关键基因的表达,最终导致脂肪生成的促进。提出了一种Zfp217调节脂肪生成的方式。






