LncRNA调控糖尿病心肌病的心肌细胞自噬
糖尿病性心肌病是严重威胁糖尿病患者生命的一类的心肌疾病,如何预防和有效救治这一疾病,对挽救糖尿病患者的生命有重大意义。近期,一篇名为“LncRNA DCRF regulates cardiomyocyte autophagy by targeting miR-551b-5p in diabetic cardiomyopathy”的文章,在Theranostics上发表,文章中报道了关于DCM的最新研究成果。研究者们通过一系列的实验,研究了高糖环境下DCRF/miR-551b-5p/PCDH17通路如何调节心肌细胞自噬,是功课糖尿病心肌病这一疾病的新突破口。
摘要:
背景:研究者们建立了糖尿病心肌病(DCM)大鼠模型,并报告了长非编码RNA DCRF的显着上调。本研究旨在探讨DCRF在DCM发生发展中的分子机制。
方法:采用实时定量PCR和RNA荧光原位杂交技术检测DCRF在心肌细胞中的表达模式。用组织学和超声心动图分析评估DCRF敲低对糖尿病大鼠心脏结构和功能的影响。mRFP-GFP-LC3荧光显微镜、透射电子显微镜和Western blotting检测心肌细胞自噬。通过RNA免疫沉淀和荧光素酶报告实验来阐明DCRF/miR-551b-5p/PCDH17通路在心肌细胞自噬中的调节作用。
结果:研究结果表明,DCRF敲低可减少糖尿病大鼠心肌细胞自噬,减轻心肌纤维化,改善心功能。高糖增加心肌细胞DCRF表达并诱导自噬。RNA免疫沉淀和荧光素酶报告分析表明,DCRF以AGO2依赖的方式被miR-551b-5p靶向,PCDH17是miR-551b-5p的直接靶标。强迫表达DCRF可减弱miR-551b-5p对PCDH17的抑制作用。此外,DCRF敲低降低PCDH17的表达并抑制高糖处理的心肌细胞的自噬。
结论:研究表明,DCRF可以作为竞争的内源性RNA,通过海绵miR-551b-5p增加PCDH17的表达,从而促进DCM中心肌细胞自噬的增加。
技术路线:
结果:
1. DCRF在心肌细胞中的表达模式
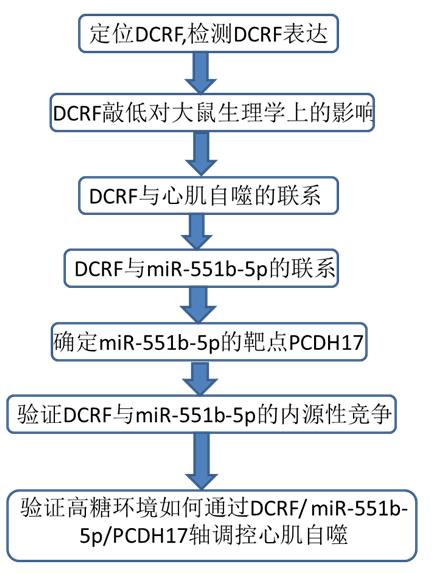
DCRF位于大鼠基因组RNOR_6中的Chr2:228036171-228036880,其序列如表1所示。实时PCR和FISH分析表明,DCRF主要表达在心肌细胞的细胞质中(图1A和B)。此外,DCRF在糖尿病大鼠心肌和高糖处理的心肌细胞中表达上调(图1C和D)。
表 1. DCRF 序列

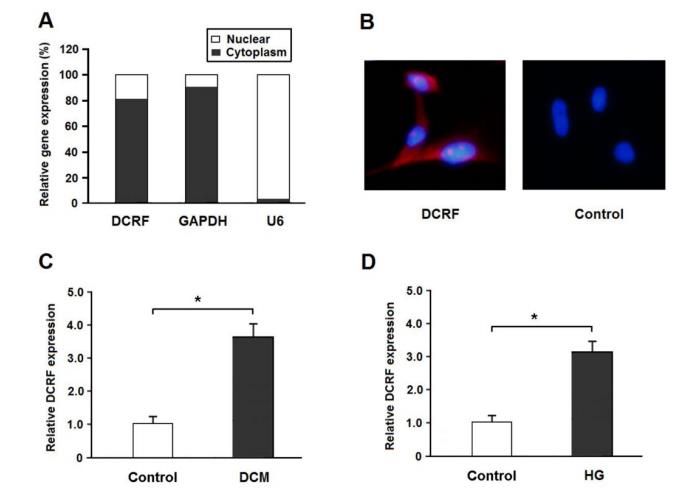
图1. DCRF在心肌细胞中的表达模式。 (A) 实时荧光定量PCR检测DCRF、GAPDH(细胞质对照)和U6(细胞核对照)在心肌细胞核和细胞质部分的表达。(B) 用Cy3标记的正义(Control)和反义探针(DCRF)进行RNA-FISH检测DCRF在心肌细胞中的表达。(C, D) 实时定量PCR检测DCM大鼠心肌组织和高糖(HG,30 mmol/L)处理的心肌细胞中DCRF的表达。 (n = 5, *P < 0.05)。
2. DCRF敲低改善糖尿病大鼠组织学异常
心肌组织HE染色和Masson‘s三色染色,测定CsA和CVF。HE染色显示糖尿病心肌的典型组织学变化,包括心肌细胞肥大,心肌纤维断裂,细胞间隙增加,而DCRF敲低与较少的组织学异常相关(图2A)。此外,Masson染色表明DCRF的表达减少可以减轻糖尿病大鼠的心肌纤维化(图2B)。此外,CSA和CVF在DM组明显增加,DM+DCRF-shRNA组降低(图2C和D)。
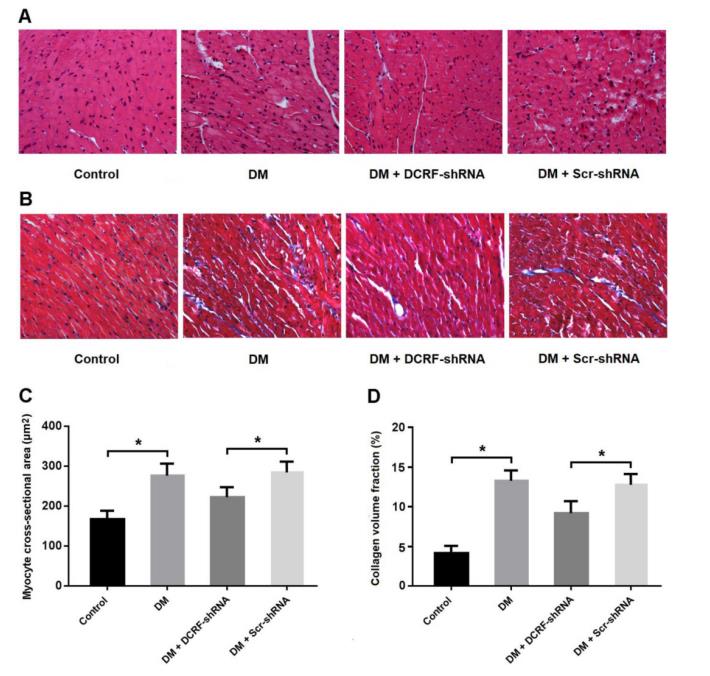
图2. DCRF敲低可改善糖尿病大鼠的组织学异常。 (A, C) 用 hematoxylin-eosin staining染色心肌组织,测量心肌细胞横截面积。 (B, D) 用Masson‘s三色染色法对心肌组织进行染色,计算胶原体积分数。 (n = 5, *P < 0.05)。
3. DCRF敲低改善糖尿病大鼠心功能
经胸超声心动图评价DCRF敲低对心脏结构和功能的影响。如图3A所示,DCRF在糖尿病心肌中表达上调,并在DCRF-shRNA转染后下调。超声心动图测量显示DM组LVESD和LVEDD增加,DM+DCRF-shRNA组LVESD和LVEDD降低(图3B和C)。此外,糖尿病大鼠的LVFS和LVEF降低,而DCRF敲低可改善左心室功能(图3D)。
图3. DCRF敲低可改善糖尿病大鼠的心功能。 (A) 实时荧光定量PCR检测心肌组织中DCRF的表达(n = 5, *P < 0.05)。 (B-D) 超声心动图评价心脏结构和功能(n = 5, *P < 0.05)。LVESD=左心室收缩末期内径;LVEDD=左心室舒张末期内径;LVFS=左心室短轴缩短率;LVEF=左心室射血分数。
4.DCRF参与心肌细胞自噬的调节
透射电镜和mRFP-GFP-LC3荧光显微镜检测心肌细胞自噬。如图4A所示,自噬在糖尿病心肌中升高,而DCRF敲低显著减少了自噬小体的数量。此外,高糖处理与心肌细胞自噬增加有关,而DCRF-siRNA转染可以减弱高糖诱导的自噬(图4B)。
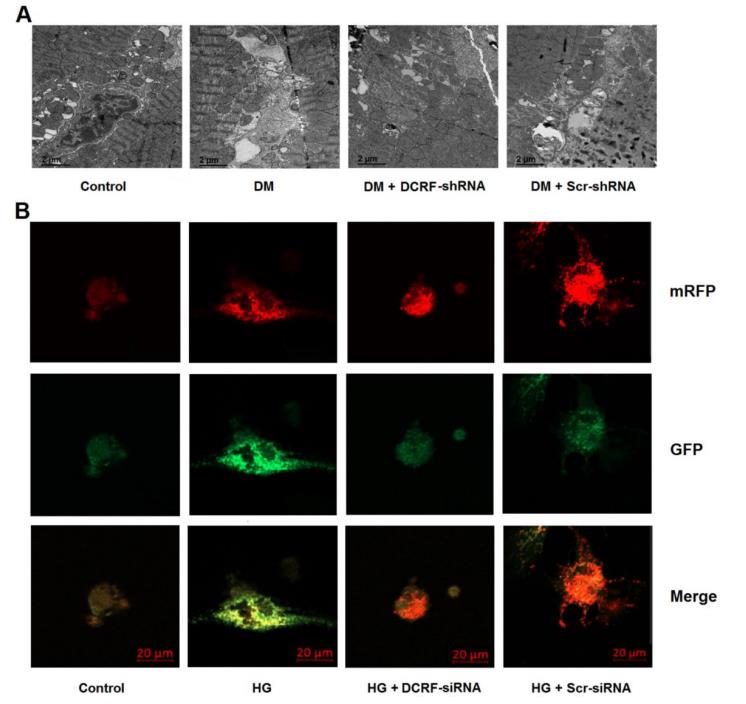
图4. DCRF参与了心肌细胞自噬的调节。 (A) 糖尿病大鼠心肌内注射含有DCRF-shRNA或scrambled-shRNA的腺相关病毒。12周后,用透射电镜检测心肌中的自噬小体。(B) 将含有DCRF-siRNA或scrambled-siRNA的腺病毒转染心肌细胞,然后暴露于高糖(HG,30 mmol/L)。48小时后,采用串联mRFP-GFP-LC3荧光显微镜观察心肌细胞自噬情况。
5. miR-551b-5p以AGO2依赖的方式靶向DCRF
生物信息学分析表明,DCRF序列包含miR-551b-5p的假定结合位点(图5A)。miR-551b-5p mimics转染的HEK293细胞中miR-551b-5p的表达升高(图5B)。将DCRF cDNA克隆到荧光素酶基因(Luc-DCRF-Wt)下游,用miR-551b-5pmimics转染HEK293细胞。然后我们在DCRF中突变miR-551b-5p结合位点,产生Luc-DCRF-Mut。荧光素酶实验表明miR-551b-5p转染可抑制Luc-DCRF-Wt的活性,但不能抑制LUC-DCRF-MUT的活性(图5C)。
DCRF主要表达于心肌细胞的细胞质中。因此,我们推测DCRF可能通过起miRNA海绵的作用来调节基因表达。AGO2蛋白是RNA诱导的沉默复合体的核心成分。RIP分析显示DCRF和miR-551b-5p在抗AGO2而不是抗IgG下拉的免疫沉淀中特别丰富(图5D).
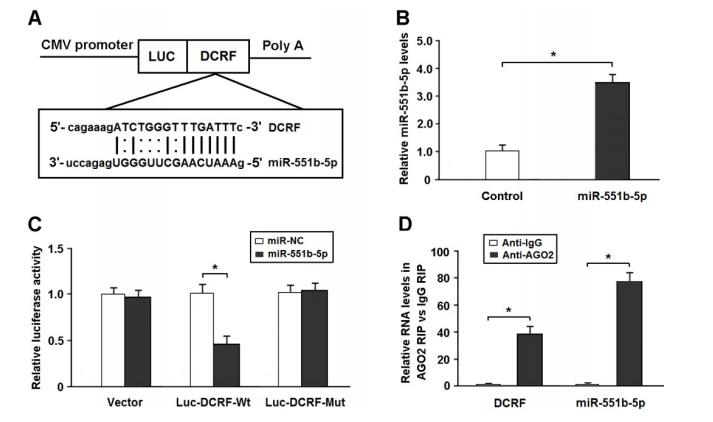
图5. DCRF以AGO2依赖的方式被miR-551b-5p靶向。 (A) 生物信息学预测表明,DCRF序列含有miR-551b-5p的推测结合位点。(B) miR-551b-5pmimics转染HEK293细胞后miR-551b-5p的表达增加(n = 3, *P < 0.05)。(C) 将DCRF cDNA克隆到荧光素酶基因(Luc-DCRF-Wt)下游,用miR-551b-5pmimics或对照寡核苷酸转染进HEK293细胞。将DCRF中的miR-551b-5p结合位点突变为luc-DCRF-Mut。转染48小时后检测荧光素酶活性(n = 3, *P < 0.05)。(D) RIP法验证DCRF和miR-551b-5p是否与心肌细胞中的AGO2直接结合(n = 3, *P < 0.05)。
6. PCDH17是心肌细胞中miR-551b-5p的直接靶点
在miR-551b-5p的潜在靶点中,我们对参与自噬调节的PCDH17感兴趣(图6A)。将PCDH17的3‘-UTR融合到荧光素酶的编码区,用miR-551b-5pmimics转染进HEK293细胞。结果表明PCDH17是miR-551b-5p的直接靶标(图6B)。此外,在miR-551b-5p antiagomir转染后,PCDH17的表达增加,从而导致自噬增强,而PCDH17敲低可以减弱miR-551b-5p antagomir转染后的自噬(图6C和D)。
为了确定DCRF是否竞争性地抑制miR-551b-5p与PCDH17的结合,我们在HEK293细胞中进行了荧光素酶报告试验。结果表明,DCRF可抵消miR-551b-5p对PCDH17的抑制作用(图6e),提示DCRF可能通过海绵miR-551b-5p发挥竞争内源性RNA(ceRNA)的作用,控制PCDH17的表达。
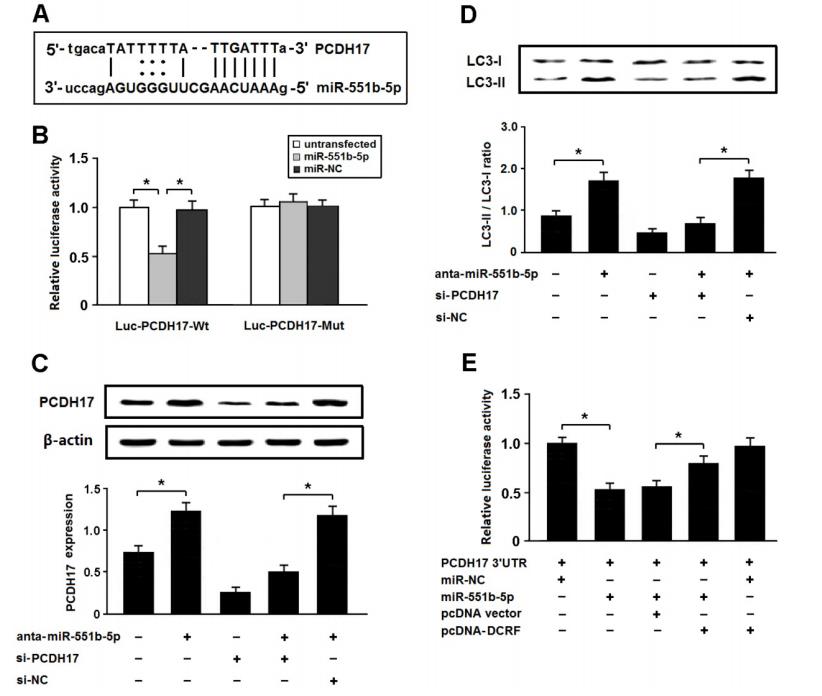
图 6. PCDH17是心肌细胞miR-551b-5p的直接靶点。 (A) 利用miRBase预测PCDH17为miR-551b-5p的靶基因。(B) 用miR-551b-5p模拟物和pcDH17 3‘UTR(luc-PCDH17-Wt)或突变体(luc-PCDH17-Mut)的荧光素酶结构转染HEK293细胞。转染48小时后检测荧光素酶活性(n = 3, *P < 0.05)。(C) 将miR-551b-5p antiagomir和/或PCDH17 siRNA转染心肌细胞。Western blotting检测PCDH17的表达(n = 3, *P < 0.05)。(D) 通过检测LC3的表达来评估心肌细胞的自噬(n = 3, *P < 0.05)。(E) 用pcDH17 3‘UTR、miR-551b-5p mimic和pcDNA-DCRF的荧光素酶质粒转染HEK293细胞。荧光素酶测定确定DCRF是否竞争性地抑制miR-551b-5p与PCDH17的结合 (n = 3, *P < 0.05)。
7. 高糖通过调节DCRF/PCDH17轴促进自噬
转染DCRF-siRNA和/或pc DNA-PCDH17后,将心肌细胞置于高糖环境中,Western blotting检测LC3的表达。结果表明,高糖可增加PCDH17表达并诱导心肌细胞自噬,而DCRF敲低与PCDH17表达降低和心肌细胞自噬有关。此外,DCRF-siRNA和PC DNA-PCDH17共转染促进了高糖处理的心肌细胞的自噬(图7A-C)。
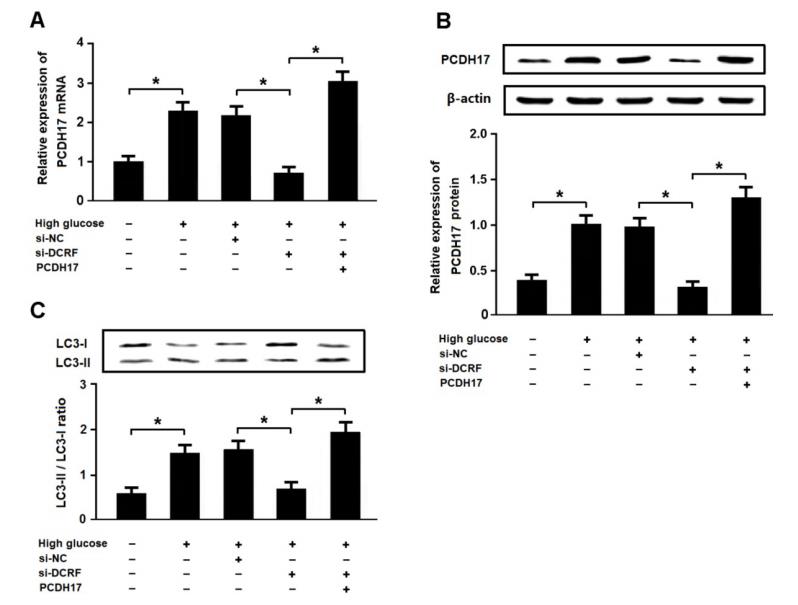
图 7. 高糖通过调节DCRF/PCDH17轴促进自噬。 (A, B) 用含DCRF-siRNA或PCDH17的腺病毒转染心肌细胞,然后置于高糖环境(30 mmol/L)48h。实时荧光定量PCR和Western blotting分析PCDH17的表达(n = 3, *P < 0.05)。 (C) 通过检测LC3的表达来评估心肌细胞的自噬(n = 3, *P < 0.05)。
结论:
研究显示DCRF在糖尿病心肌中的表达增加。通过发挥ceRNA的作用,DCRF可以通过海绵miR-551b-5p上调PCDH17,从而激活心肌细胞自噬,从而促进DCM的进展。






