环状RNA circRHOT1 通过激活NR2F6表达促进肝细胞癌的进展
桂林医科大学附属医院胃肠科的Liyan Wang,2019 年7月发表在Molecular Cancer 的一篇文章,IF=10.679。因为越来越多的证据表明non-coding RNAs与癌症进展之间存在密切关系。最近发现的non-coding RNAs的新成员circRNAs被证明参与多种生物过程,如发育、稳态维持和病理反应。circRNAs在癌症中的作用近来受到广泛关注。目前为止,circRNAs在肝细胞癌(HCC)中的表达模式和作用很大程度的基本未知。

技术路线:
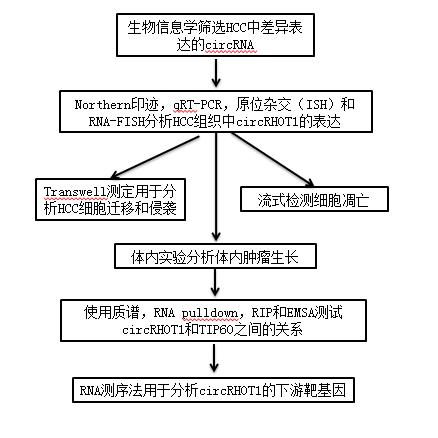
结果:
一、CircRHOT1 在HCC组织中过度表达
为了确定在肝细胞癌组织中表达至关重要circRNAs,研究者分析关于HCC组织中circRNAs分布的数据库。发现许多circRNAs在HCC组织相比癌旁组织中过度表达(图1a)。研究者通过PCR和RNA测序来测定100对HCC组织和癌旁组织中的circRHOT1水平。结果发现,在肿瘤组织中circRHOT1显著上调(图1b)。选择5对HCC组织样本进行northern blot验证,结果显示circRHOT1在肿瘤组织中显著过表达(图1c)。进一步使用生物素标记特异性探针的原位杂交(ISH)和荧光原位杂交(FISH)检测circRHOT1的表达。结果显示,HCC组织中存在更多的circRHOT1(图1d,e)。采用qRT-PCR检测了不同分期HCC组织中circRHOT1的表达情况,结果显示第三阶段组织中的表达比第一/第二阶段样品中的高(图 1f)。此外,在晚期HCC组织中的表达高于早期HCC组织(图 1g)。通过Kaplan–Meier生存分析,研究者发现HCC患者的circRHOT1表达较高,预后较差(图 1h, i)。综上所述,研究者的数据表明,circRHOT1在HCC组织中高度表达,并与不良预后相关。
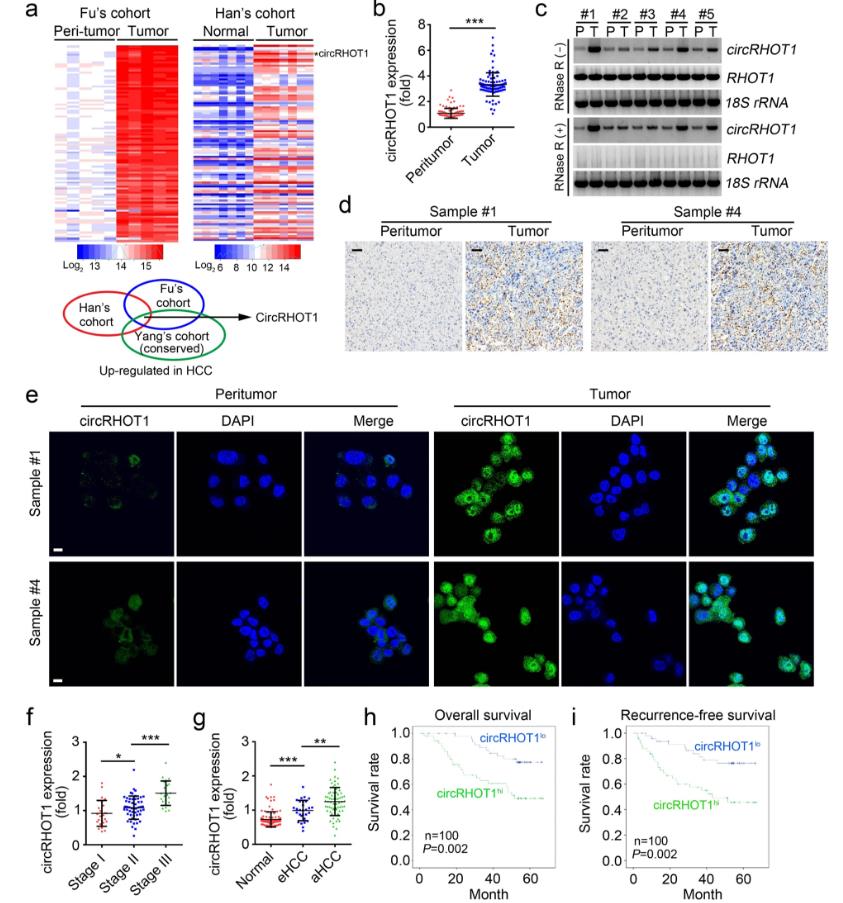
图1 CircRHOT1 在HCC组织中过度表达。a HCC组织中上调circRNA的热图。在这两个群体中,circRHOT均显著上调和保守。b 100对HCC患者癌症组织及癌旁组织中circRHOT的相对表达水平。c使用5对HCC样本通过northern blot分析circRHOT表达。(P表示肿瘤周围;T表示肿瘤。)使用backsplice连接探针检测到circRHOT1。使用RHOT1特异性探针检测RHOT1 mRNA。18S是加载对照,用于18S检测的RNA样品未用RNA酶处理。d,e用原位杂交(d)和核酸荧光原位杂交(e)使用HCC样本#1和#4。ISH用比例尺为50 μm,FISH用比例尺为10 μm f用qRT-PCR检测HCC不同临床阶段标本中circRHOT的表达。g用qRT-PCR检测肿瘤、早期HCC和晚期HCC中circRHOT的相对表达水平。 h,i 100对HCC样本根据circRHOT表达式分为高组和低组。Kaplan–Meier生存率分析,以确定总生存率(h)和无复发生存率(i)。 * p <0.05,** p <0.01和*** p <0.001。所有数据代表至少三个独立的实验,并以平均值SD表示
二、CircRHOT1 基因敲除抑制HCC细胞增殖、迁移和侵袭,促进了细胞凋亡。
我们通过CRISPR / Cas9技术敲除circRHOT1右侧区域#3,构建了circRHOT1缺失 HCC细胞系。通过PCR,Northern blot和qRT-PCR(图2a)证实了。circRHOT1缺失不影响RHOT1 mRNA和蛋白质的表达。然后进行了CCK-8、集落形成和EdU掺入试验,以评估circRHOT1对细胞增殖的影响。如图所示,circRHOT1敲除显著抑制细胞增殖、集落形成和EdU掺入(图2b-d)。 Transwell分析发现circRHOT1基因敲除显著抑制了HCC细胞的迁移和侵袭(图2e,f)。此外,circRHOT1缺失显著促进凋亡细胞百分比(图2g),通过检测Caspase 3/7活性进一步证实(图2h)。为了进一步验证circRHOT1对HCC细胞的影响,研究者使其在HCC细胞系中的表达沉默。CCK8、集落形成、EdU掺入、Transwell和FACS的功能性实验结果也表明,circRHOT1敲低抑制了HCC细胞的增殖、迁移和侵袭,但促进细胞凋亡。用野生型小鼠和缺失circRHOT1的HCC细胞进行异种移植实验检测功能性。如图2i所示. circRHOT1基因敲除显著降低了肿瘤的重量。此外,用circRHOT 1低表达或高表达HCC细胞的异种移植实验表明circRHOT 1过表达促进体内肿瘤生长(图2j)。总之,circRHOT1促进了HCC的发展。
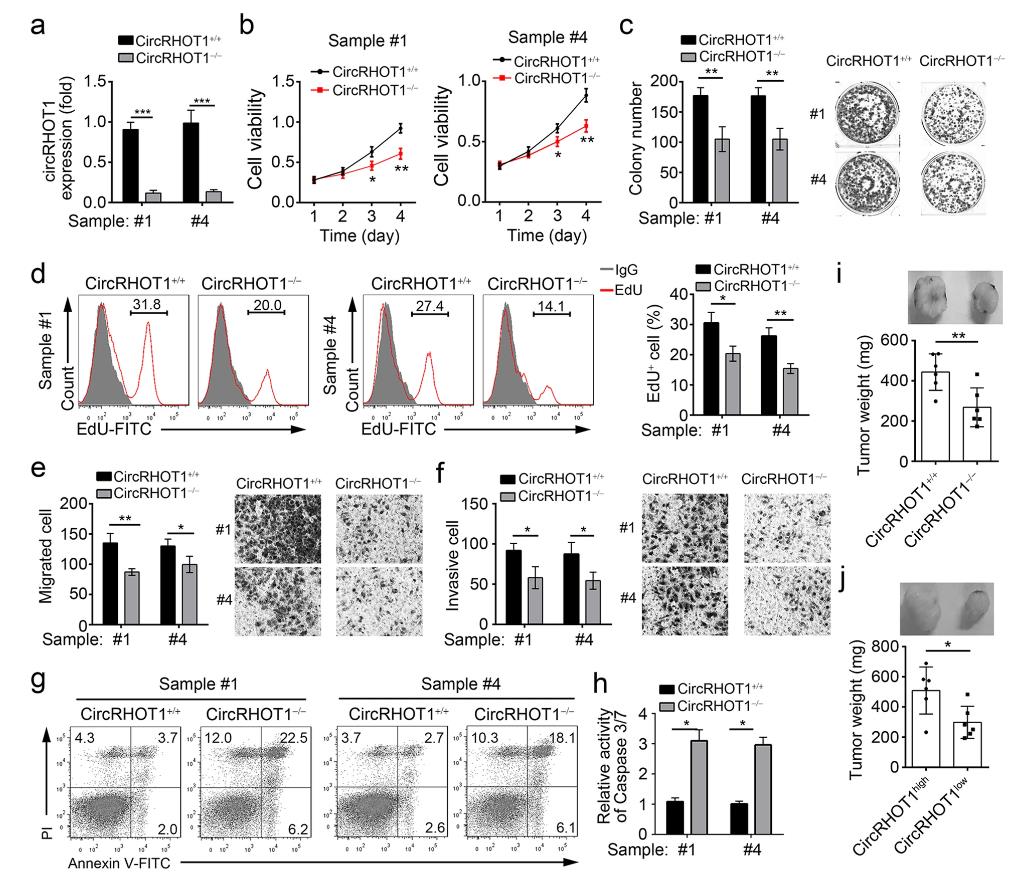
图2 CircRHOT1 基因敲除抑制HCC细胞增殖、迁移和侵袭,但促进凋亡。a用qRT-PCR分析了circRHOT 1基因敲除的HCC细胞中circRHOT 1的表达。b-d用CCK-8(b),集落形成(c)和EdU掺入试验(d)测定circRHOT1对HCC细胞增殖的影响。e,f通过transwell试验评估了circRHOT1对侵袭(e)和迁移(f)的影响。g膜联蛋白V/PI染色,流式检测HCC细胞凋亡。h通过使用Caspase 3/7活性细胞凋亡检测试剂盒测量Caspase 3/7活性。i将野生型和circRHOT1缺失的HCC细胞皮下注射到裸受体小鼠中。四周后,测量肿瘤重量。j将circRHOT1低和高表达的HCC细胞皮下注射到裸受体小鼠中。四周后,测量肿瘤重量。 * p <0.05,** p <0.01和*** p <0.001。所有数据代表至少三个独立的实验,并以平均值SD表示
三、CircRHOT1 调节HCC细胞中NR2F6的表达
RNA测序分析了在circRHOT1缺失后差异表达的基因,发现被下调的基因中NR2F6在HCC细胞中具有较高表达值且最显著下调(图3a)。基于倍数变化和表达水平选择了7个下调基因,通过qRT-PCR验证RNA测序结果(图3b)。蛋白质印迹显示NR2F6蛋白水平在circRHOT1缺失的HCC细胞中显著降低,circRHOT1主要分布在细胞核中(图1d,e)。为了确定circRHOT1是否调节NR2F6转录,研究者用特异性生物素标记的circRHOT1探针通过RNA纯化(CHIRP)进行染色质分离,发现circRHOT1可以富集在NR2F6启动子转录起始位点(TSS)1000 ~ 800 bp的区域(图 3d)。此外,组蛋白活性修饰H3K27Ac的富集在circRHOT1敲除后减少,而H3K27me3的富集增加(图3e,f)。RNApol在CircRHOT1缺失后不能与NR2F6启动子结合(图 3g)。此外,NR2F6启动子在circRHOT1缺失的HCC细胞中对脱氧RNA酶消化更具抗性(图3h),表明circRHOT1对NR2F6启动子是不可或缺的。试验发现在这个区域缺失后,circRHOT1不能在NR2F6启动子上富集(图3I)。此外,研究者发现过表达的circRHOT1提高了NR2F6的基因水平,而结合区的缺失消除了这种效应(图3j)。因此,circRHOT1与NR2F6启动子相关并促进其表达。
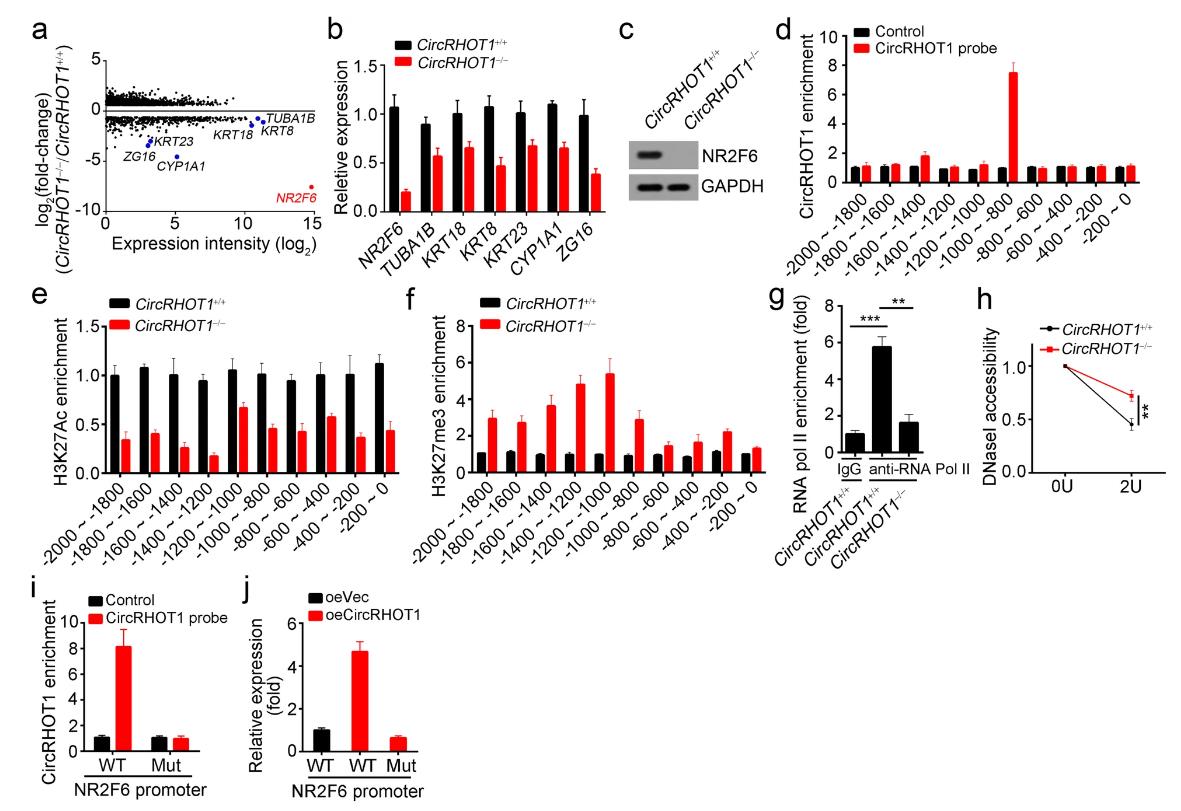
图3 CircRHOT1 调节HCC细胞中NR2F6的表达。a Bland-Altman不同表达基因图(log 2(倍数变化) > 1.5),列出了7个选定的基因。红色图表示NR2F6。b qRT-PCR检测了野生型和缺失circRHOT1的HCC细胞中大多数下调基因的表达。c蛋白质印迹检测NR2F6的表达。d在HCC细胞中,通过使用特异性生物素标记探针的RNA纯化(CHIRP)来分离染色质,评估circRHOT1在NR2F6启动子上的富集。e-g通过WT和circRHOT1缺失的HCC细胞中的染色质免疫沉淀(ChIP)测定在NR2F6启动子上H3K27Ac(e),H3K27me3(f)和RNA pol II(g)的富集。h通过DNAse I消化评估启动子可及性。i敲除NR2F6启动子中circRHOT1的结合区域,然后通过CHIRP评估circRHOT1的富集。J 在指定的HCC细胞中通过qRT-PCR测定NR2F6的mRNA水平。** p <0.01和*** p <0.001。所有数据均代表至少三次独立实验,并以均值±SD表示
四、CircRHOT1 与TIP60的关系
为了研究circRHOT1是否与特定蛋白合作来调节NR2F6的表达,研究者使用HCC细胞裂解物进行了RNA pull down,然后进行银染和质谱鉴定出TIP60是一种潜在的环状蛋白1的互作蛋白(图4a)。此外,用TIP60过表达的HCC细胞 pull down RNA显示生物素标记的circRHOT1沉淀标志-TIP60(图 4b)。此外,生物素标记的探针circRHOT1可以在野生型HCC细胞裂解物中沉淀内源性TIP60(图 4c)。此外,特异TIP60抗体在HCC细胞中富集内源性circRHOT1(图4d)。根据FISH测定,在HCC细胞中,circRHOT1与TIP60共定位(图4e)。RNA-EMSA分析表明,TIP60直接与circRHOT1相互作用(图4f)。
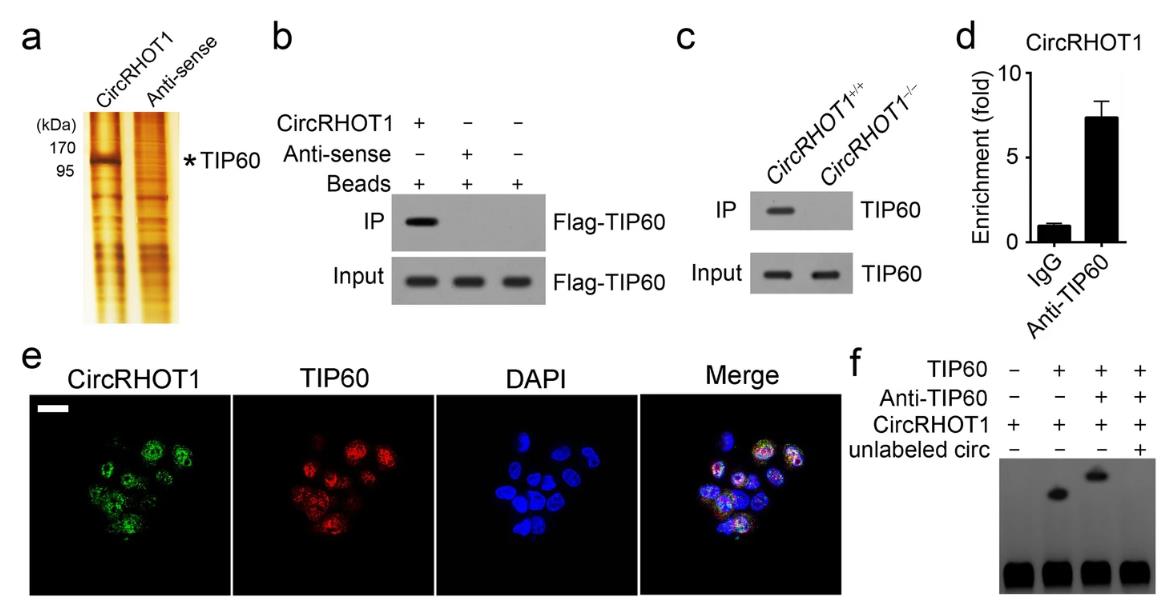
图4 CircRHOT1 与TIP60相关联。a将特异性生物素标记的circRHOT1探针加入HCC裂解液中,沉淀的蛋白质通过SDS-PAGE分离,进行银染色。通过质谱分析(MS)来鉴定环形探针通道中的差异带。circRHOT1的反义作为对照,识别出TIP60。b使用TIP60过度表达的HCC细胞进行RNA pulldown以验证TIP60和大约T1之间的相互作用。生物素标记的circRHOT1或反义用于沉淀标志-TIP60。c特异性生物素标记的circRHOT1探针没有在circRHOT1敲除的HCC细胞中沉淀TIP60。d RNA分子印迹结果表明,HCC细胞中TIP60富集约T1。e RNA荧光原位杂交(FISH)显示,在HCC细胞中,circRHOT1与TIP60共定位。比例尺,10 μm。f RNA EMSA分析表明,TIP60与circRHOT1直接相互作用。线性circRHOT1用生物素标记。所有数据代表至少三个独立的实验,并以平均值SD表示
五、CircRHOT1富集TIP60来激活NR2F6表达
为了进一步确定TIP60是否参与NR2F6表达的调节,研究者用HCC细胞进行了ChIP测定。研究者发现TIP60在与NRRF1启动子相同的区域中与circRHOT1富集(图5a)。此外,敲除TIP60还抑制H3K27Ac和RNA pol在NR2F6启动子上的富集(图5b,c)。此外,TIP60缺失下调了HCC细胞NR2F6的基因和蛋白水平(图 5d,e)。接下来,研究者想确定在TIP60介导的NR2F6表达中,circRHOT1的作用。研究者发现CircRHOT1 敲除取消了TIP60在NR2F6启动子上的富集(图5f)。DNA FISH还表明,circRHOT1基因敲除消除了TIP60与NR2F6启动子的共定位(图 5g)。重要的是,circRHOT1缺陷导致NuA4复合体的富集失败NR2F6启动子,而NuA4复合物结合到NR2F6对照HCC细胞中启动子(图5h)。此外,circRHOT1和TIP60的双重敲除进一步抑制了HCC细胞中NR2F6的基因水平(图1)。5I)。然后,研究者分析了HCC组织中circRHOT1、TIP60和NR2F6的表达水平之间的关系。研究者发现HCC组织中NR2F6的蛋白和基因水平与TIP60的蛋白和基因水平呈正相关。5j,k)。此外,HCC组织中NR2F6和circRHOT1的表达呈正相关(图2)。总之,CircRHOT1 对HCC组织中TIP60介导的NR2F6表达是必需的。
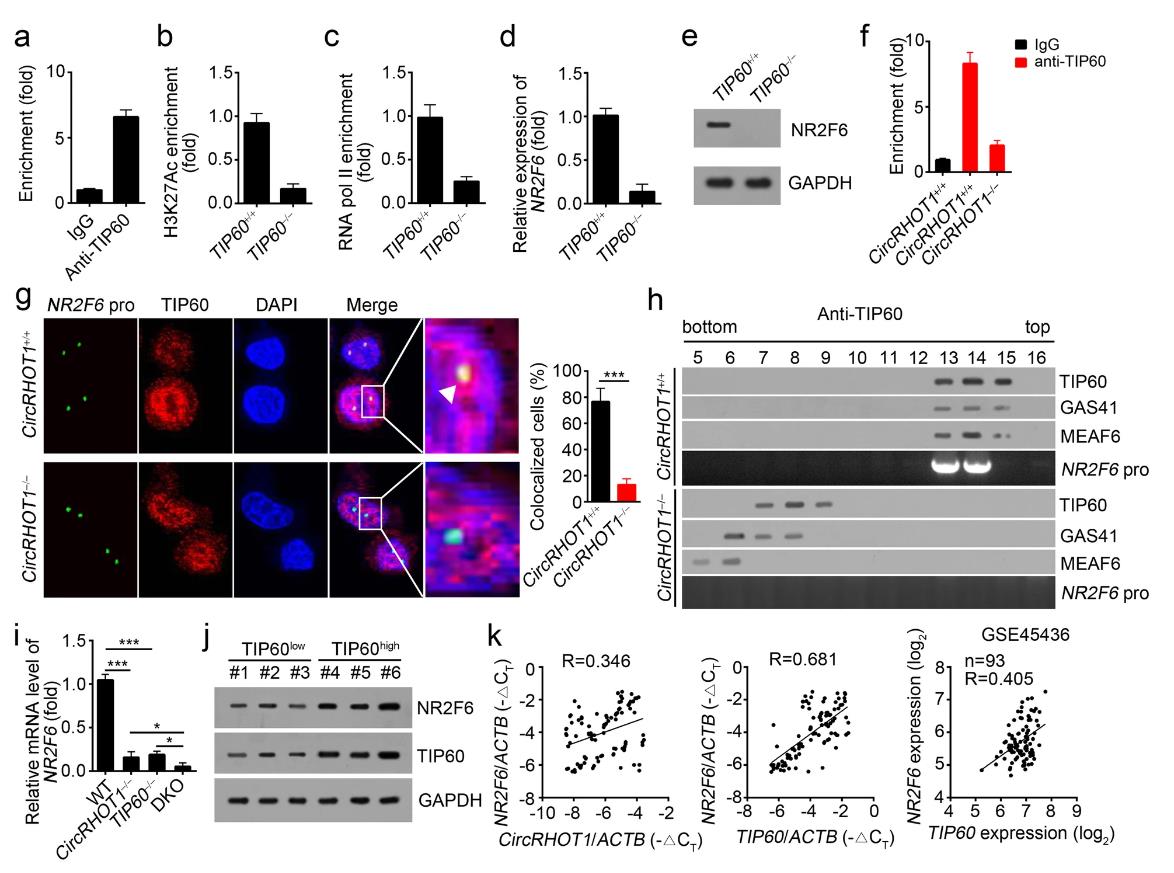
图5 circRHOT1富集TIP60以激活NR2F6表达。a ChIP实验表明,TIP60与NR2F6启动子在与circRHOT1相同的区域相关。b,c TIP60敲除显著降低H2K27Ac的富集(b)和RNA pol II(c)在NR2F6启动子上。d,e TIP60敲除能显著抑制基因表达(d)和蛋白质水平(e)在HCC细胞中的表达。f,g RNA IP(f)和RNA FISH(g)结果表明,circRHOT1敲除抑制了HCC细胞中TIP60与NR2F6启动子的关联。比例尺,10 μm。h将所示的HCC细胞裂解并用1%甲醛处理进行交联。接下来,将anti-TIP60与经处理的裂解物一起孵育,用于ChIP分析,随后分别通过蔗糖梯度超速离心进行尺寸分级。洗脱液梯度通过蛋白质印迹和PCR检测。i circRHOT1和TIP60双敲除对NR2F6基因表达水平的抑制更为严重。j用蛋白质印迹法测定HCC组织中TIP60和NR2F6的蛋白水平。k根据GSE45436数据集,NR2F6的表达与HCC组织中的circRHOT1和TIP60的表达呈负相关。***p<0.001。所有数据代表至少三个独立的实验,并以平均值SD表示
六、NR2F6的恢复了circRHOT1缺失介导的HCC生长和转移的抑制
研究发现NR2F6在HCC癌组织中与癌旁组织的表达相比上调(图6a,b)。研究发现100对HCC样本中NR2F6的表达在肿瘤组织中上调(图6c)。免疫组织化学分析和蛋白质印迹证实HCC组织中NR2F6水平升高(图6d,e)。此外,NR2F6在HCC患者中的高表达提示预后较差(图6f)。然后研究者敲除NR2F6或恢复其在circRHOT1缺失的HCC细胞中的蛋白质水平(图6g)。CCK-8和Transwell分析显示敲除circRHOT1或NR2F6可抑制细胞增殖、迁移和侵袭,而在circRHOT1缺失的HCC细胞中启动NR2F6可在体外恢复细胞增殖、迁移和侵袭(图6h-j)。体内异种移植实验表明敲除circRHOT1或NR2F6抑制肿瘤生长。然而,NR2F6恢复了circRHOT1缺失介导的对肿瘤生长的抑制(图6k)。因此,研究者的结果表明,circRHOT 1通过NR2F6的激活抑制HCC进程。
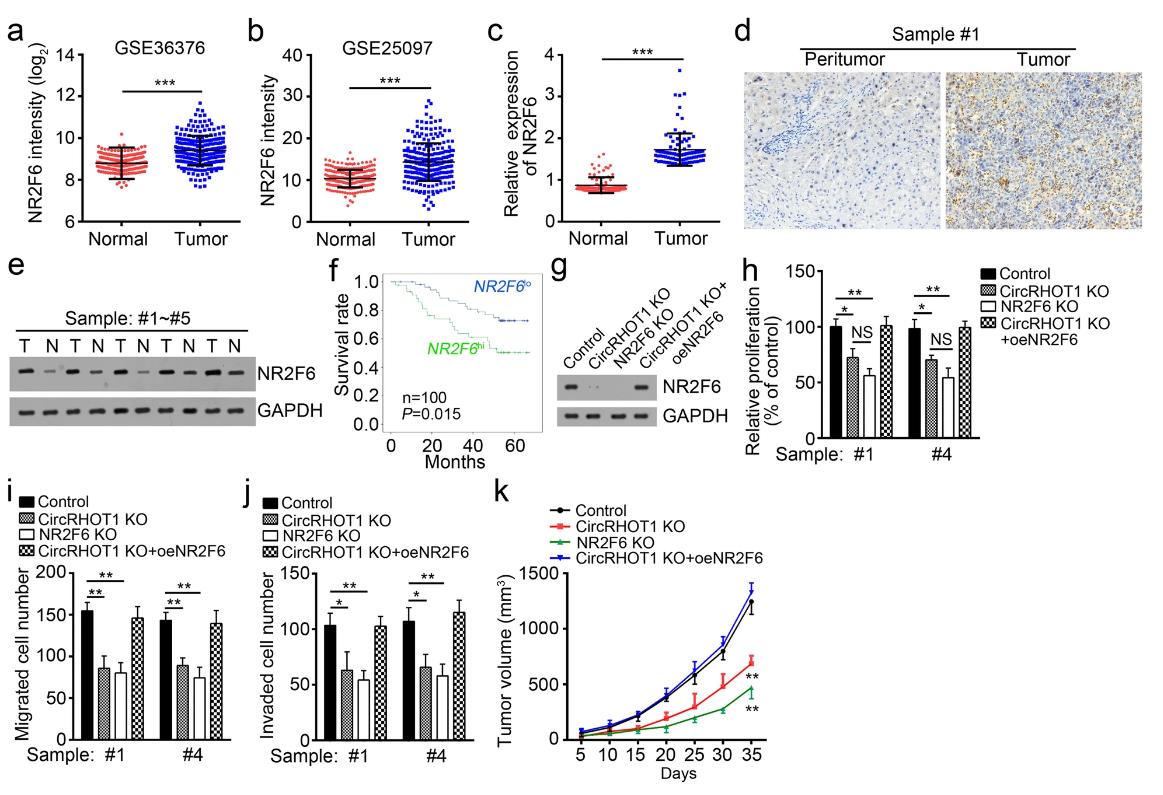
图6 NR2F6的恢复了circRHOT1缺失介导的HCC生长和转移的抑制。a.c根据GSE36376数据集(a),GSE25097数据集(b)和qRT-PCR结果(c)与邻近正常组织相比,在HCC组织中NR2F6 mRNA水平上调。d,e免疫组织化学分析(d)和western blotting(e)表明NR2F6蛋白水平在HCC组织中上调。f Kaplan-Meier生存分析用于评估NR2F6在HCC患者表达的预后意义。g 通过在circRHOT1敲除的HCC细胞中用异位表达质粒的NR2F6转导来恢复NR2F6蛋白水平。h-j通过CCK-8和Transwell测定评估NR2F6对HCC细胞增殖(h),迁移(i)和侵袭(j)的影响。 k 通过异种移植测定NR2F6对体内肿瘤生长的影响。* p <0.05,** p <0.01和*** p <0.001。所有数据均代表至少三次独立实验,并以均值±SD表示
结论:
综上所述,circRHOT1通过富集TIP60来抑制HCC的发展和进步NR2F6表达,表明circRHOT1和NR2F6可能是HCC预后的潜在生物标志物。






