microRNA在神经保护中的实锤!microRNA-223与神经元退化初探
参考文献:
Morquette Barbara., Juźwik Camille A., Drake Sienna S., Charabati Marc., Zhang Yang., Lécuyer Marc-André., Galloway Dylan A., Dumas Aline., de Faria Junior Omar., Paradis-Isler Nicolas., Bueno Mardja., Rambaldi Isabel., Zandee Stephanie., Moore Craig., Bar-Or Amit., Vallières Luc., Prat Alexandre., Fournier Alyson E., (2019). MicroRNA-223 protects neurons from degeneration in experimental autoimmune encephalomyelitis., Brain, 08. IF:11.814
导语:
多发性硬化症是种影响脑,脊髓和视神经的慢性炎症,脱髓鞘和神经退行性疾病。神经元损伤是由各种有害因素引发的,这些因素会影响神经元中不同的信号级联反应;因此,保护神经元的治疗方法需要关注能够针对多个生物过程的药剂。本文将重点集中在microRNA上,因为单个microRNA可以针对许多功能相关的信使RNA使microRNA成为强大的表观遗传调节因子。那么本研究中microRNA究竟是如何调控多发性硬化症的呢?一起来看看吧!
结果分析:
1、miR-23a-3p,miR-27a-3p,miR-146a-5p和miR-223-3p在EAE和多发性硬化症中上调
与对照动物相比,EAE动物的腰部运动神经元中有4种miRNA显着上调;miR-146a-5p(2倍),miR-27a-3p(5倍),miR-23a-3p(7倍)和miR-223-3p(40倍)(图1A)。在视网膜神经元miR-146a5p(2倍)中,与症状前对照动物相比,miR-27a-3p(7倍)和miR-23a-3p(30倍)显着上调。 miR-223-3p未受影响(图1B)。

图1 候选miRNA在EAE和多发性硬化中的表达
2、MiR-27a-3p和miR-223-3p具有神经保护作用
由于作者观察到miR-27a-3p和miR-223-3p在死后多发性硬化组织的活动性和白质皮损中均上调(图1D和F)。所以作者接着做进一步验证,结果发现转染miR-223-3p和miR-27a-3p的神经元正常生长,并且没有表现出任何可能与变性相关的轴突肿胀,断裂或其他迹象(图2A)。然后作者用PBMC-CM或对照-CM处理的miRNA模拟物转染皮质神经元,从性引入M27a或M223可以保护皮层神经元免受PBMC-CM依赖性神经突退化(图2A-C)。
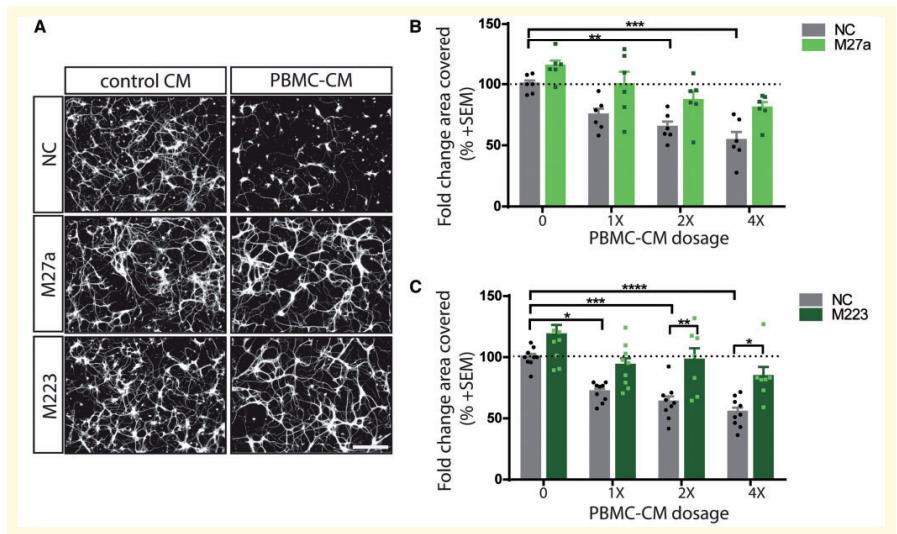
图2 MiR-27a-3p和miR-223-3p过表达可预防pbc - cm依赖性神经退行性变
适当抑制miR-23a-3p/miR-27a-3p (I23a/27a)会显著地抑制神经元突起生长,而不影响细胞死亡,这一观点与miRNA簇可能保护神经元免于退化一致(图3A-C)。此外,miR223的缺失也导致离解皮层神经元的神经突生长显著减少,而不影响细胞死亡(图3D-F)。为了确定miR-23a / 27a和miR-223功能丧失的神经元对PBMC-CM的敏感性,用PBMC-CM处理了I23a / 27a转染的神经元和miR223 /神经元。以其自身的基础生长做对照,I23a / 27a转染的神经元对PBMC-CM的敏感性不比阴性对照模拟转染的神经元更强(图3G)。类似地,来自miR-223 /小鼠的神经元对PBMC-CM的敏感性未改变(图3H)。这些结果表明,miR-27a-3p或miR-223-3p的过表达可以防止神经元过程丧失,但是单个miRNA的功能丧失不足以进一步使神经元对PBMC依赖性神经突损失敏感。
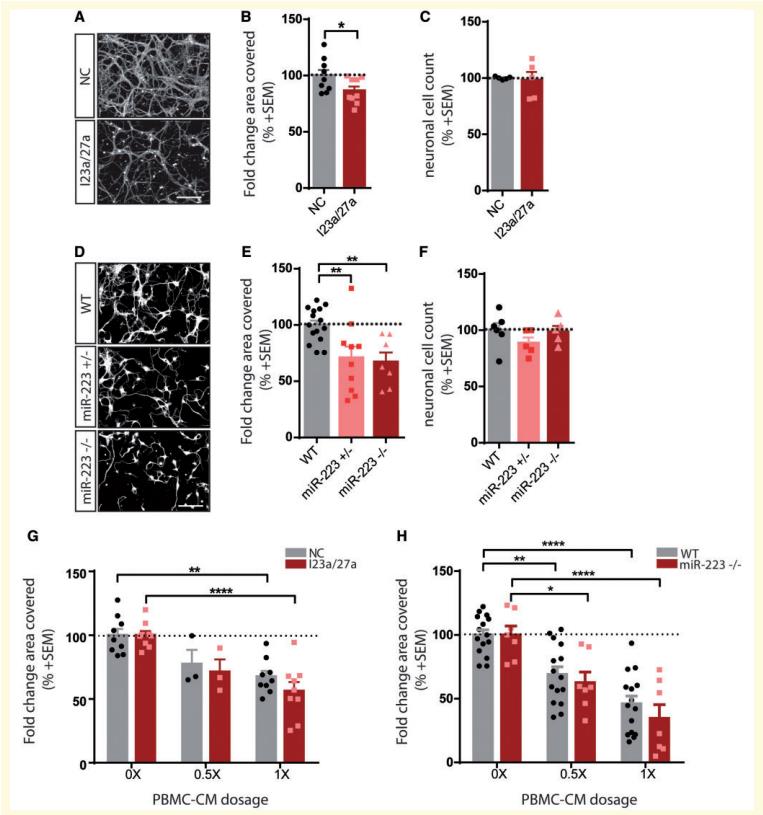
图3 MiR-27a-3p和miR-223功能丧失降低了基底神经元的生长,但对PBMC-CM没有进一步的响应
3 MiR-223过表达挽救了EAE视神经轴突变性
在整个EAE过程中,视神经可见轴突膨大、卵圆孔和碎裂(图4A-J)。在RGC显著死亡前发病时轴突膨大,在发病高峰期达到最大密度,在慢性期基本消退(图4A-J和M)。RGC密度在疾病高峰期显著下降,在慢性期继续下降(图4N)。通过qPCR验证miR-223-3p在RGCs和视神经中的过表达(图4O)。在包含未注射的眼球凸出轴突的对侧视神经中,EAE诱导可导致可见的局灶性变性,其特征为轴突肿胀、卵圆孔和疾病高峰时的碎裂(图4K)。在包含从对照AAV2-NT注射的视网膜突出的轴突的同侧视神经中,类似程度的轴突变性是明显的(图4K和P),相反的,与未注射的对侧眼相比,注射aav2 - mir -223的眼投射出的视神经轴突肿胀明显减少(图4 L和P)。

图4在EAE模型中,神经元过表达miR-223可以挽救轴突变性
4、MiR-27a-3p和miR-223-3p通过谷氨酸受体信号介导神经保护
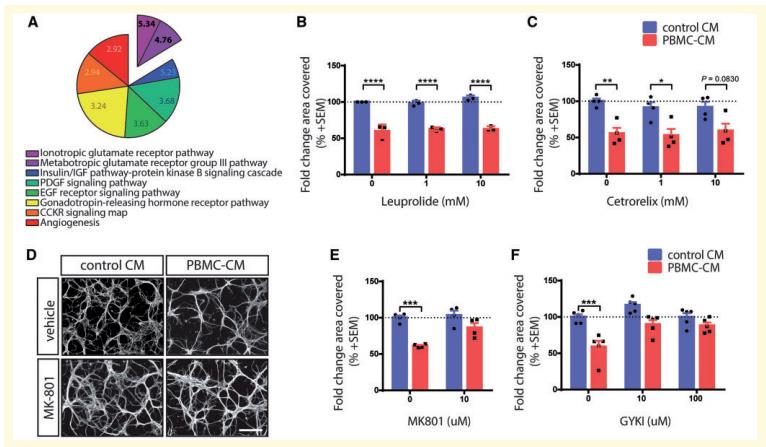
图5 GluR信号的抑制在体外可以防止神经退行性变性
PANTHER确定了8个明显过多的由miR-27a-3p和miR-223-3p的靶基因参与的途径(图5A)。与各自的对照组相比,两种药物对PBMC-CM诱导的神经元突丢失均无显著影响(图5B和C)。为了探究是否可以通过阻断NMDAR来减轻PBMCCM依赖性变性,使用MK-801治疗皮质神经元。结果发现,相对于载体对照,MK-801阻止PBMC-CM介导的过程变性(图5D和E)。GYKI对PBMC-CM的响应的神经保护作用可能通过AMPAR的抑制来介导(图5F)。
研究发现MK-801和GYKI都能够挽救LNA介导的miR-223-3p功能丧失,使生长恢复到对照神经元的生长水平(图6A-C)。类似地,应用MK-801或GYKI可以拯救miR-23a-3p / 27a-3p损失 - 去除功能(图6D-F)。为了直接测试谷氨酸信号传导在miR-223-3p-和miR-27a-3p-依赖性神经保护中的作用,培养神经元10DIV并用谷氨酸处理以诱导兴奋性毒性细胞死亡。如预期的,在阴性对照转染的神经元中用10或20mM谷氨酸处理导致神经元显著减少(图6G)。然而,用M27a转染可显著防止10mM谷氨酸处理的神经细胞损失,并且M223对神经元的保护浓度可高达20mM谷氨酸(图6H和1)。这进一步支持两种miRNA的神经保护作用都是通过抑制谷氨酸信号传导反应来介导的这一假设。

图6 MiR-27a-3p和miR-223-3p功能缺失生长缺陷可以通过抑制GluR恢复
为了进一步支持该假设,作者研究了miR-223-3p和miR-27a-3p靶向GluA2和NR2B30UTR的3’UTR。研究发现miR-223-3p的表达抑制了GluA2和NR2B的荧光素酶活性(图7A和B)。此外,miR-27a3p模拟物还抑制由GluA2和NR2B30UTR调节的荧光素酶活性(图7A和B)。还发现用AAV-223转导的RGC在体内表现出NR2B的下调表达(图7C)。与AAV-223注射的视网膜中的非转导组相比,转导的RGC的视觉检查显示NR2B染色的强度降低,而在AAV-NT条件下,转导的和未转导的RGC均显示相似的强度染色(图7C)。总之,研究结果支持上述模型,其中miR-223-3p和miR-27a-3p下调GluA2和NR2B的表达,从而有助于其神经保护作用。
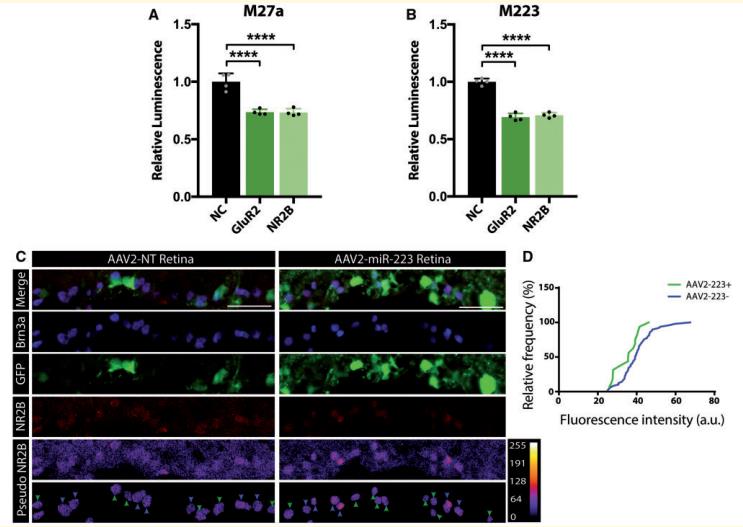
图7 MiR-27a-3p和miR-223-3p靶向谷氨酸受体亚基






