自然杀伤细胞对肺腺癌适应性免疫应答的作用
近日,麻省理工学院在PNAS上发表了一篇题名为:通过自然杀伤细胞刺激增强肺腺癌的适应性免疫应答的文章。该研究设计了一种用于在肿瘤中诱导表达活化配体的系统。刺激后,自然杀伤(NK)细胞定位于肿瘤内部,细胞因子产生能力增强。T细胞也以NK细胞依赖性方式聚集到肿瘤中,并表现出更高的功能性。在表达新抗原的肿瘤中,NK细胞刺激增强了肿瘤特异性T细胞的数量和功能,并且在长期环境中减少了肿瘤生长。NK细胞也可以被激活以促进抗肿瘤免疫,从而支持它们作为癌症免疫疗法中的重要靶标的潜力。

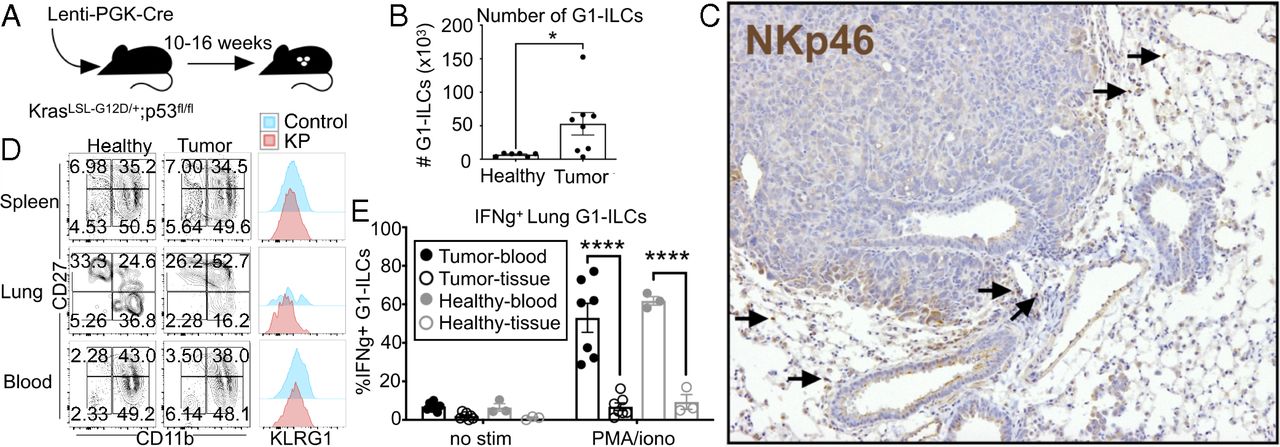
1.NK细胞在LUAD小鼠模型中表现为不成熟表型和低功能性
为了研究NK细胞和肺肿瘤之间的相互作用,使用了由Cre重组酶诱导的致癌Kras G12D激活和肿瘤抑制因子p53 缺失驱动的LUAD 小鼠模型。用Lenti-Cre气管内感染KP小鼠,引发肿瘤形成。通过流式细胞术,观察到与健康肺相比,在携带肿瘤的肺中具有NK细胞特征性标志物(NK1.1 +; CD8-; CD4-或NK1.1 +; CD3-)的细胞数量增加,而健康肺组织隔室中很少有NK样细胞。这些标记物不能区分cNK细胞和ILC1亚型;进一步的免疫表型分析显示,根据DX5(CD49b)染色,该群体可细分为2组,并且这些DX5 +和DX5-亚群可在健康和携带肿瘤的肺组织中发现。还观察到Ly49H NK细胞激活受体的表达局限于G1-ILC中的DX5 +组,表明这是在肺中cNK细胞上特异性表达的标志物。使用抗Nkp46抗体对肿瘤切片进行IHC染色显示G1-ILC位于肿瘤周围的基质中,而不是肿瘤内。流式细胞仪分析显示,与血液和脾脏来源的细胞相比,肺组织中具有更多未成熟cNK细胞的表面标志物表型(CD11blow; CD27high; KLRG1low)特征。与血液来源的细胞相比,组织G1-ILC显示出低的细胞因子产生能力。由于从携带肿瘤的肺中分离出有限的细胞,无法进行细胞毒性测定。然而,观察到组织来源的G1-ILC上的CD107a表达水平高于血液来源的细胞。尽管仍有待确定该表型是否与该群体中的细胞毒性功能相关。有趣的是,在健康和携带肿瘤的肺部分离的细胞之间看到了相似的表面表型和功能能力,这表明这些是肺组织隔室中NK样细胞与血液相比具有一般特征。总之,这些数据表明,尽管它们富集KP肺肿瘤,G1-ILC表现出低功能性,类似于人LUAD中的NK细胞,提出了NK细胞功能是否可以在确定疾病的情况下用于治疗干预。
2.NK细胞应答可以在既定肿瘤中增强。
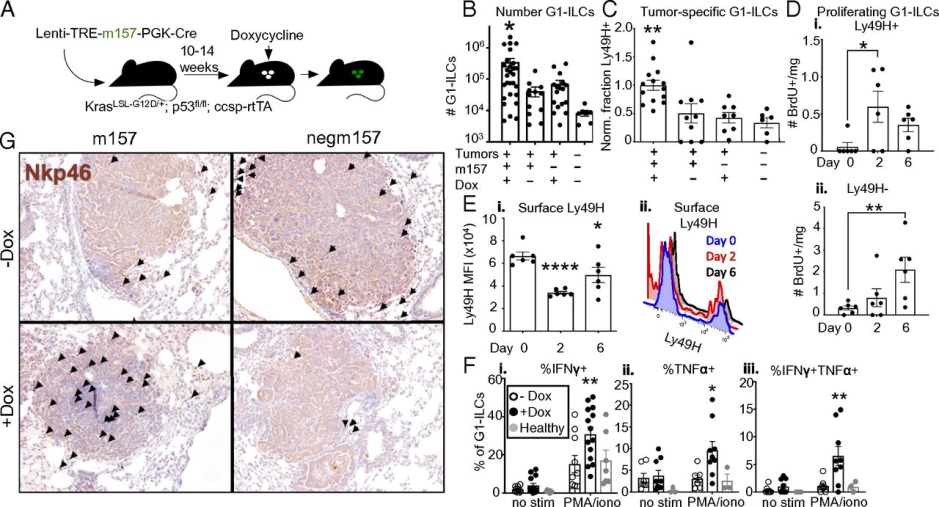
在肺上皮特异性细胞分泌蛋白(Ccsp)启动子(KP rtTA)的控制下,进入KP模型,进入反向四环素反式激活因子(rtTA)转基因,从而可以在肺肿瘤中特异性诱导NK细胞配体的表达。为了研究是否可以在确定的KP肺癌中刺激NK细胞反应,使用Lenti-TREm157(或Lenti-TREnegm157)启动肿瘤,允许它们生长10至14周,然后将小鼠置于含有Dox的饮食中诱导M157表达。配体诱导一周后,与对照组相比,观察到肿瘤携带肺组织中总G1-ILC数量增加和m157特异性(Ly49H +)NK细胞富集。Ly49H + NK细胞在配体后第2天表现出增增加。有趣的是,在相同的动物中观察到Ly49H-G1-ILC的后来(第6天)Ly49H非依赖性增殖期,可能是由于Ly49H + NK细胞刺激产生的促炎信号。观察到m157诱导后Ly49H + NK细胞上Ly49H的表面水平降低,这是通过该途径发出信号的特征。在离体刺激测定中,与对照相组比,G1-ILC在肿瘤中m157诱导后表现出更高的细胞因子产生能力。m157诱导也导致NKp46 +细胞的瘤内定位增加,相比之下,这些细胞在对照肿瘤中更严格的基质存在。这些发现表明NK细胞的细胞因子产生能力可以通过cNK细胞特异性识别的活化进行增强。
3.刺激的NK细胞将适应性免疫细胞募集到肿瘤中。
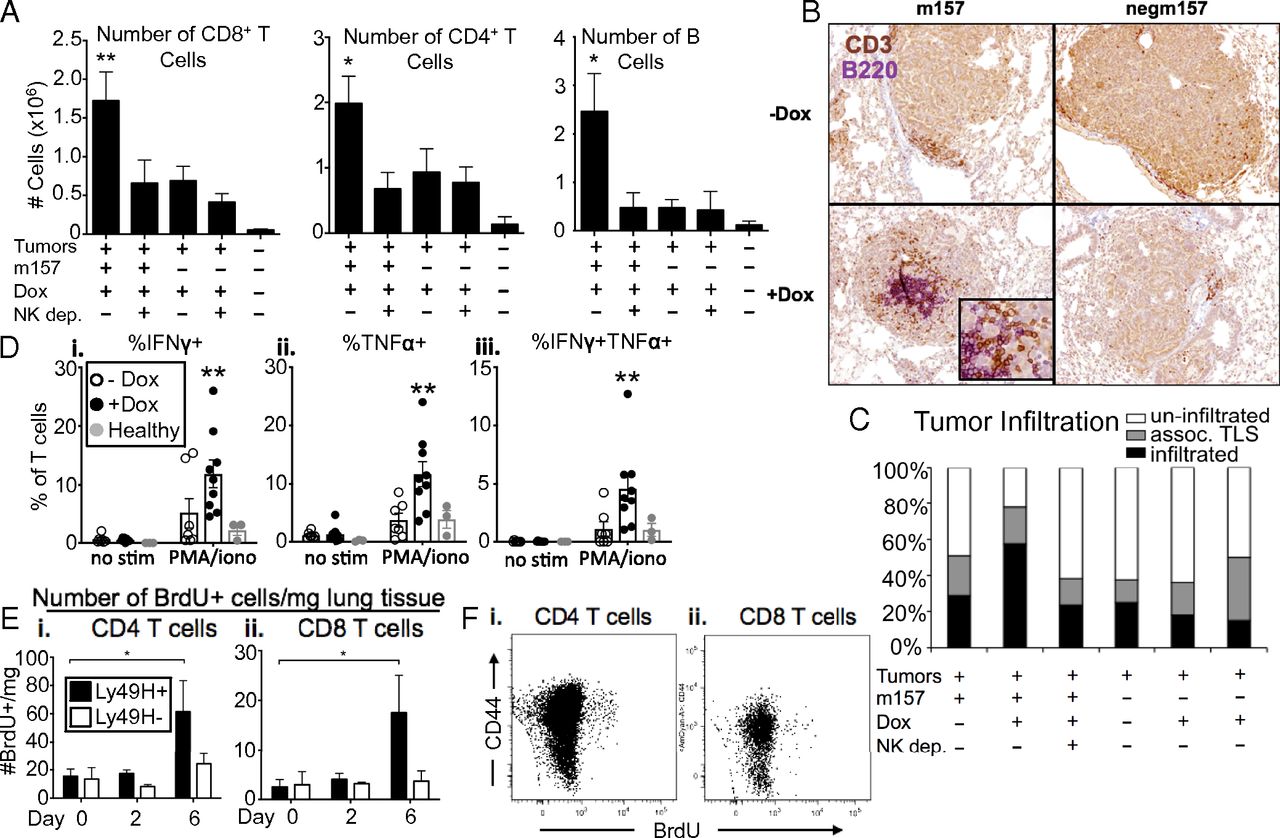
接下来,想探讨NK细胞刺激对该模型中适应性免疫的影响。使用流式细胞术,组织学和IHC组合分析,观察到T细胞和B细胞强烈募集到诱导表达m157的肿瘤。携带肿瘤的肺组织中T和B淋巴细胞数量的增加依赖于NK1.1 +细胞,这种效应因其消耗而被消除,表明T细胞和B细胞的募集不仅仅是由于针对自身的适应性反应。此外, negm157突变体的表达,与m157仅相差3个氨基酸,不会导致T或B细胞的募集。与对照相比,来自表达m157的肿瘤的肺组织T细胞响应于离体刺激表现出更高的细胞因子产生能力。虽然CD44 +和CD44-T细胞都被募集到肿瘤中,但m157诱导促进了抗原,CD44 + CD4 +和CD8 + T细胞的增殖。这些结果表明在已建立的肺肿瘤中刺激NK细胞应答导致适应性免疫细胞的募集和增强的T细胞功能。
4.CCL5(RANTES)在淋巴细胞向肿瘤的募集中发挥作用
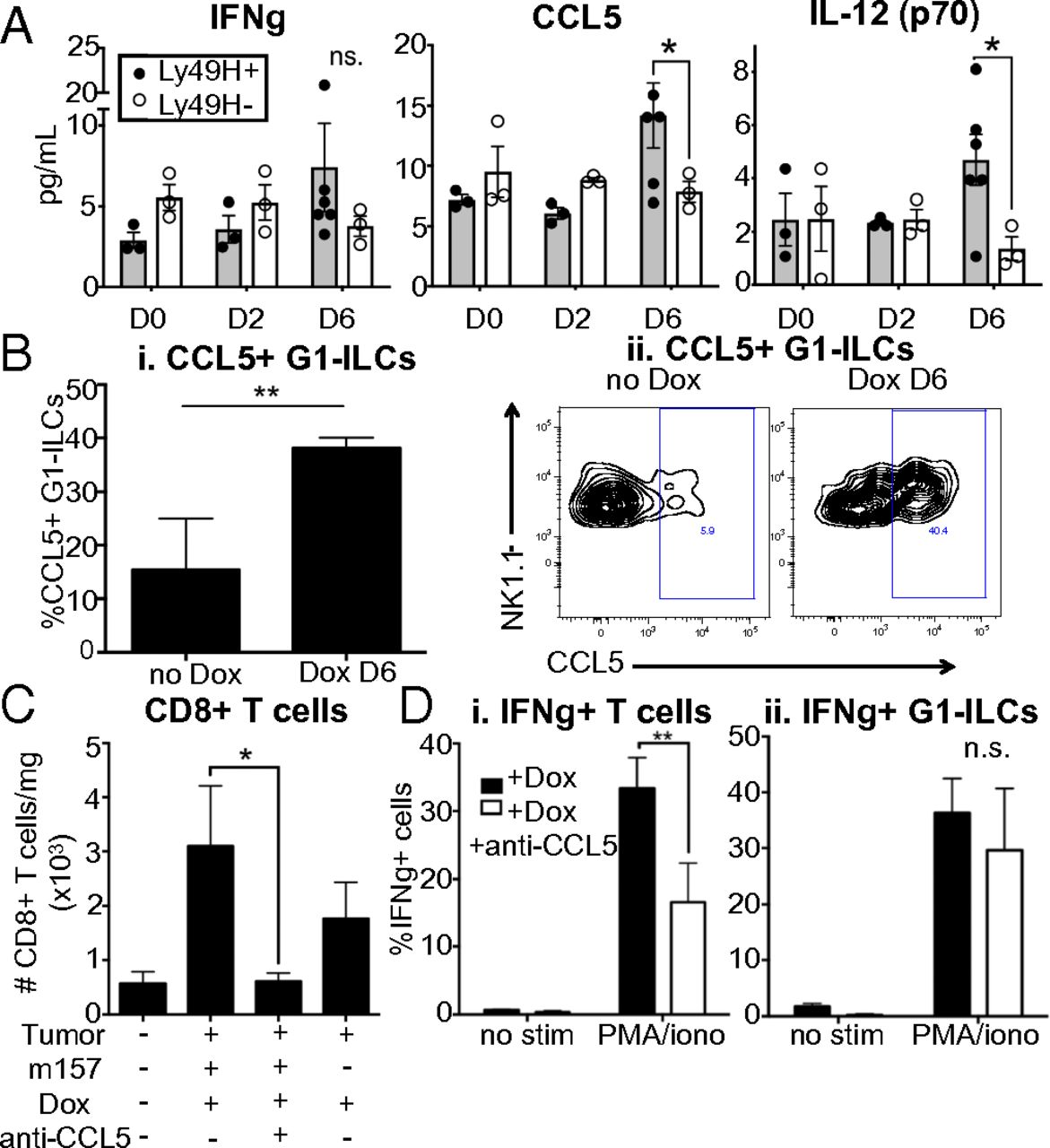
为了研究在系统中向T细胞募集T细胞所涉及的因素,从来自KP rtTA或KP rtTA; Ly49H缺陷的肿瘤肺中制备裂解物。小鼠在配体后第0,2和6天诱导并使用细胞因子和趋化因子阵列分析它们。尽管不能排除IFN-γ在m157诱导的反应中的作用,但阵列分析并未发现该细胞因子的显着富集。确实发现趋化因子CCL5和细胞因子IL-12显着增加。通过流式细胞术分析观察到m157诱导后CCL5 + G1-ILC的比例增加,表明NK细胞可能是这种情况下CCL5的来源。为了直接测试CCL5的作用,使用中和抗体在m157诱导前阻断其功能。 CCL5阻断消除了CD8 + T细胞向肿瘤的募集。还观察到肿瘤中G1-ILC和CD4 + T细胞数量减少的趋势,尽管这没有达到统计学显着性。来自配体表达肿瘤的T细胞在离体刺激测定中显示出CCL5阻断的细胞因子产生能力降低,但重要的是,没有区分CCL5是否直接影响T细胞应答或仅仅是招募功能不同的T细胞亚群,或两者兼而有之。G1-ILC的细胞因子产生没有显着影响,表明它们的功能不依赖于CCL5。这些结果表明CCL5在NK细胞依赖性募集CD8 + T细胞至肿瘤中起作用。
5.刺激的NK细胞反应是短暂的,可以通过IL-15加强
为了研究NK细胞刺激对抗肿瘤反应的长期影响,检查了淋巴细胞数量和功能。3周后,G1-ILC的数量和细胞因子产生能力不再比对照增加。这些结果表明,尽管NK细胞仍然对已建立的肿瘤中的刺激具有反应性,但它们的反应是短暂的,可能是由于TME中存在免疫抑制因子或仅仅是诱导NK细胞低反应性的内在负反馈机制。在配体诱导3周后,T细胞数和细胞因子产生能力也不再高于对照组。
在治疗环境中,NK细胞反应的短暂性质可能对组合治疗的合理时机具有重要意义。例如,可能存在有限的时间窗口,在此期间NK细胞靶向治疗可以增强由T细胞靶向疗法实现的抗肿瘤免疫。值得注意的是,观察到气管内给予IL-15(一种已知可刺激NK细胞活化的细胞因子)均可增强G1-ILC反应,类似于对照肿瘤中的配体诱导,并在长期配体表达后挽救了G1-ILC反应下降,细胞数,术语Ly49H + G1-ILC和CCL5染色,以及细胞因子产生,表明用于启动或延长NK细胞应答窗口的治疗途径。重要的是,虽然IL-15给药在持续m157刺激后增加了Ly49H +细胞的比例,但它可能作用于所有G1-ILC群体,以及T细胞和其他亚群,与先前的刺激无关。因此,无法区分IL-15是否起作用以拯救先前刺激的NK细胞,或者可能将循环NK细胞募集到携带肿瘤的肺组织中,或两者兼而有之。
值得注意的是,实验室以前的研究表明,KP模型中的肿瘤很少获得非同义编码突变,这表明KP肿瘤基本上没有新抗原。因此,在缺乏强抗原的情况下,适应性免疫应答可能无法获得牵引力,导致其在NK细胞功能丧失后下降。重要的是,没有描述在这种“非免疫原性”系统中招募肿瘤的T细胞的特异性,无法确定它们是否识别肿瘤抗原,或者是否他们的招募是抗原非依赖性的。
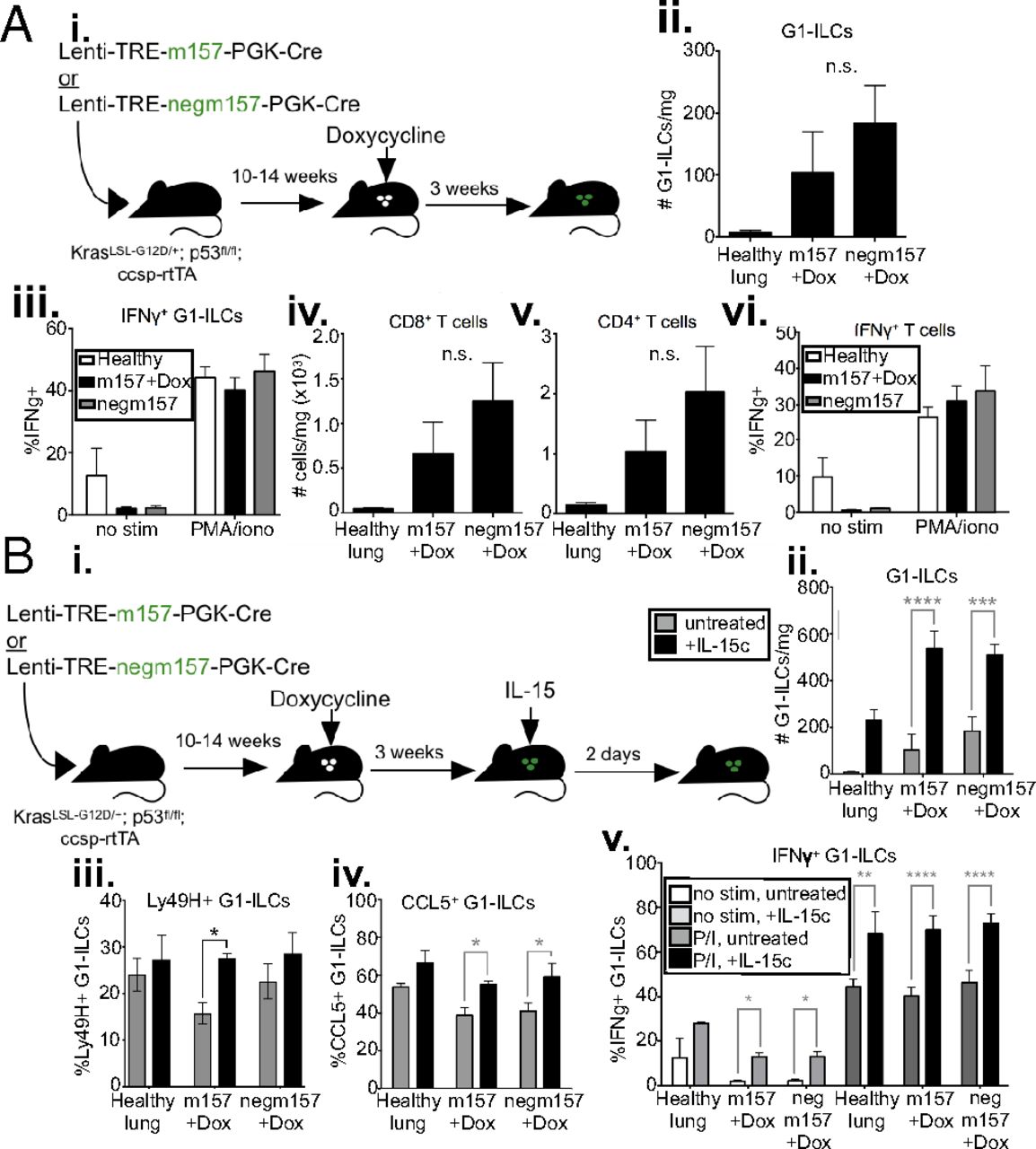
6.NK细胞刺激导致增强的肿瘤特异性T细胞应答
利用LucOS / TREm157系统产生免疫原性肿瘤,然后在携带肿瘤的小鼠中14至16周后施用Dox以刺激NK细胞,并且在1周后收获组织用于分析。实验室LucOS系统的先前工作表明,在肿瘤开始后14至16周,抗原特异性T细胞的数量和功能已经下降,并获得了疲惫的表型。正如之前在非免疫原性KP肺肿瘤中所见,m157配体诱导也导致在该环境中肿瘤组织中整体CD8 + T细胞数量增加。使用SIIN-四聚体,观察到表达配体的肿瘤也富含抗原特异性T细胞。最后,测试了NK细胞刺激是否可以增强过继转移的抗原特异性T细胞的反应。从OTI TCR-转基因小鼠的脾中分离出一千万个先天性标记的(Thy1.1 +)幼稚SIIN特异性T细胞,并在Dox施用后1天将眼窝后转移到具有LucOS / TREm157肿瘤的动物中。十天后,观察到转移的OTI T细胞在NK细胞刺激后构成比对照动物更大的CD8 + T细胞群。此外,观察到离体刺激测定中转移的来自NK细胞配体诱导的肿瘤的OTI细胞产生的细胞因子增加。这些发现表明,免疫原性肿瘤中的NK细胞刺激可以通过募集(在内源性T细胞的情况下)或通过募集和增强功能(在过继性T细胞治疗的情况下)改善肿瘤特异性T细胞应答,因此增强抗肿瘤免疫力。因此,用于刺激TME中的NK细胞的治疗方法可以与基于T细胞的癌症治疗互补。
7.NK细胞可以增强免疫原性肿瘤的控制
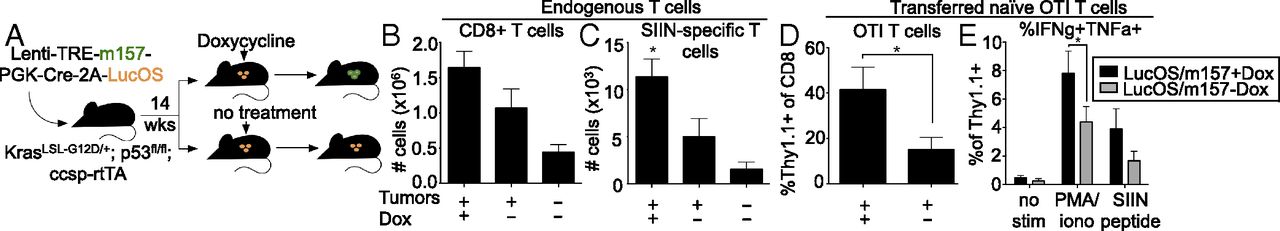
为了评估NK细胞是否可以在长期环境中存在刺激信号的情况下影响肺癌进展,开始使用Dox饮食小鼠,然后在1天后使用Lenti-TREm157或Lenti-TREnegm157启动肿瘤,并继续使用Dox在肿瘤发展过程中进行治疗直至小鼠濒临死亡。观察到在携带肿瘤的小鼠中总体存活率仅有适度增加,所述肿瘤在肿瘤发展早期表达激活的NK细胞配体,表明单独的NK细胞不能提供针对疾病进展的实质性保护,即使肿瘤被迫表达刺激信号。
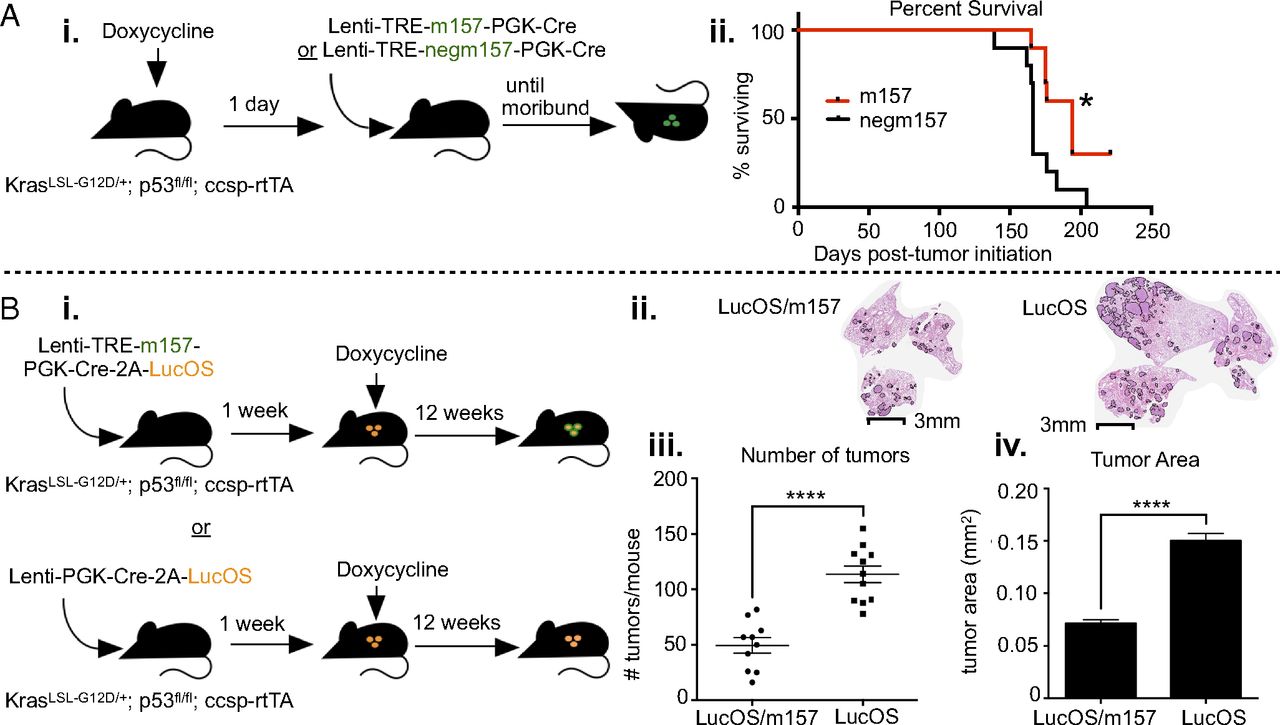
为了评估NK细胞刺激对该模型中免疫原性肿瘤进展的影响,开始表达具有或不具有诱导型m157的LucOS的肿瘤,并且在1周后施用Dox。将小鼠保持在Dox上12周,之后收集组织用于分析。引人注目的是,与携带OVA肿瘤的肺相比,观察到LucOS / TREm157荷瘤肺中的肿瘤负荷显着降低。LucOS / TREm157肿瘤的数量较少且尺寸小于LucOS肿瘤,表明免疫原性肿瘤中的NK细胞刺激导致消除病变并抑制确实出现的肿瘤生长。总之,这些实验表明,无论NK细胞是否在该模型中自然地形成肿瘤进展,它们都能够在刺激信号的存在下增强适应性抗肿瘤免疫力。
结论:
作者认为,导致肿瘤中NK细胞功能增强的策略可能是T细胞募集的强大机制,除了NK细胞直接杀伤的潜在有益作用外,还可以提高T细胞治疗癌症的疗效。






