Tip 60是如何来操控BMAL 1乙酰化的呢?
乙酰化就是将有机化合物分子中的氮、氧、碳原子上引入乙酰基CH3CO-的反应,最常见的是组蛋白乙酰化。常用氯乙酰和Acetic Anhydride等作为乙酰化剂。
该研究于今年8月份,德国马克斯·普朗克生物物理化学研究所在《Elife》杂志上发表,题为“Acetylation of BMAL1 by TIP 60 controls BRD4-P-TEFb recruitment to circadian promoters”。揭示了Tip 60对BMAL 1乙酰化的控制机制,并为Tip 60作为乙酰化反应的应用提供了理论基础。
摘要:
许多生理过程都表现出由相互连接的激活和抑制元素组成的细胞时钟驱动的昼夜节律。为了研究这种分子振荡器的调节时间,我们结合了小鼠遗传方法和关键昼夜节律蛋白相互作用和时钟基因启动子的相互作用分析。我们发现转录激活因子BRD4-PTEFb富集到含有E-box的昼夜节律启动子。 在昼夜周期的激活阶段期间,赖氨酸乙酰转移酶TIP 60使转录激活因子BMAL1乙酰化,导致BRD4和P-TEFb暂停释放因子的富集,随后是昼夜节律的生产转录延伸。 我们提出BRD4-P-TEFb富集的启动子是生物钟周期中新的时间检查点。
结果:
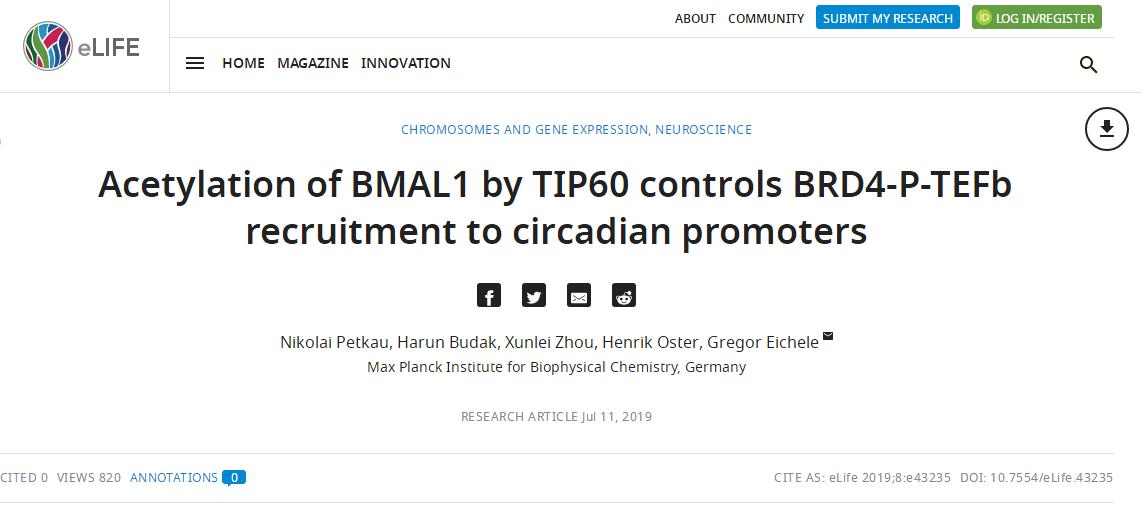
一、抑制CDK 9和BRD4消除了昼夜或者生理节律的振荡
稳定表达时钟驱动的荧光素酶报告基因Bmal1-LUC的同步成纤维细胞在26小时内持续表达。存在P-TEFb的CDK9亚基有效抑制剂flavopiridol(FP)的情况下,荧光素酶活性节律在高剂量时,节律完全丧失(图1A)。生物钟基因调控不仅发生在转录起始,还发生在Pol II暂停释放和生产延伸的水平。用JQ1(选择性BRD4抑制剂)处理Bmal1-LUC报告基因成纤维细胞以剂量依赖性方式抑制荧光素酶活性节律,引起周期延长(图1B),还导致这些细胞中内源性Dbp表达节律的强烈抑制(图1C)。在JQ1存在下,Dbp的转录起始位点(TSS)上BRD4和CDK9的富集显着减少(图1D)。在Dbp的3'末端,Pol II的Ser2磷酸化被强烈减少(图1E),表明Pol II暂停释放已被抑制。降低的Dbp表达可能是由于BMAL1水平较低。我们的JQ1抑制剂研究表明BRD4-P-TEFb被富集到含有E-box的时钟控制基因Dbp中,随后允许Pol II暂停释放和转录延伸。因此,对于这种生物钟控制的基因,Pol II暂停释放可以作为其转录的重要调节步骤。
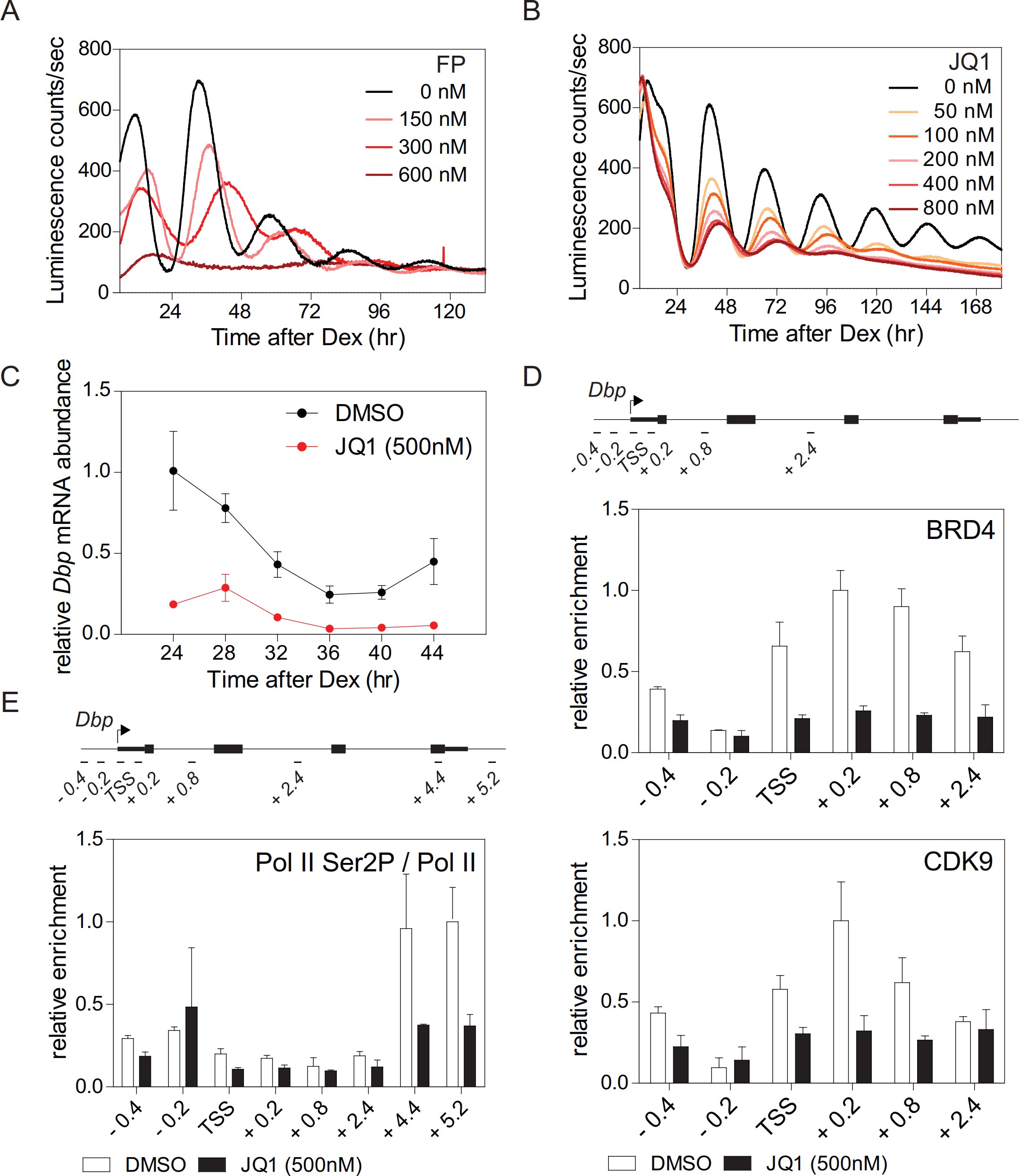
图1.BRD 4控制时钟基因的表达。
二、需要在赖氨酸538处乙酰化BMAL1以启动昼夜节律的生产转录延伸
BRD4在暂停基因的启动子上与转录因子/组蛋白的乙酰化赖氨酸结合。观察到JQ1对细胞昼夜节律的强烈影响,提出了在BRD4靶标中存在核心时钟组分的可能性,例如BMAL1,其在Lys538处被乙酰化可提供BRD4的结合位点。作者采用免疫沉淀实验研究了含有工程化BMAL1K538R的对照成纤维细胞和成纤维细胞中检查BRD4和CDK9与BMAL1的相互作用,结果表明在表达BMAL1K538R的细胞中,这种相互作用显着降低(图2A)。当野生型细胞经JQ1处理时,这种相互作用基本上受到抑制。 ChIP实验证明BMAL1K538R突变细胞显示BRD4和P-TEFb亚基CDK9向Dbp(图2B)的TSS的富集减少。 此外,Ser2-磷酸化的Pol II的富集显着降低(图2B)。由于对照成纤维细胞和BMAL1K538R突变细胞均稳定表达时钟驱动的荧光素酶报告基因,我们评估了K538R突变对发光节律的影响。在BMAL1K538R细胞中,几乎没有记录三个克隆中任何一个的节律性荧光素酶报告基因表达(图2C)。另外,在这些细胞中,内源性Dbp(图2D) mRNA的峰表达显着降低。BMAL1乙酰化可能另外促进转录起始,利于转录延伸而非起始是主要通过BMAL1的乙酰化调节的过程。因此,乙酰化的BMAL1将BRD4-P和TEFb富集到含有E-box的生物钟基因,然后导致Pol II从其暂停状态释放,从而允许生产性延长。
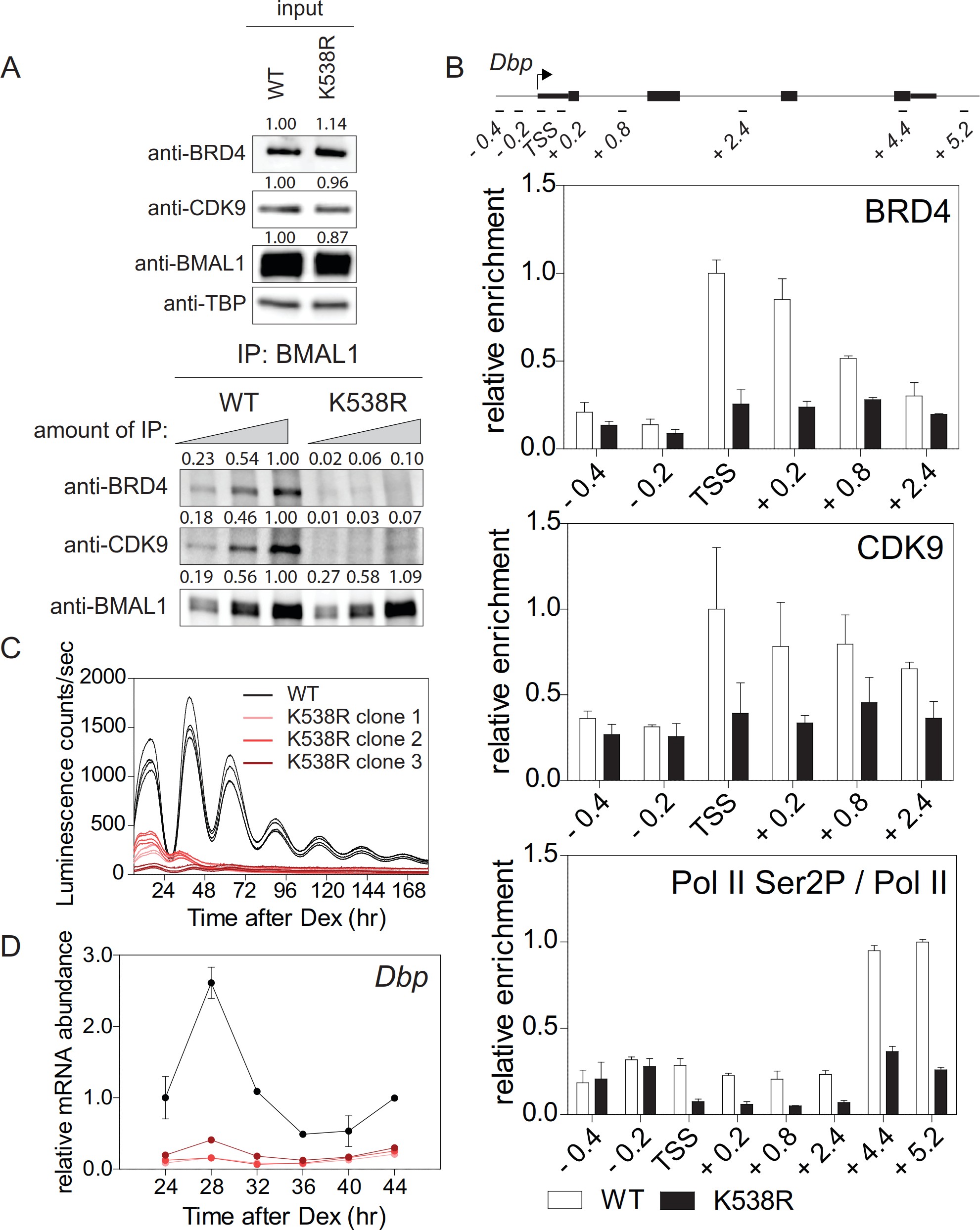
图2.BMAL 1的Lys 538乙酰化对转录延伸至关重要。
三、TIP 60对于小鼠生物钟的功能是必不可少的。
BMAL1乙酰化由CLOCK进行。研究发现在CLOCK缺陷的成纤维细胞中,BMAL1在Lys538处被乙酰化与野生型细胞中观察到的相似程度(图3A)。 CLOCKmutA不能使组蛋白H3和H4乙酰化,并且BMAL1的乙酰化活性大大降低。与对照相比,两种CLOCK变体呈现出BMAL1乙酰化的最小增加(图3B),存在CLOCK或CLOCKmutA时BMAL1乙酰化水平难以区分。总之,这些数据表明存在催化BMAL1乙酰化的替代乙酰转移酶TIP 60,其与CLOCK-BMAL1共同纯化并且乙酰化广泛的转录因子。添加TIP 60,但不是酶促失活的TIP 60C369A; E403Q,强烈增强了BMAL1乙酰化(图3B)。
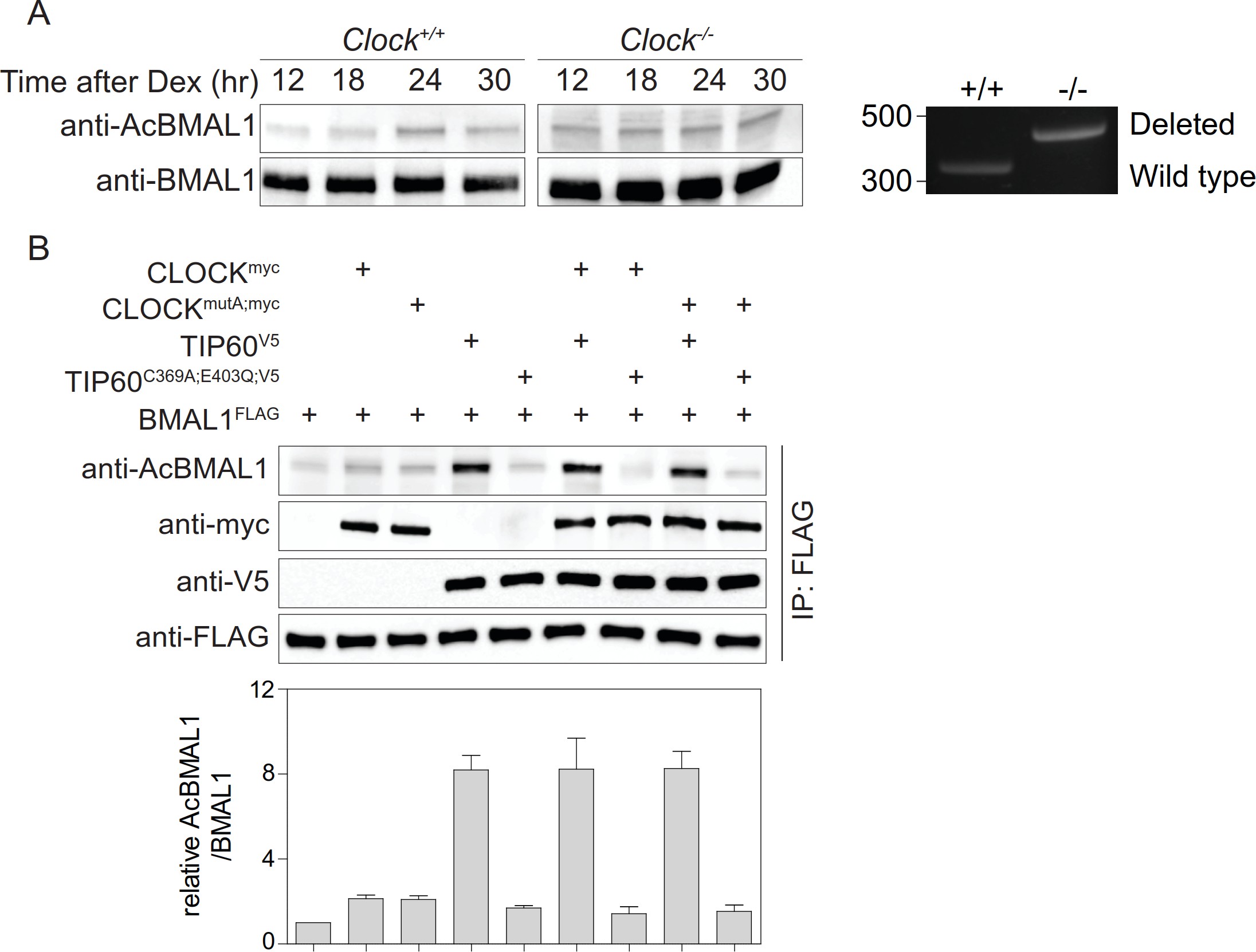
图3.BMAL 1在缺乏时钟的细胞中的乙酰化。
这种生物钟新潜在调节器促使我们产生条件性Tip 60小鼠,以评估该酶的体内功能并用于体外研究分子钟的成纤维细胞。Tip 60fl/- 携带Tip 60的一个条件和一个缺失等位基因的小鼠(图4)与Syt10-CRE驱动小鼠交配。该驱动因子在SCN的有丝分裂后神经元中具有强烈活性,可以规避与TIP 60缺陷相关的细胞致死率。所有后代携带两个拷贝的敲入Cre等位基因(Syt10Cre/Cre Tip 60fl /- )和一半携带一个拷贝的敲入Cre等位基因(Syt10Cre/+ Tip 60 fl/- )的小鼠在释放后立即变得心律失常。恒定暗度(DD)(图4A和B),Syt10Cre /+ Tip 60 fl/-小鼠的其余部分显示更长(29%)或正常(21%)自由运行期。SCN中TIP 60的免疫组织化学染色显示核信号,其在心律失常的Syt10Cre / + Tip 60 fl/- 小鼠中不存在(图4C)。昼夜节律SCN中Per1,Dbp和Bmal1的表达模式受到严重抑制(图4D),与这些动物中观察到的行为心律失常一致。细胞融合足以诱导细胞周期静止,从而绕过TIP 60在细胞周期调节中的作用。除管家基因之外,缺失导致荧光素酶报告基因的节律表达的显着抑制和内源性时钟基因的显着降低的表达(图4E和4F)。因此,删除TIP 60功能对SCN体内和有丝分裂后MEF中的运动活性和时钟基因的节律性表达具有重要影响。
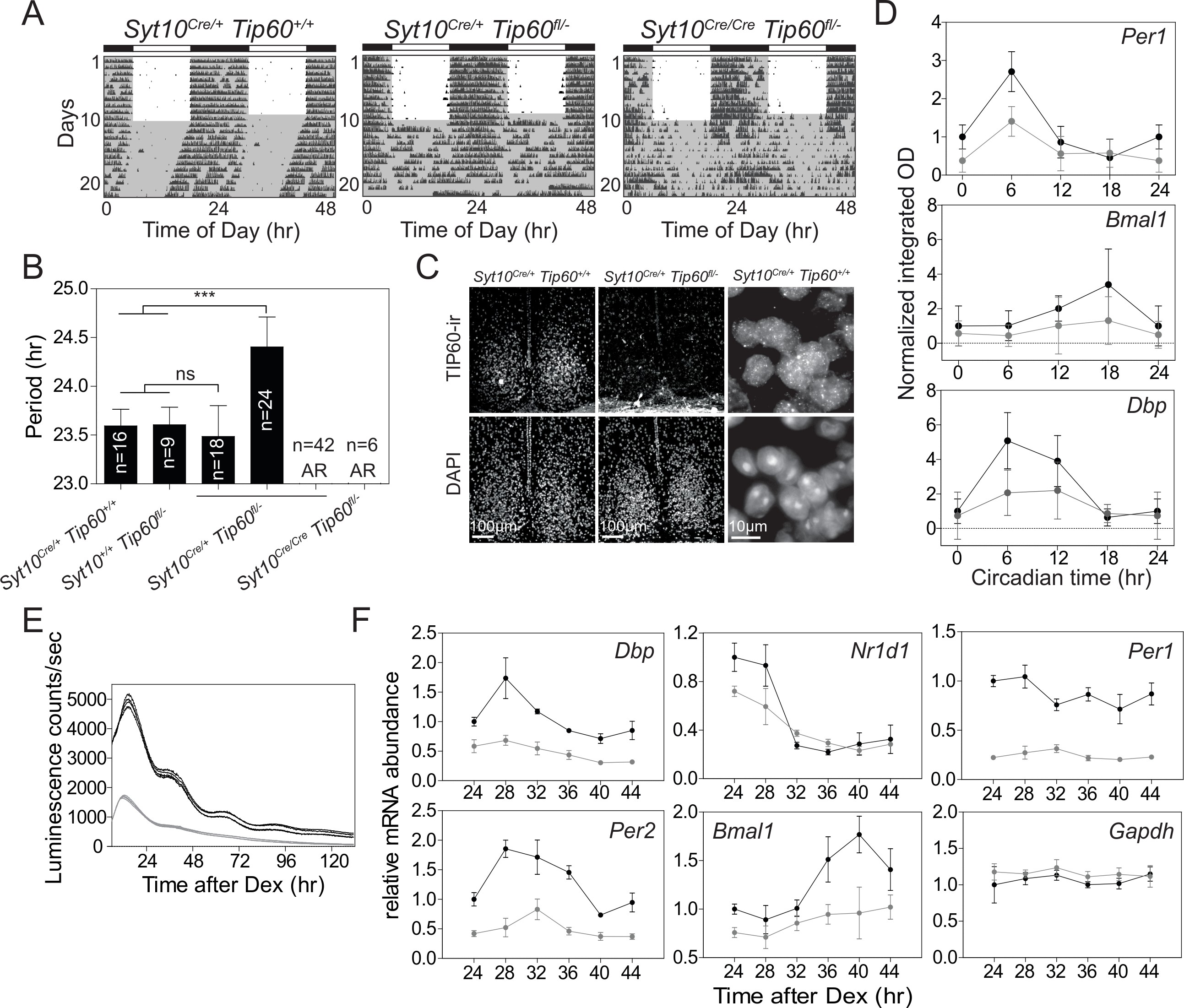
图4.Tip 60-缺乏引起小鼠昼夜节律表型,并干扰SCN和MEFs中节律时钟基因的表达。
四 、Tip 60乙酰化BMAL 1在赖氨酸538
小鼠严重的昼夜节律表型、Tip 60缺陷SCN和MEFs中时钟基因表达的强烈变化以及共转染实验(图3B)均表明BMAL1可能是Tip 60的直接基板。共转染实验显示bmal 1的Lys 538以剂量依赖性的方式被Tip 60乙酰化,而缺乏乙酰转移酶的Tip 60c369a;e403q导致类似模拟转染细胞的BMAL 1基线乙酰化水平(图3B;图5A)。Lys 538似乎是Tip 60作为信号乙酰化的主要赖氨酸。 在BMAL1K538R和Tip 60共转染细胞中,抗PAC-ack抗体明显减少(图5A)。Tip 60与野生型和BMAL1K538R共沉淀,表明两者之间存在相互作用这两种蛋白质(图5A)。BMAL 1的乙酰化作用不影响这种相互作用。重组TIP 60GST乙酰化重组BMAL1GST在Lys 538(图5B),在Tip 60缺陷MEFs中,内源性BMAL 1的Lys 538乙酰化明显减少(图5C)。 当内源性Tip 60被Bmal1-Luc报告细胞中的TIP 60C369A;E403Q替代时,内源性DBP的荧光素酶节律和mRNA节律被阻断(图5D和E)。总之,这些 数据提供强有力的证据表明BMAL1是TIP 60的底物。
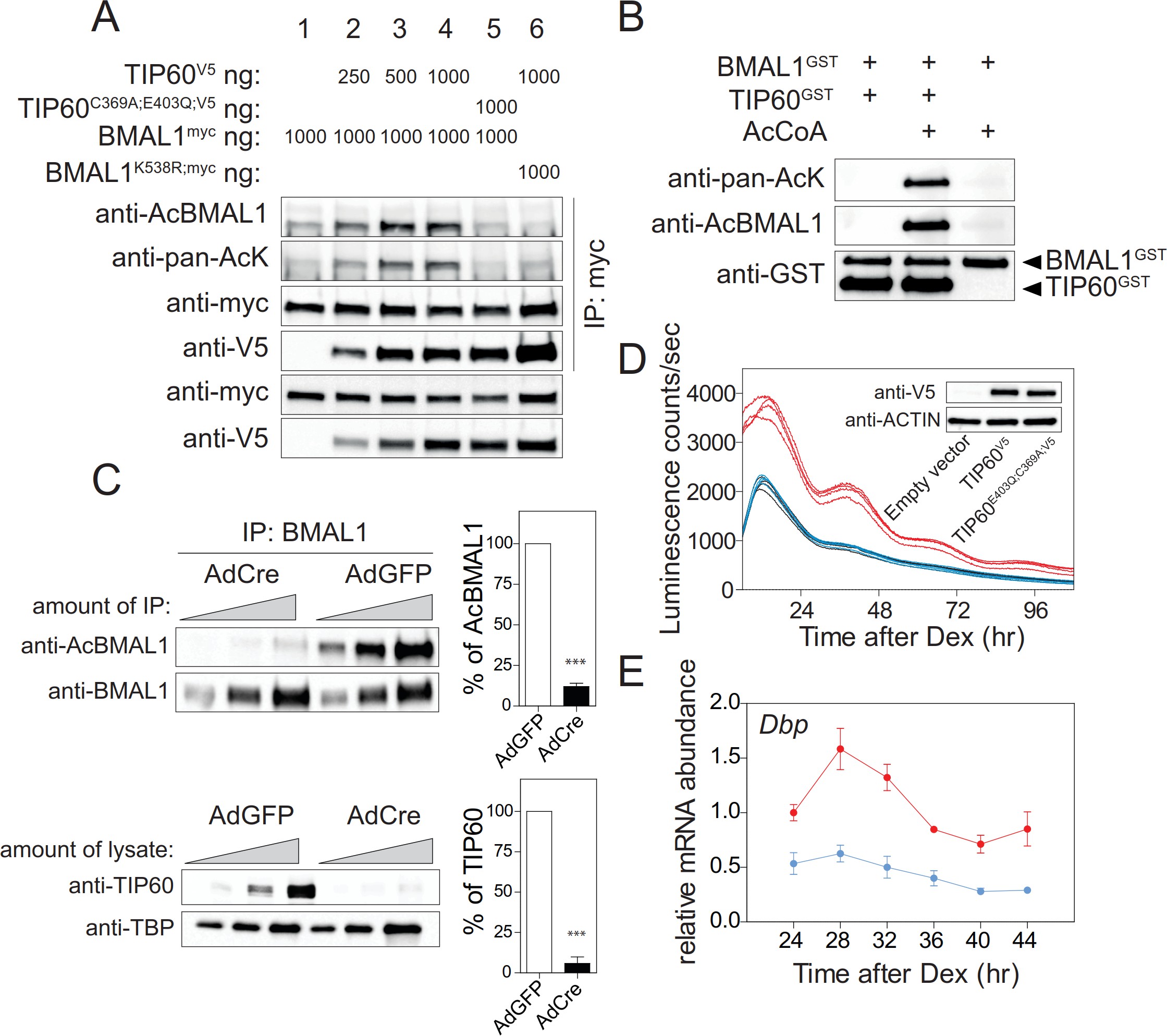
图5.Tip 60乙酰化BMAL 1。
五、Tip 60控制昼夜节律转录本的产生延长
使用BRD 4和P-TEFb(图2A和B)。此外,在BMAL1K538R细胞中,PolⅡSer2磷酸化(一种生产延长率的指标)明显降低(图2B)。因此,删除Tip 60应该废除BRD4-P-TEFb富集和POL II暂停发布。事实上,在融合的Tip 60缺陷的Dex同步纤维瘤中 TS,BMAL 1是低乙酰化的(图5C和6A),BMAL 1和BRD 4(图6A和B)以及BMAL 1和CDK 9(图6C)之间的相互作用严重丧失。芯片实验显示 在DBP、PER 1和Nr1d1基因的tss上,BRD 4和CDK 9的富集量明显减少,而Ser2磷酸化的POLⅡ占用率降低(图6D)。
以上数据表明,BMAL 1的乙酰化在转录延伸中起着关键作用。Tip 60乙酰化BMAL 1,Tip 60缺失不应该影响转录起始。删除TIP 60不影响TIFIEA富集到DBP、Per1和NR1D1基因的TSS。
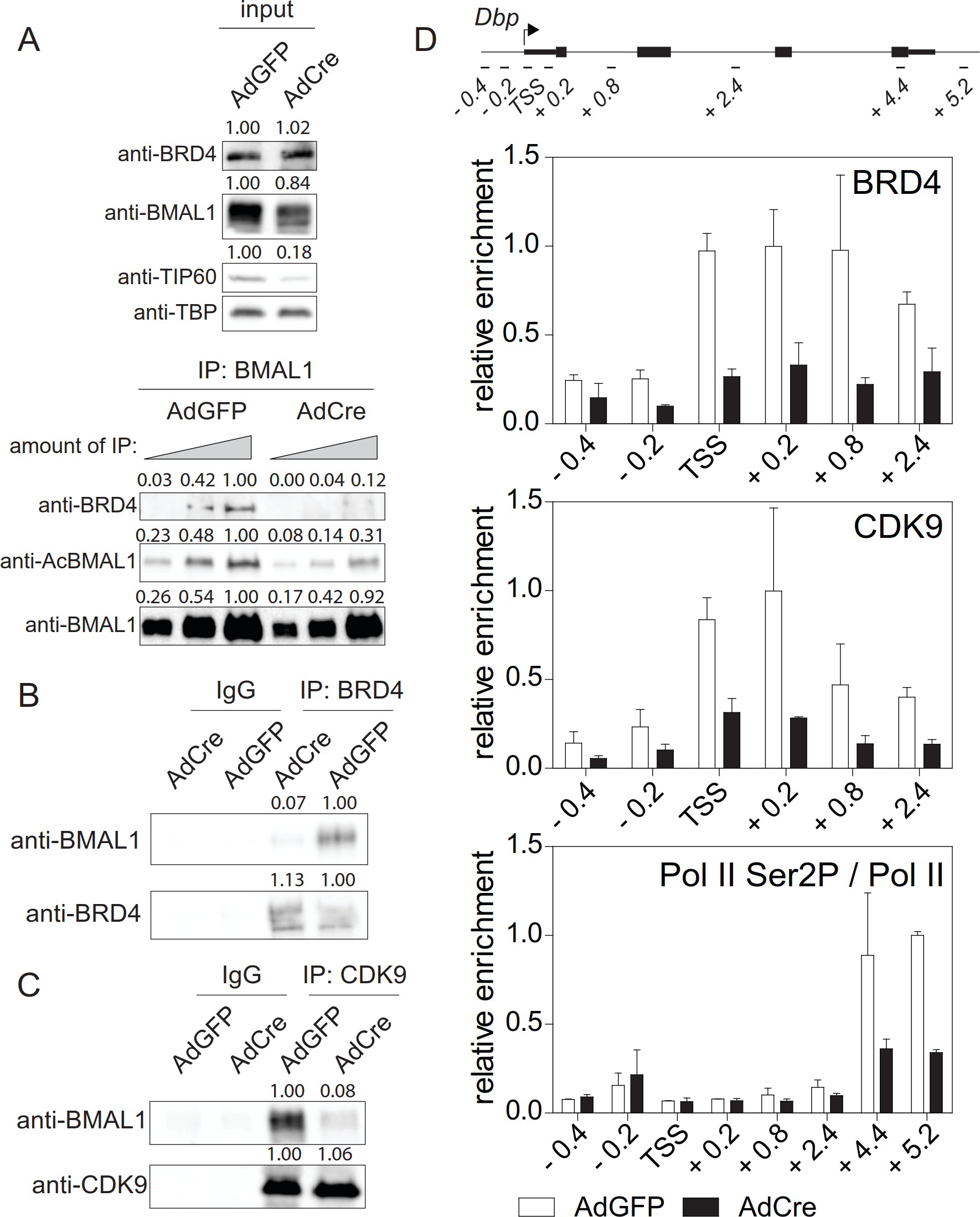
图6. TIP 60控制生产延长率。
六 、昼夜节律转录体产生延长的节律性
我们的实验证明TIP 60介导的BMAL1的乙酰化是生物钟振荡器的阳性肢体的必要元素。 TIP 60介导的BMAL1乙酰化导致BRD4和暂停释放因子P-TEFb富集至时钟基因TSS。反而允许CLOCK-BMAL1控制基因的生产性延长。在E-box控制的时钟基因的启动子的暂停释放因子的时间占有情况中也应该看到正昼夜调节的正调节和负调节之间的平衡。在细胞同步后大约24小时,我们观察到在Dbp,Per1和Nr1d1基因的启动子处BMAL1和乙酰化BMAL1的最强富集(图7A)。核提取物中乙酰化BMAL1的浓度在此时呈现最大值(图7B)。BRD4的占据在靶基因启动子处达到峰值(图7A),并且Pol II的Ser2磷酸化显示最大值(图7A)。因此,Dbp,Per1和Nr1d1 mRNA的丰度在24和28小时之间达到峰值(图7A)。总之,我们的数据显示依赖于TIP 60的BRD4富集,Pol II暂停释放和生产延长在昼夜周期中精确定时,并且以这种方式对生物钟振荡器施加时间控制。
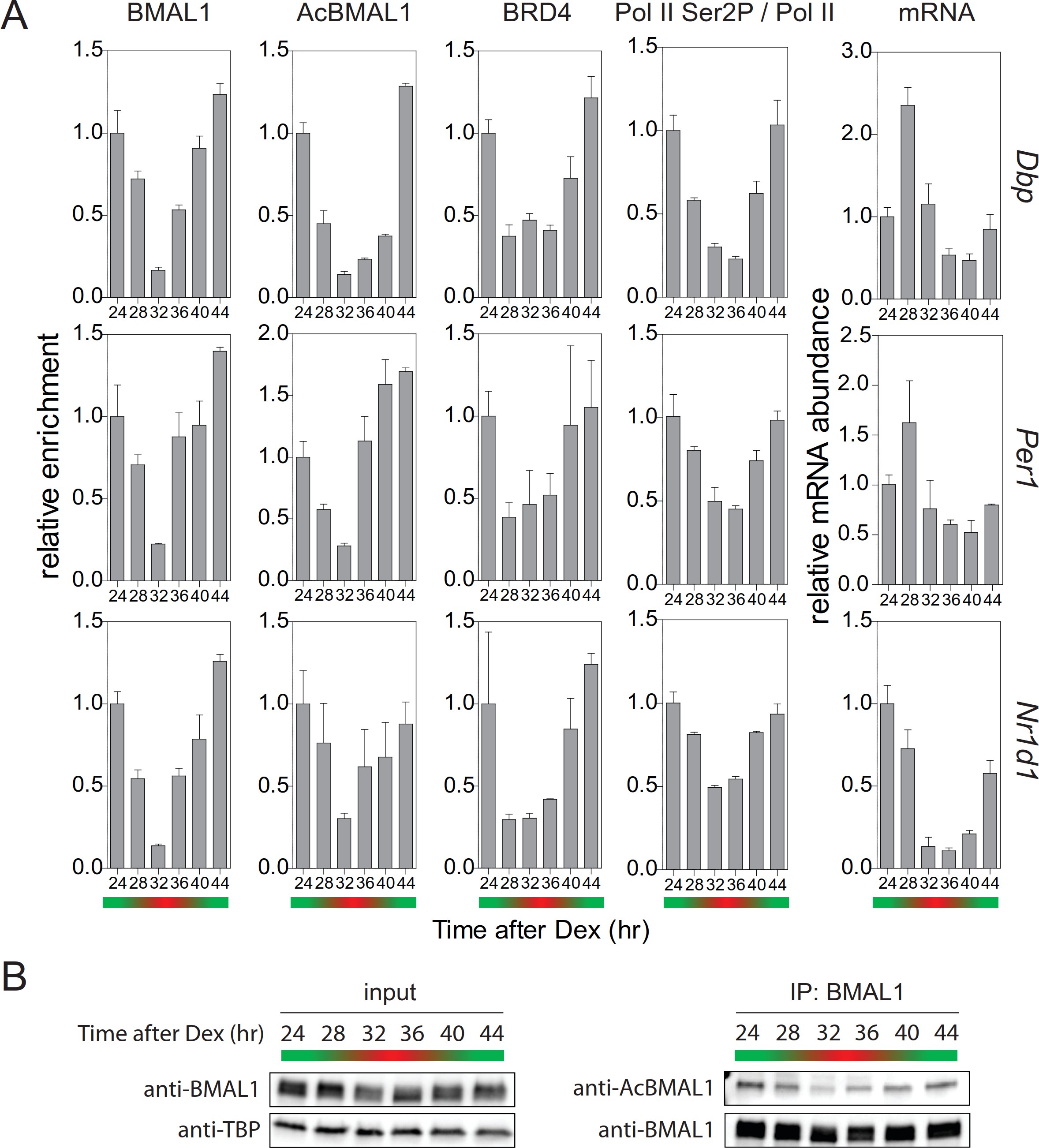
图7.生产延长的有节奏的轮廓。
结论:
暂停释放涉及到由Tip 60介导的BMAL 1的Lys 538的染色质乙酰化反应,Bmal1乙酰化允许向AcBMAL 1富集辅助激活剂BRD 4。BRD 4依次富集暂停释放因子P -TEFb,其激酶亚基CDK 9然后磷酸化POLⅡ的Ser2,导致POLⅡ从停顿状态释放,从而使含有E-box的昼夜节律基因得以产生延长。






