circRNA的过去,现在和未来
circRNA在真核生物中高丰富,其中许多是进化保守的。在后生动物中,circRNA以组织特异性方式表达,高度稳定,并且随着年龄在神经组织中累积。由于反向剪接与线性剪接的竞争,circRNA生物发生可以调节顺式线性RNA的衍生物。例如,最新报道证明了某些circRNA的功能:circRNA可以与microRNA相互作用,其中某些circRNA被翻译,可以调节免疫应答和行为。
6月份,InesLuciaPatop等人发表一篇“Past,present,andfutureofcircRNAs”的SCI文章,回顾了有关动物circRNA的当前知识,并对潜在circRNA功能,起源概念以及该领域未来可能研究方向进行了总结。
一、circRNA的形成-反剪接机制
1.外显子衍生的circRNA是通过反向剪接这类机制产生的,其中5’端剪接供体结合上游的3’端剪接位点。5’与3’端形成磷酸二酯键,进而产生了circRNA分子(图1)。
circRNA在大多数真核生物中由剪接体产生的,但在酵母,植物和变形虫之间产生的机制存在差异。在植物中,circRNA由侧翼为长内含子的区域产生,侧翼为长内含子的互补序列非常短或完全没有。在古细菌中,circRNA的环化过程不依赖剪接体,其中16%左右来自编码基因,少部分来自外显子。在后生动物中,circRNA的产生源于错综复杂的可变剪接。由于一些基因产生许多可变剪接亚型和circRNA,这表明反向剪接和选择性剪接可能在功能上相关。(全外显子型的circRNA;内含子和外显子组合的EICircRNA;内含子组成的套索型ciRNA;由病毒RNA基因组、tRNA、rRNA、snRNA等环化产生的circRNA)
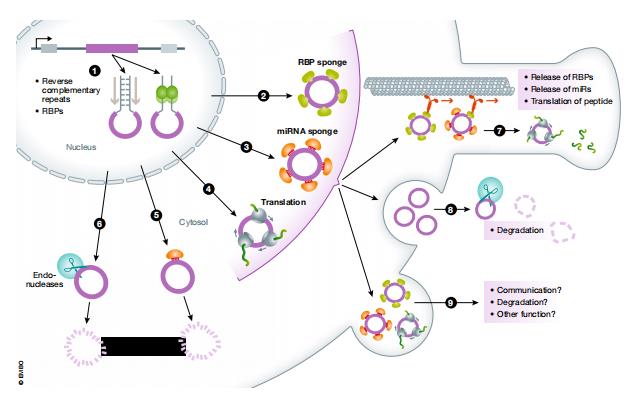
图1.circRNAs概览图。circRNA可以在反向互补重复序列或RNA结合蛋白的帮助下产生并从细胞核输出(1)。在细胞质中circRNA可能受多种因子的束缚,可以是RNA结合蛋白(2),载有miRNA作为海绵或支架的Argonaute蛋白(3),核糖体(4),Argonaute蛋白或者内切核酸酶(5)导致circRNA降解(6)。circRNA与因子非降解结合,其复合物可以在细胞质中扩散或者被主动转运到细胞的特定区域[例如突触(7)],从而释放其结合的因子或被翻译。囊泡中的circRNA或circRNA因子复合物被释放到细胞外空间以降解circRNA(8)。然而受囊泡保护的circRNA或circRNA复合物可以到达其他细胞或组织,充当信使分子或执行其他未知功能(9)。
2.序列与蛋白质驱动外显子环化
外显子衍生的circRNA的产生至少依赖其中一种机制:具有长反向重复的内含子或与RBP的结合。这两种机制使circRNA侧翼内含子彼此非常接近。相比连接位点的规范剪接事件,circRNA的侧翼内含子难以有效剪接,这表明线性剪接是默认的剪接过程(2016b)。此外,可环化的外显子在果蝇,人,小鼠,猪和植物中都有长内含子(Jeck等,2013;Guo等,2014;Westholm等,2014;Veno等,2015;Ye等。al,2015;Zhao等,2017)。其中很多内含子显示广泛的反向互补性(Capel等,1993;Jeck等,2013;Liang&Wilusz,2014;Zhang等,2014)。此外,内含子中反向互补重复的存在可用于预测哪些外显子可能发生环化(Ivanov等,2015)。根据分析的物种反向互补元素显示不同的基序富集。在人类中,88%是ALU重复,而在小鼠中,22%是ALU样重复,而在蠕虫中,只有11%富含一种特定基序(Jeck等,2013;Ivanov等,2015)。这些基序之间的序列比对指出了可能的进化关系(Ivanov等,2015)。有趣的是,ALU元件被认为起源于进化过程中的转座子(Quentin,1992)。此外,位于内含子之间或之内的反向元件分布对circRNA的产生丰度和类型有影响(Zhang等,2014)。例如,在人成纤维细胞中表达的仅有40%的circRNA表达,其侧翼内含子中含有ALU重复的基因,其中20%也是互补的(Jeck等,2013)。在猪皮质中表达的30%的circRNA在可环化外显子侧翼的内含子中具有互补的短分散的序列(Veno等,2015)。在秀丽隐杆线虫中观察到的38%(Ivanov等,2015)。在可环化外显子侧翼的许多内含子中不存在反向重复,这强烈表明外显子环化存在其他机制。事实上,剪接因子MBL介导了一种替代机制(Ashwal-Fluss等,2014)。MBL与几个高度保守的内含子位点结合,促进其自身第二外显子的环化。有趣的是,果蝇MBL基因产生mRNA编码几种蛋白质,其中只有MBL-C和MBL-A才促进外显子环化。可以想种型MBL-C和MBL-A促进内源性人MBNL1基因的环化,表明了存在高度保守的机制(Ashwal-Fluss等,2014)。circMb1也强烈结合MBL蛋白,指出这两个分子之间存在调节回路。哺乳动物两种MBL同源物(MBNL1和MBNL2)在小鼠和人中产生circRNA(Salzman等,2012;RybakWolf等,2015)。虽然与果蝇相比,这些circRNA表达水平相对较低,但其含有两倍以上的MBL/MBNL1/MBNL2蛋白结合位点,在不同的物种保持MB(N)L/circMbl(n)l比例(Ashwal-Fluss等,2014)。有趣的是,位于MBL第二外显子侧翼的内含子包含很可能的短反转序列稳定内-内相互作用,但可能太弱而不能在没有MBL结合的情况下促进外显子环化(Ashwal-Fluss等,2014)。这有力地表明MBL通过与侧翼内含子结合并促进内含子-内含子相互作用来促进环化。MBL分子可以二聚化,将外显子的两端结合在一起以允许circRNA形成(Yuan等,2007)。其他RBP,如QKI,FUS和ESRP1,也可以调节外显子环化。QKI通过与环化外显子周围的内含子序列结合,在人细胞培养物的上皮-间充质转化过程中促进全球circRNA的产生(Conn等,2015)。有趣的是,像MBL一样,QKI可能会二聚化促进环化(Teplova等,2013)。FUS规定通过与特定外显子-内含子连接结合,在小鼠胚胎干细胞衍生的运动神经元中形成circRNA(Errichelli等,2017)。此外,剪接因子ESRP1通过与存在于可环化外显子侧翼的内含子中的特定位点结合来介导circBIRC6的环化(Yu等,2017)。最后,果蝇中漆酶-2衍生的circRNA的生物合成受不同RBP的组合调节,例如异质核核糖核蛋白(hnRNP)和SR蛋白,表明给定外显子的环化效率可能是由于几种信号的整合(Kramer等,2015)。综上所述,内含子长反向重复和与RBP的结合(并且可能是二聚化)促进内含子-内含子相互作用,导致circRNA形成。通过内含子-内含子相互作用促进环化,有部分原因线性剪接的空间抑制。在这种情况下,通过促进或破坏RNA结构的因子,以及影响内含子-内含子相互作用,可以影响circRNA的生物合成。RNA解旋酶DHX9通过破坏二级结构来限制circRNA的产生,例如基于ALU反向重复的二级结构(Aktas等,2017)。DHX9直接与ADAR的干扰素诱导型同种型(p150)相互作用,该复合物负责破坏RNA二级结构,包括许多可促进外显子环化的结构。有趣的是,DHX9下调检测到的circRNA的数量增加了一倍(约26,000到~50,000).这似乎是一种减少circRNA广泛产生的校正机制,并表明一些circRNA只不过是“加工缺陷”或拼接噪音。然而,这也表明甚至在DHX9存在下产生的circRNA的潜在需求。涉及dsRNA结构出现的特定生理情况也可以改变circRNA生物发生。例如,免疫应答因子NF90和NF110(Patin等人,2015)调节circRNA产生。有趣的是,这些蛋白质在感染时与病毒RNA结合并与转录过程中形成的dsRNA结构相互作用。这种结合似乎稳定了这种瞬时RNA双链体并促进了一部分circRNA的反向剪接(Li等,2017a)。有趣的是,NF90结合位点是选择性的富含内含子的ALU基序,支持circRNA形成外显子。因此,这些外显子的环化也可以进行ADAR和/或DHX9控制。此外,模拟病毒感染的聚(I:C)(聚肌苷:聚胞苷酸)刺激促进NF90/NF110向胞质溶胶的输出。在这些条件下,通过NF90/NF110的结合产生的circRNA被下调(Li等,2017a)。NF90/NF110不仅结合细胞核中的新生circRNA,还结合细胞质中的至少两个circRNA(circPOLR2A和circDHX34)。在聚(I:C)处理或水泡性口炎病毒感染时,两种circRNA与NF90/NF110的相互作用减少。对于其他circRNA也可能是这种情况。因此,circRNA可能触发NF90/NF110的释放,使其在病毒感染时与病毒RNA结合(Li等,2017a)。RIG-1是一种检测dsRNA并触发抗病毒细胞因子产生的蛋白质(Yoneyama和Fujita,2008),改变了HeLa细胞中的circRNA产生。我们对促进、干扰或调节circRNA形成的机制的理解在未来几年中可能会增加。评估产生circRNA的机制以及进化保守程度是非常有趣的。此外,人们想知道具有反式功能的circRNA是否由特定类型的机制产生。
3.circRNA生物合成的调节
circRNA由RNA聚合酶II转录并由剪接体产生。重要的是,形成circRNA的许多外显子不是可变剪接的,由于CircRNA来源于mRNA前体,mRNA前体在加工过程中可以进行典型的线性剪切产生mRNA,也可以发生非典型剪切产生CircRNA。研究发现提高典型线性剪切的效率会导致产生CircRNA的数目显著减少,当外显子侧翼的内含子长度比较长时,发生典型线性剪切的效率显著下降,而发生环化的效率显著提高,说明转录时CircRNA可以与mRNA前体发生剪切竞争。
4.circRNA的降解
circRNA没有游离末端,因此许多规范的RNA衰变途径无法获得。使用4-硫尿苷代谢标记对细胞培养物中的60个circRNA进行的体外研究表明,大多数测定的circRNA比其线性对应物具有更长的半衰期(18.8-23.7h)(4.0-7.4h;Enuka等,2016)。其他研究支持这一发现(Ashwal-Fluss等,2014;Zheng等,2016;Liang等,2017)。circRNAs在体内可能具有更长的半衰期,特别是在不分裂的细胞类型中。实际上,大脑中circRNA的年龄依赖性积累可能是由于这些分子的高稳定性。反之亦然,似乎circRNA不会在具有高增殖率的组织中积累(Bachmayr-Heyda等,2015)。这可能是由于如果增殖高于产量,可以稀释circRNA。关于circRNA在体内降解的机制和速率知之甚少。理论上,circRNA降解可以通过核酸内切酶启动,然后通过外切核酸酶和内切核酸酶的组合。在体外使用RNaseH和Rrp44显示了通过核酸内切酶活性进行circRNA降解的第一个提示(Mackie,1998;Schaeffer等,2009)。在这两种情况下,作者测试了人工环状RNA构建体,并且这些circRNA种类的切割非常低。迄今为止,小RNA介导的circRNA降解是最佳表征的circRNA降解途径。然而,除了基于人工shRNA/siRNA的系统之外,迄今为止唯一的例子(Jeck等,2013;Legnini等,2017;Pamudurti等,2017;Yu等,2017),是miR-671对CDR1as的降解(Hansen等,2011)。值得注意的是,circRNA中的miRNA结合位点几乎与miRNA完全互补。CDR1as的量由miR-671通过AGO2介导的降解直接调节(Hansen等,2013)。CDR1as,miR-671及其结合位点是高度保守的(Hansen等,2013),并且该位点的缺失导致CDR1a水平的显着增加(Kleaveland等,2018)。有趣的是,CDR1as水平可能通过切片调节miR-7,这也取决于miR-671(Kleaveland等,2018)。最近的一项研究表明RNA修饰N6-腺苷甲基化(m6A)促进内切核酸酶的募集,所述内切核酸酶可能降解circRNA(Park等,2019)。另一项研究发现在HeLa细胞中聚(I:C)刺激或脑心肌炎病毒(EMCV)感染后circRNA的全球降解(Liu等,2019)。两种处理均导致内切核糖核酸酶RNaseL的活化和circRNA的降解。有趣的是,一部分circRNA结合并抑制PKR(蛋白激酶dsRNA激活),这是一种对病毒感染反应的激活剂。此外,作者发现自发性RNaseL激活,PKR磷酸化增加和外周血中circRNA减少。
二、circRNA的特性和特征
1.circRNA的进化保守性问题(图2)
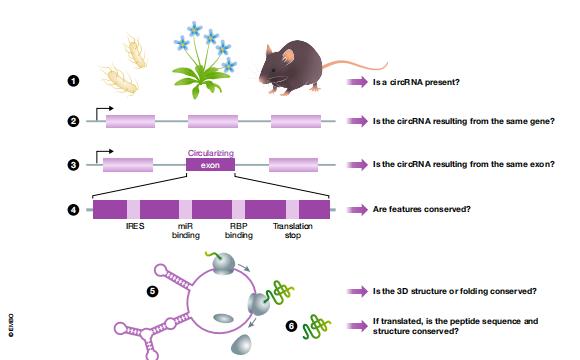
图2:circRNAs进化保守的多个水平。为了确定两种或更多种生物之间的circRNA的保守水平,我们提出了几个一般性问题:1.两种生物体中是否存在circRNA?2.在两种生物中,同一(同源或直系同源)基因是否产生circRNA?3.circRNA是否由相同的外显子产生?4.潜在的特征是否得到保护?这意味着可能存在RBP和miRNA结合位点,IRES和平移终止的存在。5.是否保留了潜在的3D结构?6.如果翻译了circRNA,那么肽序列同源物也是如此?
2.组织,发育阶段和亚细胞位置特异性表达
宿主circRNA的基因高度富集脑相关基因(Ashwal-Fluss等,2014; Westholm等,2014; Rybak-Wolf等,2015; You等,2015)。因此, circRNA在神经组织中高度富集并不奇怪。这种CNS特异性富集似乎 是所有研究物种中circRNA的一般特征(Guo等,2014; Westholm等,2014; Rybak-Wolf等,2015; You等, 2015)。值得注意的是,脑内circRNA的表达具有高度特异性,并 且在许多情况下,与宿主基因产生的线性同种型的表达无关 (Rybak-Wolf等,2015; Veno等,2015; You等, 2015年)。 CNS中circRNA的显着富集可能是由于一种或多种因素。首先,大 脑,更具体地说,神经元在体内显示出最高的可变剪接率(Yeo等, 2004; Pan等,2008),并且circRNA生物发生可以被定义为特定类 型的可变剪接。另一个有趣特征是它们的亚细胞定位。与在转录位点附近定位的异常剪接产物不同,circRNA主要是细胞质的(Nigro等,1991;Capel等,1993;Cocquerelle等,1993;Salzman等,2012;Memczak等,2013;Werfel等)。al,2016)。circRNAs对轴突,树突和突触的定位也很有趣。目前尚不清楚观察到的积累是由于定向转运还是由于这些分子在这些区室中的扩散和保留(例如,通过与膜蛋白结合或仅仅不可能返回)。进一步的遗传和生物化学实验应该揭示驱动神经元内circRNA的亚细胞定位的机制。
3.circRNAs的翻译
Yang等(2017)鉴定了由癌细胞系和人成纤维细胞中的一部分circRNA产生的几种小肽(Yang等,2017)。有趣的是,作者发现当腺苷甲基化时,起始密码子上游的RRACH基序(R=G或A;H=A,C或U)增强了circRNA的转录(Yang等,2017)。大多数预测的肽可能与circRNA宿主基因编码的蛋白质的N-末端区域相同。这些截短的蛋白质可能作为其线性mRNA表达的全长对应物的竞争者。一种可能的情况可能是像Mef2这样的转录因子。它的N-末端DNA结合结构域可能是从circRNA表达的(Legnini等,2017),可能与全长Mef2竞争DNA结合位点,甚至可以自己发挥作用(Heetal,2011;Legnini)等,2017)。最直接的假设是circRNA编码的蛋白质本身具有功能。考虑到该领域的快速发展,我们期望在未来几年内出现研究显示circRNA翻译和所得肽的生理影响。
4.circRNAs作为诱饵,转运蛋白或支架
由于circRNA稳定,并与RBP结合,因此它们可以作为转录因子的诱饵或转运蛋白。在一些情况下,circRNA和宿主基因的蛋白质产物之间可能存在直接或间接的串扰。
三、评估circRNA在体内的功能
1.发挥miRNA 海绵效应,circRNA 富含miRNA 的结合位点,可以阻止miRNA与3’端非编码区与mRNA结合,即调控miRNA下游靶基因的表达。
2.调控蛋白结合(图1)
3.调控基因转录
4.编码蛋白
结论:
此文献描述的研究表明,circRNA可以作为蛋白质的支架,可以募集其他RNA种类,并且通过miRNA的结合,可以影响特定mRNA的转录沉默,翻译或衰变。神经元中circRNA的不对称分布表明这些RNA在细胞中的定向转运的可能性。circRNA可以编码蛋白质。虽然大多数这些可能的蛋白质的生理功能尚未确定,但它们很可能会分享由转录本的线性形式编码的全长蛋白质对应物的一些能力。作为旁注,circRNA的编码能力和稳定性可用于需要产生肽的生物技术应用。随着RNA技术稳步发展,我们预见到了一个伟大的发展未来几年对circRNA领域的评价。进一步了解circRNA定位,运输,活细胞降解,完整的circRNA相互作用组和单细胞分析是该领域的一些预期进展。






