LncRNA新发现——HAND2-AS1促进肝癌干细胞的自我更新
关于癌症的研究一直是热门,随着技术的不断发展,研究者们已从各种方面针对癌症展开了研究。近期,一篇名为“LncRNA HAND2-AS1 promotes liver cancer stem cell self-renewal via BMP signaling”的文章在杂志 The EMBO JOURNAL上发表。
这项研究证明了HAND2-AS1促进肝脏CSCs的自我更新,促进肝脏肿瘤的发生,可能成为肝癌诊断的潜在生物标志物和HCC治疗的靶点,为如何开发针对肿瘤的长效治疗手段提供了新思路。

摘要:
肝细胞性肝癌(HCC)是最常见的肝癌,具有高复发率和异质性的特点。肝癌干细胞(CSCs)可能对这两种病理特性都有很大贡献,但对其自我更新维持的内在机制却知之甚少。在这里,我们鉴定了一种称为HAND2-AS1的长非编码RNA(LncRNA),它在肝脏CSCs中高度表达。人HAND2-AS1及其小鼠同源物lncHand2具有较高的保守性。HAND2-AS1是肝脏CSC自我更新维持以启动HCC的发展所必需的。从机制上讲,HAND2-AS1将INO80染色质重塑复合体招募到BMPR1A启动子上,从而诱导其表达并导致BMP信号传导的激活。重要的是,通过反义寡核苷酸(ASOS)干扰HAND2-AS1的表达和通过siRNAs干扰BMPR1A的表达对人源化肝癌模型具有协同抗肿瘤作用。此外,敲除小鼠肝细胞中的lncHand2或BMPR1A可破坏BMP信号传导,并抑制肝癌的发生。我们的研究结果表明,HAND2-AS1促进肝脏CSCs的自我更新,并推动肝脏肿瘤的发生,为HCC治疗提供了一个潜在的新靶点。
技术路线:
![说明: C:\Users\y107\AppData\Roaming\Tencent\Users\3005006148\QiDian\WinTemp\RichOle\KI2I~0EM16SC`Z58K]B[Y_S.png](https://img1.dxycdn.com/2019/1011/698/3373172331123115567-14.jpg)
结果:
1.HAND2-AS1在肝脏CSCs中的表达明显增加
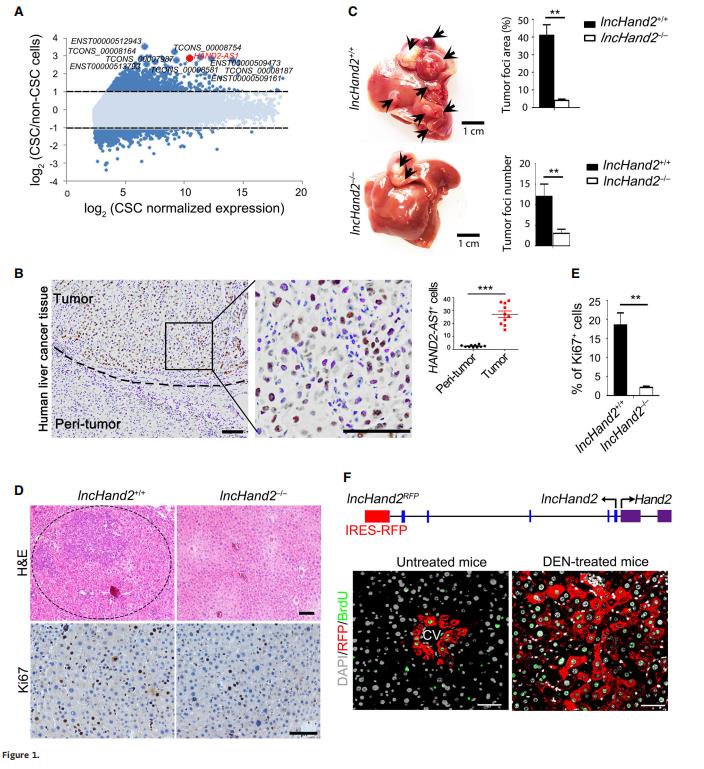
研究者们通过芯片分析挑选了在10种CSC中上调最明显的lncRNA(图1A)。选择lncRNA HAND2-AS1为此次研究的目标,并利用原位杂交证实其在肝癌组织中高表达(图1B)。
2.HAND2-AS1缺乏对化学诱导的HCC发展的保护作用
研究者们通过将lncHand2flox/flox小鼠与白蛋白(Alb)-Cre小鼠杂交,有条件地删除了肝细胞lncHand2。在LncHand2+/+和LncHand2基因敲除(LncHand2-/-)小鼠中使用二乙基胺(DEN)化学诱导肿瘤形成(图1C)。图E与图F为两组小鼠肝脏的HE染色结果和Ki67检测结果。研究者发现lncHand2-RFP肝细胞主要存在于中心静脉周围(,在DEN治疗后,lncHand2-RFP阳性细胞从中心静脉扩散到整个肝脏(图1F)。
综上所述,HAND2-AS1促进化学诱导的肝癌发展。
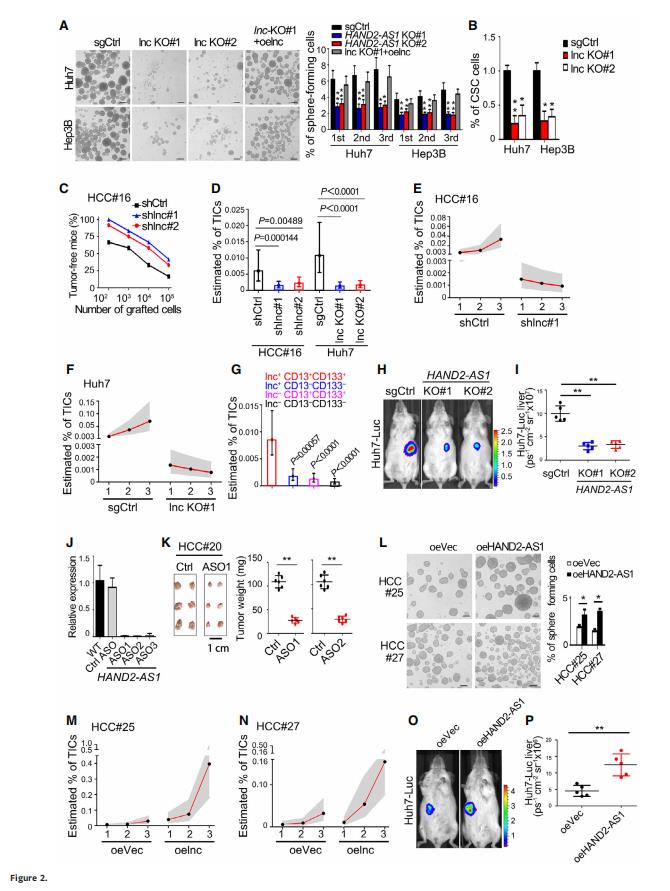
3.HAND2-AS1是肝脏CSC自我更新维护所必需的
HAND2-AS1缺失显著降低了HCC细胞系(图2A)和原发肿瘤细胞的初级(1)、次级(2)和第三(3)肿瘤圈形成,HAND2-AS1(Oelnc)的过表达挽救了因HAND2-AS1缺失而减少的球体形成。HAND2-AS1敲除显著降低CD13+CD133+细胞的比例(CSCs;图2B)。对不同癌细胞群进行极端极限稀释,然后将一系列肿瘤移植到免疫缺陷小鼠中,以测量它们形成继发性肿瘤的能力。HAND2-AS1缺乏会损害移植后继发性肿瘤的改建能力(图2C和D),这种差异在连续移植中增加(图2E和F)。图2G为首次移植后不同组群抽搐的估计频率。将抗Hand 2-AS1的sgRNAs导入含荧光素酶载体的Huh 7细胞(Huh7-Luc)中 ,HAND2-AS1缺失显著降低了异种移植物的原位生长,显著抑制了生物发光(图H,I)。研究者还使用反义寡核苷酸(ASOS)沉默HAND2-AS1的表达。三种不同的ASO有效地阻断了肝脏HAND2-AS1的表达,但不能阻断ASO的扰乱对照(图2J),此外,HAND2-AS1 ASOS给药显着降低了肿瘤的生长(图2K)。HAND2-AS1的过表达显著增加了肿瘤圈的形成(图2L),图M,N为在一系列有限稀释法移植过程中HAND2-AS1过表达和对照HCC细胞中TIC的估计频率。HAND2-AS1的过表达显著增强了Huh7-Luc(图2O和2P)。这些数据表明HAND2-AS1在肝脏CSC的自我更新维持中起着关键作用。
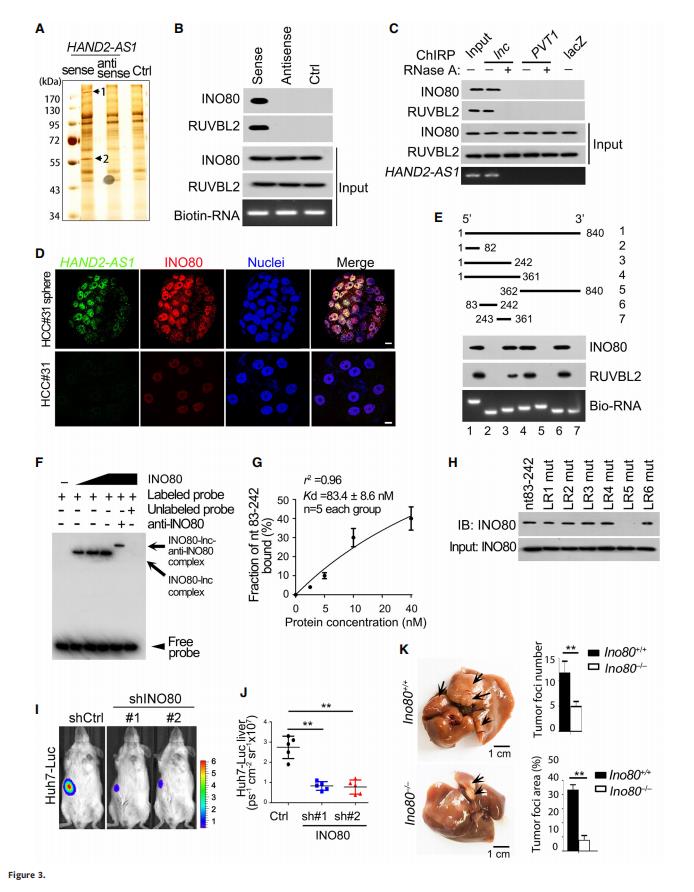
4.HAND2-AS1招募INO80复合物和INO80敲除抑制肝癌的发展
研究者们通过RNA下拉试验寻找潜在的HAND2-AS1结合蛋白。HAND2-AS1相关的INO80复合物的INO80和RUVBL2亚基与肝脏CSC相关(图3A)。Western blotting(图3B)和原代肝细胞中RNA结合蛋白的综合鉴定(图3C)证实了它们的相互作用。HAND 2-AS1与INO 80共定位于HCC肿瘤细胞的细胞核中(图3D)。图E为HAND 2-AS1的INO 80结合区的定位分析,用RNA电迁移率变化法(EMSA;图3F和G)进一步证实HAND 2-AS1片段与INO 80的结合。图H为用RNA下拉试验检测INO 80与HAND 2-AS1突变在第2外显子NT 83-242处的相互作用区域的结果。
为进一步确定INO 80在肝癌发生发展中的作用,研究者们用shRNAs方法使肝癌原发细胞中INO 80的表达减弱,INO 80缺乏对异种移植物的原位生长有明显的抑制作用,对生物发光有明显的抑制作用(图3i和J)。INO80基因敲除显着降低了化学诱导的肝肿瘤生长和数量(图3K)。这些数据表明,INO 80促进了肝脏癌的发生和肿瘤的发展。
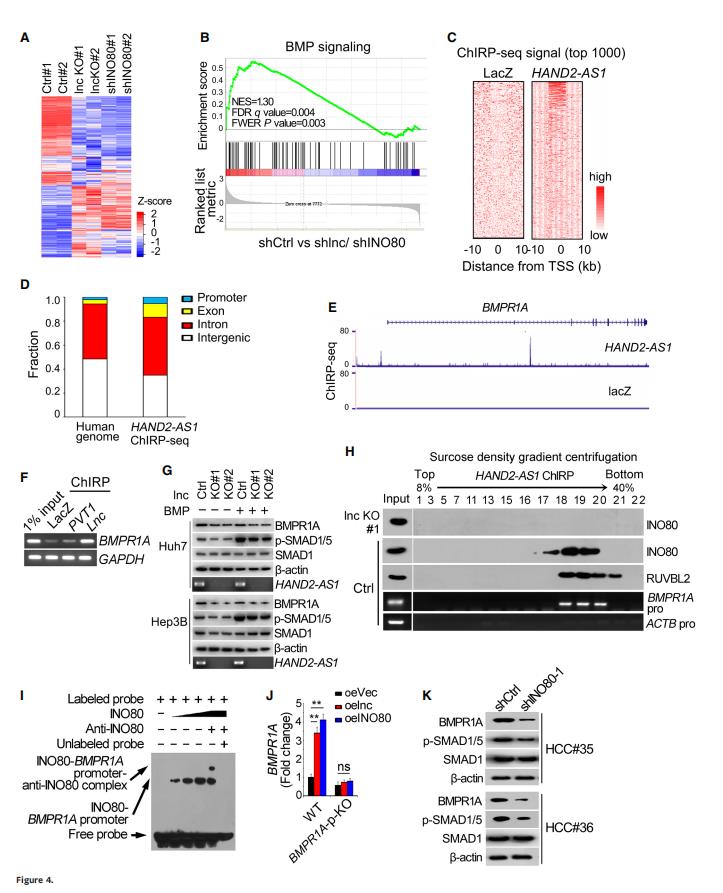
5.HAND2-AS1将INO80复合物招募到BMPR1A启动子上启动其表达和BMP信号转导
为了鉴定HAND2-AS1的靶点,研究者们建立了HAND2-AS1和INO80耗竭的HCC原代CSC细胞,并进行了转录组芯片分析。HAND2-AS1和INO80的缺乏表现出相似的转录组模式(图4A),表明HAND2-AS1和INO80之间存在功能关系。GO分析显示当HAND2-AS1和INO80都被耗尽时,BMP信号传导中的靶基因被显著抑制(q值=0.0003;图4B),表明BMP信号传导参与了肝脏CSC的调节。
为了研究HAND2-AS1的基因组结合区,用RNA纯化(ChIRP)-seq技术对肝癌肿瘤球细胞和来自HCC原发肿瘤样本的肝脏CSC中对HAND2-AS1进行染色质分离。与LacZ对照组相比,HAND 2-AS1在肝癌肿瘤球细胞中有显著的富集峰(图4C)。ChIRPseq数据显示HAND2AS1可以结合基因组中的不同位点(图4D)。分析BMP信号的ChiRP-seq基因,发现HAND2-AS1 RNA在BMPR1A、SMAD1和SMAD9基因座上富集(图4E)。图F为肝脏CSCs中HAND2-AS1 RNA结合BMPR1A启动子的凝胶分析结果(LacZ和PVT1作为阴性对照)。
此外,HAND 2-AS1缺失抑制了BMPR1A的表达和BMP信号的激活(图4G)。图4H为BMPR1A与对照组和HAND2-AS1-敲除肝脏CSC中INO80复合物的相互作用的ChIRP免疫印迹分析结果。EMSA显示HAND2-AS1与INO80和BMPR1A启动子区域形成复合物(图4I),而INO80和HAND2-AS1的过表达并没有增强BMPR1A启动子缺失的肝细胞中BMPR1A的表达(图4J),INNO80缺乏显著抑制BMP信号(图4K)。综上所述,这些数据表明,HAND 2-AS1在BMPR1A启动子上激活INO 80复合物,启动其表达并激活BMP信号。
6.BMPR1A通过BMP信号通路促进肝脏CSCs自我更新
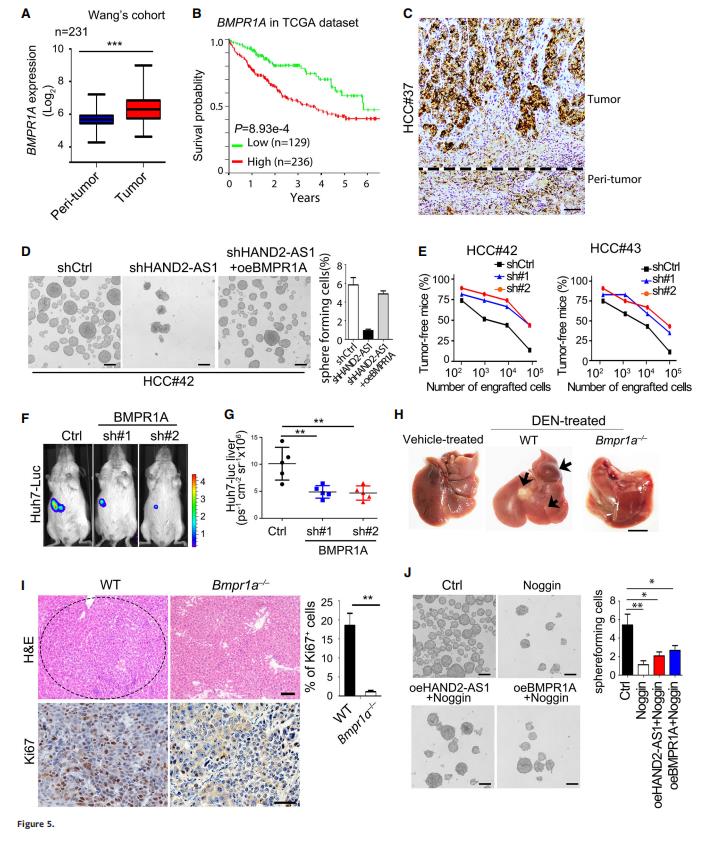
研究者们根据前人的研究数据分析了BMPR1A在HCC肿瘤和癌周组织中的表达——BMPR1A在肝癌中高表达(图5A),同时BMPR1A也是肝癌的理想预后预测指标(图5B),免疫组化进一步证实其在肝癌组织中的高表达(图5C)。在HCC原代细胞中沉默BMPR1A并建立稳定沉默的细胞系,可以观察到BMPR1A耗竭显著抑制了球体的形成和肿瘤的启动能力(图5D和E),BMPR1A耗尽显著减少肿瘤Huh7-Luc,显著抑制生物发光(图5F和G)。通过CRISPR/Cas9介导的基因编辑在体内产生BMPR1A基因敲除小鼠,与WT相比较,Bmpr1a缺失降低了DNE治疗后的肝癌形成能力(图5H)。图I为10个月大DEN治疗的WT和Bmpr1a-/l-小鼠肝脏切片中的代表性H&E和Ki67抗体免疫组织学染色结果。BMP抑制剂显着地减少了肿瘤层的形成(图5J)。由这些数据可以看出,Bmpr1A通过BMP信号通路促进肝CSC自我更新和肝癌的发展。
7.HAND2-AS1的Asos和抗BMPR1A的siRNAs对人源化肝癌模型具有协同抗肿瘤作用
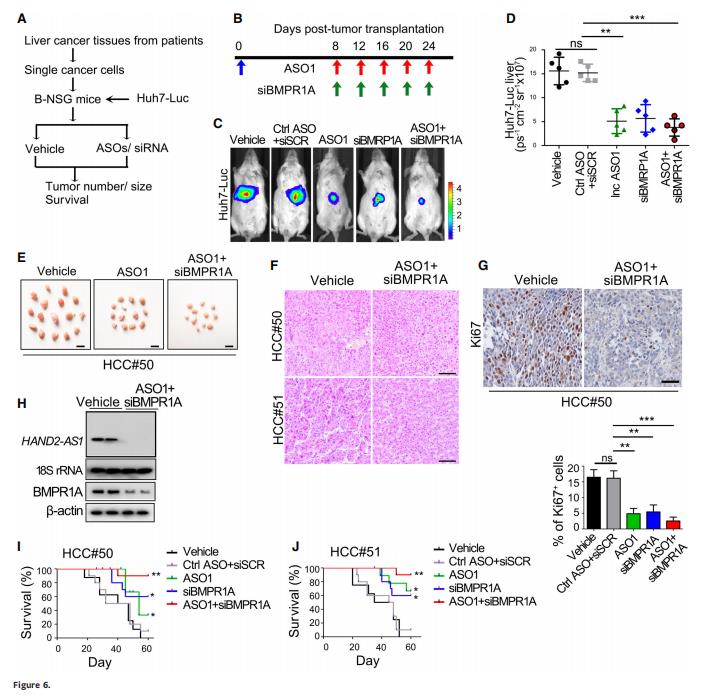
为了研究HAND 2-AS1缺失在肝癌治疗中的作用,研究者们使用Huh7-Luc和PDX模型,重新描述了人肝癌的复杂性和表型异质性(图6A)。图6B为ASO/siRNA治疗时间表图示。与载体治疗组相比,添加ASOs的HAND2-AS1或针对BMPR1A的siRNAs可抑制肿瘤生长和肿瘤数量(图6C-F),用加扰RNA处理HAND2-AS1的ASO和/或针对BMPR1A的siRNAs获得了与载体处理组相似的结果(图6C和D)。HAND2-AS1 ASO和BMPR1A siRNAs的组合对人源化HCC模型显示了协同治疗作用(图6C-F)。HAND 2-AS1 Asos和BMPR1A siRNAs显著抑制异种移植物细胞增殖(图6G)以及HAND 2-AS1和BMPR1A的表达(图6H)。与载体处理组相比,HAND2-AS1 ASO和BMPR1A siRNAs处理延长了存活率(图6I和J)。综上可知,靶向HAND 2-AS1和BMPR1A对人源化肝癌模型具有协同抗肿瘤作用。
结论:
这项研究证明了HAND2-AS1的ASOS与针对BMPR1A的siRNAs结合可以显着降低肿瘤的生长,从而提高PDX肝癌模型的整体生存率。此外,仅应用ASOS对HAND2-AS1具有强大的抗肿瘤活性,表明ASOS靶向lncRNAs可能是肝细胞癌的潜在治疗靶点。然而,如何将基于RNA的寡核苷酸有效地传递到肿瘤中,并保持对肿瘤的长效作用,仍然需要肿瘤生物学领域的深入研究。综上所述,HAND2-AS1促进肝脏CSCs的自我更新,促进肝脏肿瘤的发生,可能成为肝癌诊断的潜在生物标志物和HCC治疗的靶点。






