Nature immunology揭示LncRNA调节抗病毒天然免疫上游通路的新机制
抗病毒天然免疫中,宿主识别外源RNA并清除。RIG-I是抗病毒天然免疫中的重要基因,它识别RNA病毒后聚集于线粒体与MAVS作用,传递信息至下游信号通路,从而激活包括I型干扰素在内的抗病毒反应通路。作为其中一种RNA病毒感受分子,前人研究中在创新性的发现了宿主自身也存在lncRNA与之结合并调节其活性。相关通路中是否还有结合lncRNA调节方式呢?
在前人报道中, TRIM25结合RNA后抗病毒反应作用增强;而登革热病毒的RNA能与TRIM25结合并抑制其功能。该文作者便深入研究了lncRNA对TRIM25的调节作用。最终发现Lnczc3h7a通过scaffold作用促进TRIM25与RIG-I的结合,该结合促进了MAVS/IRF3通路的激活。这可能是宿主抵御病毒RNA阻断RIG-I活性的一种防御方式。
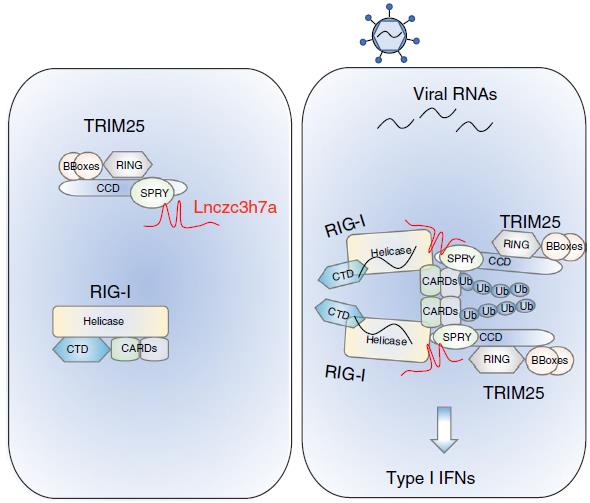
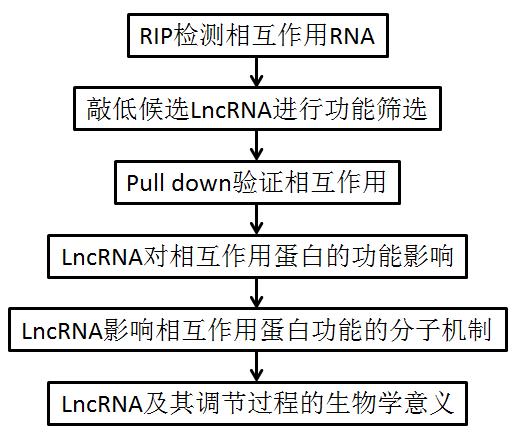
图1 研究结果模式图和流程图
作者首先在Flag-TRIM25过表达的小鼠巨噬细胞系RAW264.7中通过RIP-Seq检测了VSV感染前后与TRIM25相互作用的lncRNAs。然后确立VSV感染后富集丰度最高的20个lncRNAs为候选指标。通过siRNA在小鼠腹腔巨噬细胞中逐一敲低相应lncRNA后,作者一一检测了VSV感染后细胞相应的IFNB1转录水平变化。敲低编号RIP.6683的lncRNA后,VSV感染后的IFNB1水平显著下降。因此作者认为该lncRNA参与调解该过程。该lncRNA为新发现lncRNA且被命名为Lnczc3h7a。作者对其特征进行了一系列鉴定:长603个核苷酸,含polyA尾,位于小鼠编码基因Zc3h7a的内含子区域,无蛋白质翻译。但在人基因组上未能扩增出该序列。
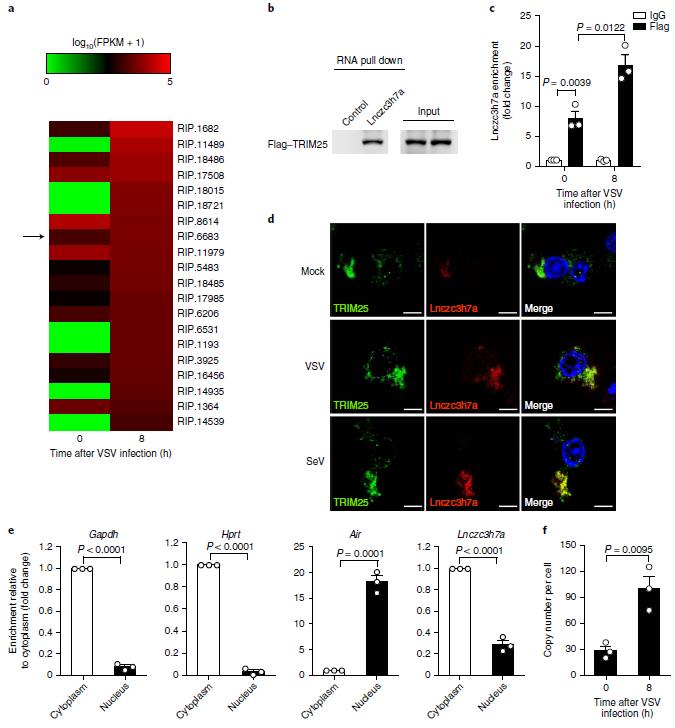
图2 Lnczc3h7a能与TRIM25结合
作者通过生物素标记的Lnczc3h7a pull down也能检测到TRIM25的富集。而且VSV感染后,两者的相互作用更强。FISH实验表明,SeV和VSV感染后,Lnczc3h7a表达量升高;而且Lnczc3h7a与TRIM25共定位。进一步检测其他病原体刺激后Lnczc3h7a的表达变化发现,RNA病毒和IFNB1的处理上调其表达的作用最为显著。在细胞和小鼠模型中敲低和敲除Lnczc3h7a后,作者检测到RIG-I介导的下游抗病毒基因在VSV感染后激活水平显著降低。通路下游激活标志p-IRF3水平也显著下降。这进一步证明了Lnczc3h7a对RIG-I介导的RNA病毒响应具有正向调节作用。
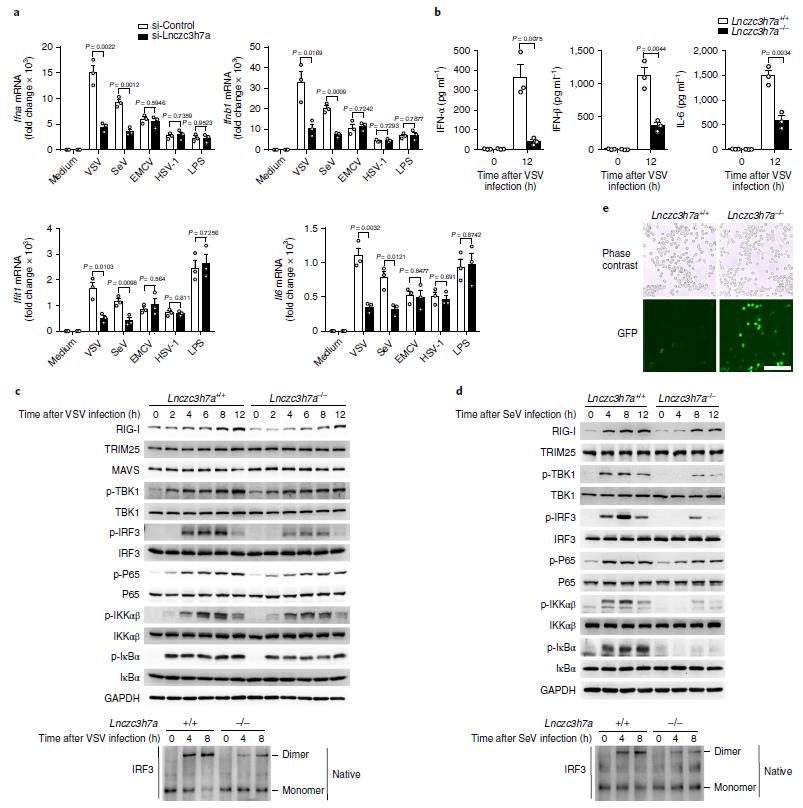
图3 Lnczc3h7a促进TRIM25下游抗RNA病毒信号通路的激活
Lnczc3h7a过表达并不影响TRIM25的寡聚化和泛素化,也不影响MAVS的泛素化。通过截断实验作者发现是TRIM25的SPRY结构域与Lnczc3h7a相互作用。过表达Lnczc3h7a能促进RIG-I的K63泛素化以及RIG-I和TRIM25的共定位。这些结果表明Lnczc3h7a结合TRIM25,促TRIM25与RIG-I的结合以及RIG-I的K63泛素化。
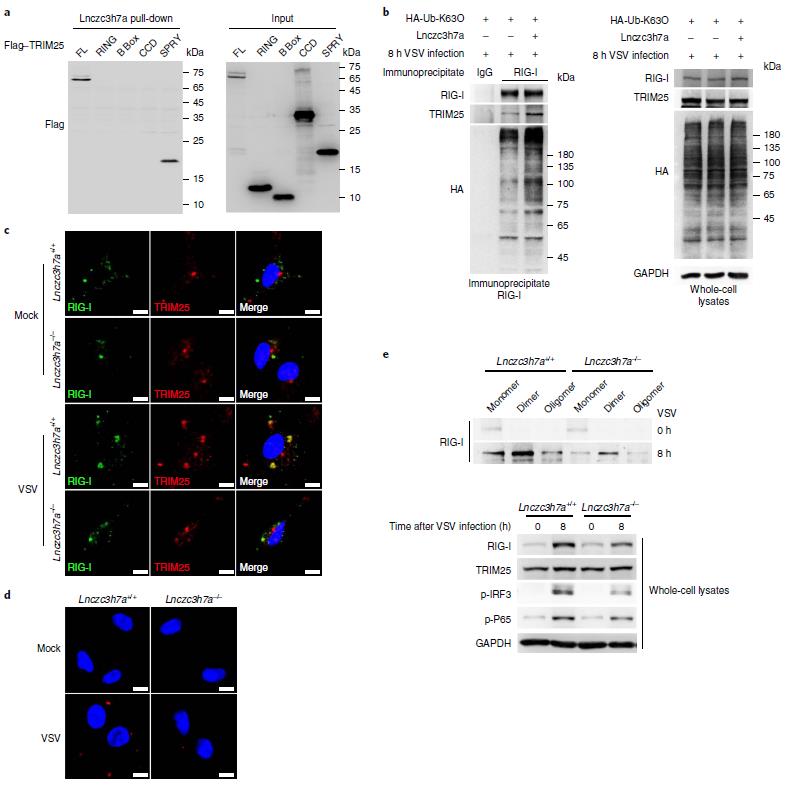
图4 Lnczc3h7a促进TRIM25介导的RIG-I K63泛素化
接下来,作者开始研究Lnczc3h7a如何调节TRIM25与RIG-I的相互作用。在VSV感染后,作者检测到Lnczc3h7a和RIG-I的相互作用;而未感染时则没有。在敲除TRIM25后,VSV感染后的Lnczc3h7a与RIG-I相互作用消失。GST-pull down实验表明Lnczc3h7a与RIG-I的helicase结构域相互作用。而该结构域只在激活后暴露。Pull down实验也表明Lnczc3h7a主要与活化的寡聚体RIG-I结合。因为该结构域能识别病毒RNA,所以作者检测了Lnczc3h7a是否会与病毒RNA竞争性结合该结构域。作者未检测到它们之间的竞争性结合,这说明它们可能各种有不同的结合位点。进一步的实验证明了Lnczc3h7a与RIG-I的结合不能使其激活。

图5 Lnczc3h7a与活化的RIG-I的解旋酶结构域相结合
通过iCLIP实验,作者检测到TRIM25结合位点在Lnczc3h7a的308和311位附近;RIG-I结合位点在Lnczc3h7a的332位附近。在Lnczc3h7a敲除细胞中,回复表达该区域删除突变的Lnczc3h7a均不能回复其功能,而野生型Lnczc3h7a能回复其促进TRIM25和RIG-I结合的功能。如图6c所示,红色信号代表TRIM25和RIG-I之间的相互作用。
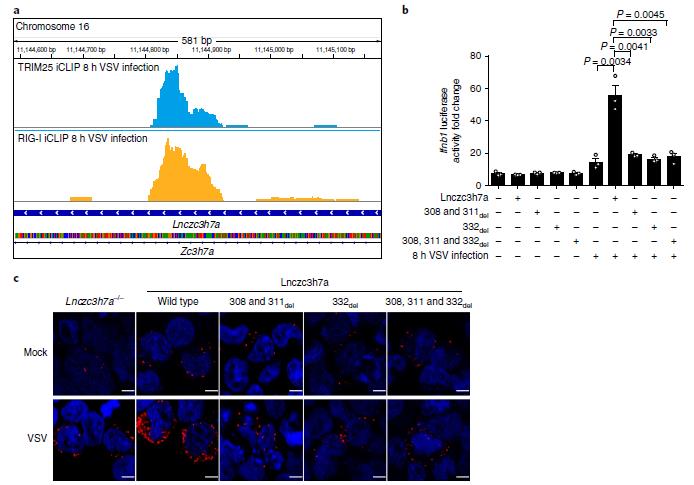
图6 Lnczc3h7a通过其308、311和332附近序列促进TRIM25和RIG-I之间的相互作用
该文为我们研究lncRNA在信号通路上游的调控作用提供了很好的参考。Lnczc3h7a在人基因组同样位置未检测到lncRNA转录,那人体内是否有同样的调控机制和是哪一个lncRNA分子参与调解是值得研究的内容。同时,病毒感染后Lnczc3h7a的表达上升的调控机制也是值得关注的问题。






