activin A帮你挽救癌症
2019年8月21日发表在J Cachexia Sarcopenia Muscle(IF=10.754)上的一篇名为“Autocrine activin A signalling in ovarian cancer cells regulates secretion of interleukin 6, autophagy, and cachexia. ”的研究揭示了激活素A信号在卵巢癌细胞中的发生发展中的功能和机制。为我们提供了一种新的研究方向。在本研究中,激活素A以自分泌方式促进癌细胞合成和分泌IL-6。 通过抑制激活素A信号传导,癌细胞中IL-6的产生减少40-50%。当使用生物,化学和遗传方法干扰自身痤疮激活素A时,始终观察到癌细胞中IL-6分泌显着降低(P <0.05)。 抑制激活素信号传导也降低了癌细胞加速非癌细胞自噬的能力(自噬通量减少高达43%,P = 0.0006)。与体外数据一致,抗体激活素受体2抗体在恶病质荷瘤小鼠中的应用使癌细胞衍生的IL-6的血清水平降低62%(从417到159pg / mL,P = 0.03),重要的是,它可逆转恶病质并抵消所有测量肌肉群的损失(P <0.0005)。
技术路线:
结果:
一 、激活素A促进肿瘤细胞分泌自噬促进因子
SQSTM1特异性地被自噬靶向,并且其随时间的依赖性下降(GFP下降/绿色荧光的丧失)是自噬活性的量度并且可以通过流式细胞术检测。自噬报告细胞对重组激活素A起反应,表现为SMAD3磷酸化增加(图1A)。激活素A在任何测试浓度下都没有加速自噬(图1A),意味着激活素A以与宿主细胞中的自噬无关的方式促成恶病质,或者激活素A仍然可以通过影响其他自噬诱导因子的丰度以间接方式加速体内自噬。TOV21G卵巢癌细胞分泌大量激活素A。激活素A通过1型和2型激活素受体启动信号传导,2型受体激活素A可以与ActRIIA和B结合。所有siRNA均有效降低其靶转录物水平(图1B),并维持mRNA水平的降低转染后至少3天。未观察到不同siRNA对细胞增殖或存活的影响。通过ELISA测量,INHBA siRNA将TOV21G分泌的激活素A蛋白减少约90%(从平均278至32pg / mL)(图1C)。转染后1天已经观察到大约40%的自噬通量降低,并且这种作用持续至少3天(图1D)。相比之下,自噬抑制剂3-甲基腺嘌呤或巴弗洛霉素A1(17h)分别将报告细胞中的自噬通量降低30%和40%(图S2)。结果表明,尽管激活素A可能不直接激活自噬,以自分泌或旁分泌方式促进其他自噬加速因子从细胞中分泌。
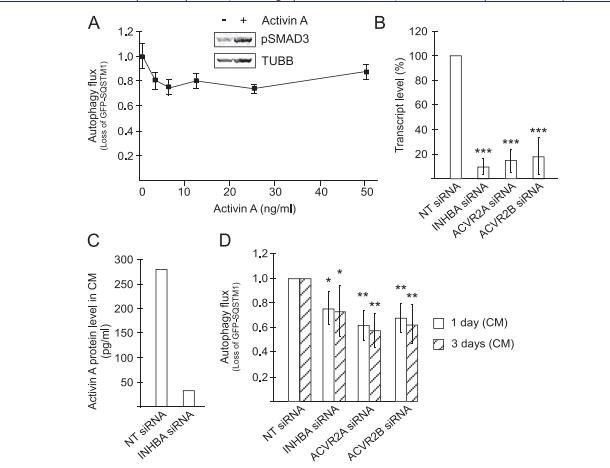
图1激活了自分泌或旁分泌环的作用,以促进从ToV21G细胞分泌自噬-加速化合物。
二、激活素A对于从癌细胞分泌自噬促进因子IL-6是重要的
用于KRAS的两种不同siRNA显示有效降低了KRAS转录物的水平(图2A),并且伴随着细胞中IL-6转录物水平的明显降低(图2B)。转染后1天CM中的IL-6蛋白从非靶向siRNA转染细胞的CM中平均23.5ng/mL降低约43%(图2C)。在TOV21G细胞中进行siRNA介导的INHBA或ACVR2A/ACVR2B的敲低。所有siRNA均导致CM中IL-6水平降低,如通过IL-6ELISA在第1天后测量的转染并通过bioplex测定确认,该效果在转染后维持至少3天(图3A)。激活素A中和抗体使CMs中IL-6的水平降低(图3B),ActRIIB诱导受体和ALK4/5/7抑制剂使CM中的IL-6水平分别降低(图3B)。SMAD3 siRNA有效降低了SMAD3转录物的水平,并显着降低了TOV21G细胞中IL-6的分泌(图3C和3D),显示涉及ALK4/5/7诱导的SMAD3的经典激活素A信号传导对诱导的IL-6分泌是重要的。靶向激活素A信号传导的所有siRNA均导致IL-6的mRNA水平降低,支持自分泌激活素A信号传导促进IL-6转录(图3E)。ALK4/5/7抑制或siRNA介导的SMAD3敲低降低了IL-6转录水平(图3F和3G)。用重组激活素A处理可以显着抵消INHBA siRNA对IL-6转录物水平的影响(图3E),证明IL-6转录的作用受自分泌激活素A信号传导的调节。使用siRNA的激活素信号传导的干扰导致pNF-κB水平的明显降低(p65),证明NF-κB与p38 MAPK协同诱导IL-6表达(图3H)。p38 MAPK是激活素A下游的信号传导介质之一,对激活素A信号传导的干扰降低了癌细胞中p38的磷酸化水平(图3I)。这些数据表明p38MAPK和NF-κB在激活素A诱导的IL-6产生中起作用。
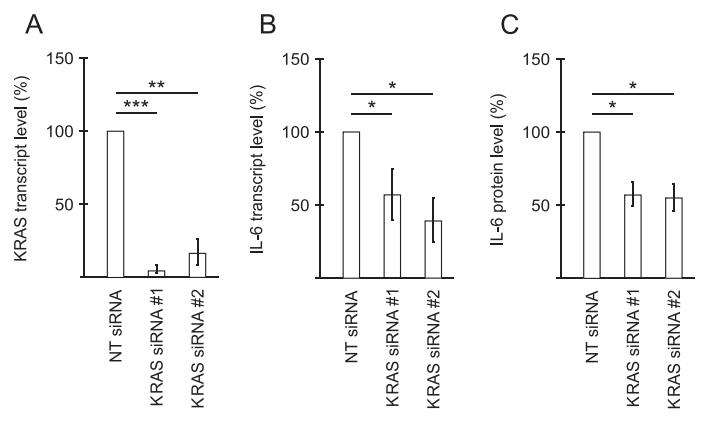
图2 KRAS影响TOV21G细胞自噬诱导细胞因子IL-6的分泌。
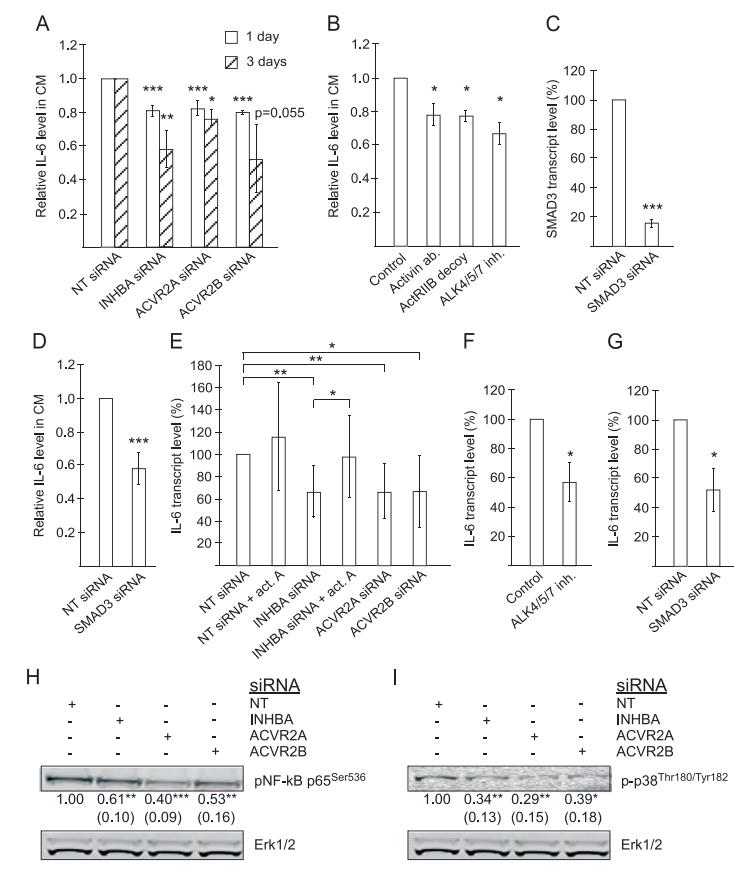
图 3 激活素A 影响 TOV21 G 细胞自噬诱导细胞因子 IL-6 的分泌。
三、干扰激活素A信号传导减少血清中肿瘤衍生的IL-6并逆转小鼠的恶病质
携带TOV21G肿瘤的小鼠迅速形成恶病质,明显表现为体重减轻,肌肉(胫骨肌,腓肠肌复合体,股四头肌和心脏)和白色脂肪组织(图4A-4I)。CDD866治疗明显逆转恶病质,小鼠体重增加,心脏和肌肉质量甚至达到超过非荷瘤小鼠的体重和肌肉质量的程度(图4A-4F)。CDD866治疗也导致肿瘤大小减小(图4G和4H),CDD866处理的小鼠减少了白色脂肪组织的损失,但并不显着(P = 0.06)(图4I)。携带TOV21G的小鼠具有增加的激活素A的血清水平,并且在CDD866处理后检测到血清激活素A的额外增加(图4J)。使用物种特异性ELISA发现携带肿瘤的小鼠的血清IL-6水平大量升高,这些血清IL-6来自癌细胞(人类IL-6)(图4K),宿主来源的鼠IL-6增加(图4L)。抑制ActRII导致携带肿瘤的小鼠血清中癌症来源的人IL-6显着减少(图4K)。尽管血清中小鼠IL-6水平增加,但用ActRII中和抗体治疗并未显着减少IL-6库(图4L)。总之,破坏肿瘤中的激活素A信号传导降低了肿瘤来源的IL-6的全身丰度并且与小鼠恶病质的逆转一致。
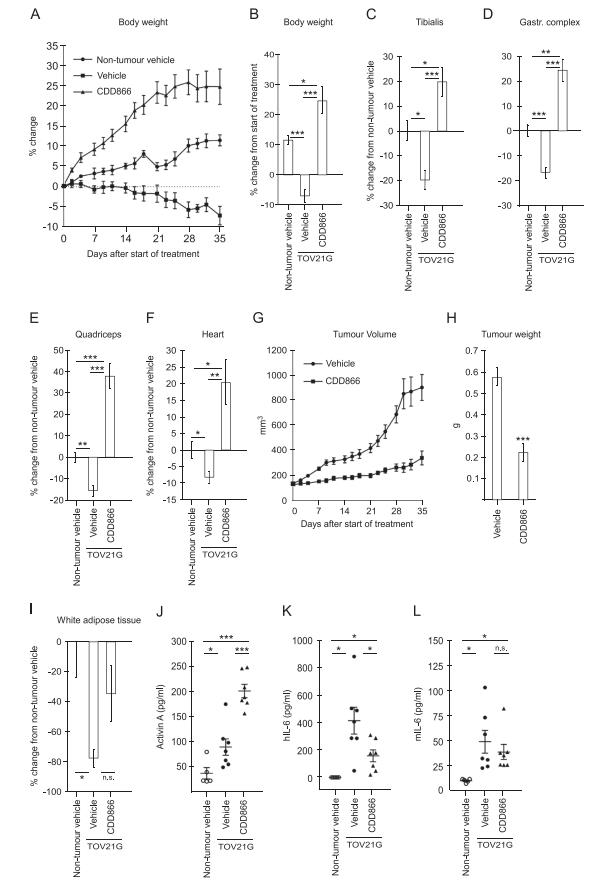
图4激活素A信号干扰降低血清中肿瘤源性IL-6,逆转小鼠恶病质。
四、人卵巢肿瘤中INHBA与IL-6基因表达的关系
发现体外和在TOV21G小鼠恶病质模型中释放IL-6需要激活素信号传导。通过使用cBioPortal网站评估来自卵巢癌患者(n = 307)的肿瘤活组织检查中编码IL-6和INHBA的转录物水平,研究了人卵巢癌患者中激活素A和IL-6之间可能的关联,结果显示这些基因的表达之间存在显着关联(图5),表明激活素A还可以调节人肿瘤中IL-6的表达。
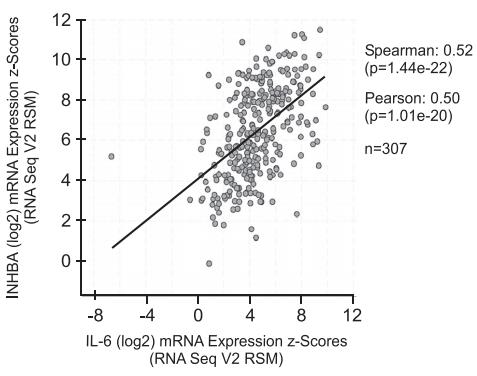
图 5 人卵巢肿瘤中 IN HBA 与 IL-6 基因表达的关系。
结论:
该研究证实了激活素A和IL-6信号传导途径之间的功能性联系,并表明干扰激活素A诱导的肿瘤IL-6分泌具有癌症诱导的恶病质的治疗潜力。






