癌症中的代谢和表观遗传学之间的联系
在过去十年中,在癌细胞代谢领域进行的研究揭示了代谢改变和癌症进展之间的新联系。众所周知,癌细胞在肿瘤发生和转移的过程中会改变其代谢结构,从而表现出严格调控的代谢可塑性程序。值得注意的是,某些代谢改变发生在表观遗传水平,从而使表观遗传学和代谢高度交织在一起。
在这里,我们讨论了癌症细胞代谢的最新发现,阐明了维持癌症生长所需的主要合成代谢、分解代谢和能量需求,以及代谢改变对表观遗传学的影响。

1. 癌症代谢
1.1有氧糖酵解
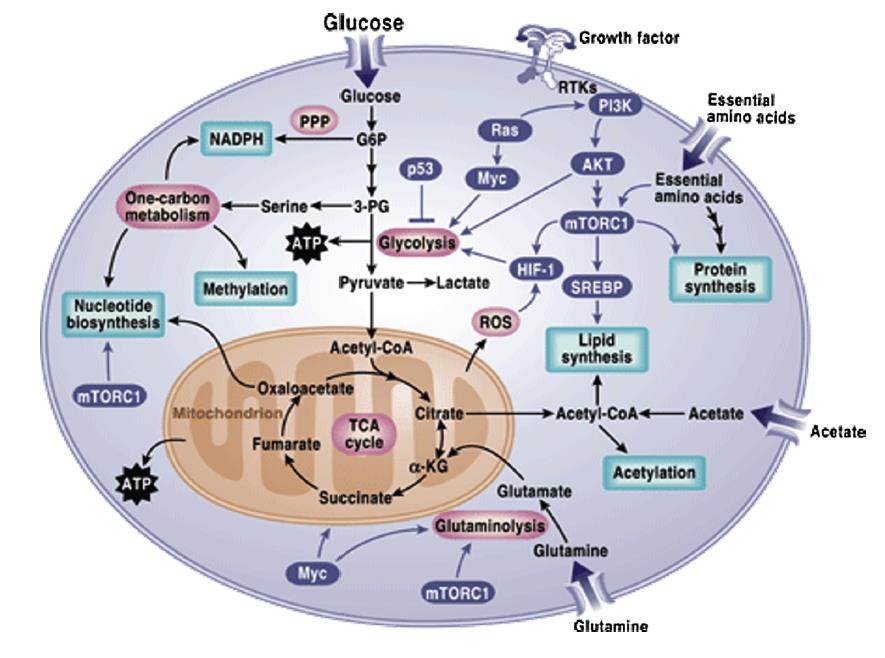
糖酵解是将葡萄糖转化为PEP的代谢途径。1920年,Otto Heinrich Warburg观察到,即使在富含氧气的情况下,癌细胞的糖酵解也会增强。众所周知,糖酵解在厌氧条件下通常会增加,糖酵解在癌细胞中的增加是一个相当新的现象,被称为有氧糖酵解或瓦氏效应。因此,葡萄糖分解代谢为乳酸的高速率代表了在癌细胞中观察到的最普遍的代谢表型,同时导致乳酸副产品在肿瘤微环境中积累。在癌细胞中,瓦氏效应并不是一个产生能量的途径,而是一种产生糖酵解和生物合成中间体的模式,并作为许多其他合成代谢过程的前体,重新合成碳水化合物、核酸、蛋白质和脂肪,从而促进癌细胞的生存和生长。
1.2戊糖磷酸途径
与糖酵解平行的代谢途径是戊糖磷酸途径。它是一种合成代谢途径,产生NADPH,5-碳糖,即戊糖和核糖5-磷酸。这一途径对于帮助癌细胞满足其合成代谢的需求,并在氧化和营养胁迫下存活是至关重要的。
1.3 PI3K通路
PI3K通路的激活在肿瘤细胞中经常被发现。PI3K的激活进一步导致AKT的激活,AKT是一种促生存激酶。AKT被认为是葡萄糖摄取的主要调控因子,通过糖酵解和PPP促进葡萄糖代谢。此外,它在癌细胞中驱动Warburg效应,从而使葡萄糖进入糖酵解途径。
1.4 氧化还原平衡
细胞代谢也产生一些有毒的副产品。其中ROS增加时对蛋白质、脂类和核苷酸具有明显的损伤作用。癌细胞采用了一种独特的机制来解毒ROS,即谷胱甘肽氧化还原作用与NADPH还原氧化作用。值得注意的是,NADPH水平升高是癌细胞的一个共同特征,这有助于它们对抗过多的ROS,并通过支持合成代谢途径帮助它们存活。
1.5 谷氨酰胺
谷氨酰胺是癌细胞中利用最迅速的氨基酸。体外实验表明,在培养基中,癌细胞的存活需要较高水平的谷氨酰胺。谷氨酰胺能够提供乙酰辅酶a作为支持肿瘤细胞生长的大分子生物合成的前体。研究发现,含有激活RAS基因突变的细胞对谷氨酰胺的吸收增加导致产生谷胱甘肽,以应对氧化应激。图1总结了调控癌症代谢的信号级联。
2. 癌症中代谢和表观遗传学的相互作用
2.1表观遗传学和癌症代谢
已知癌症代谢至少通过三种不同的细胞机制影响细胞的表观遗传结构。首先是代谢途径的重新编程。这种重新编程导致代谢产物水平的改变。某些代谢物是表观遗传修饰关键酶的重要辅助因子或底物。第二种机制与代谢酶转移到细胞核产生代谢物有关。最后,是调节几种强效表观遗传酶活性的代谢产物的产生。
众所周知,基因表达的表观遗传调控发生在DNA、组蛋白和RNA水平。在此背景下,DNA甲基化、组蛋白甲基化、乙酰化、泛素化、磷酸化和基因沉默已被很好地表征。异常的DNA甲基化与多种人类癌症的病理基因表达有关。全局DNA低甲基化和位点特异性CpG启动子高甲基化是癌症中最常见的表观遗传学改变。
2.2 DNA/组蛋白甲基化的代谢控制
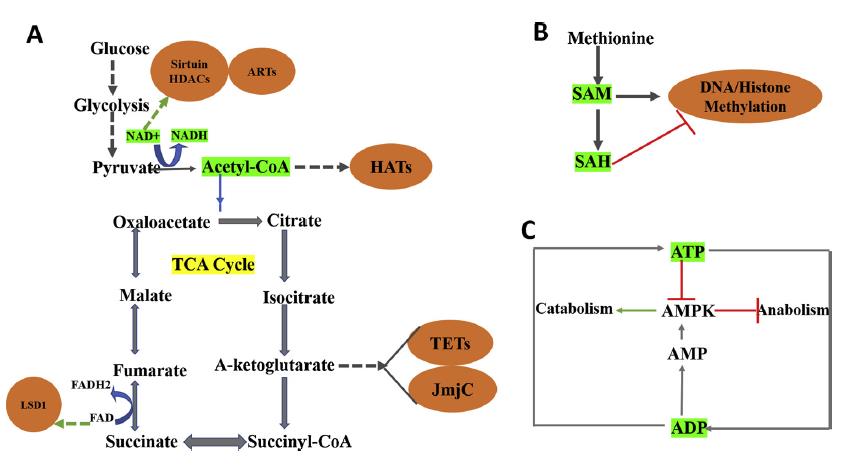
由蛋氨酸和ATP合成的s -腺苷蛋氨酸(SAM)是哺乳动物中普遍存在的甲基供体。DNA的甲基化是由使用SAM作为甲基供体的DNA甲基转移酶(DNMT)介导的。组蛋白的甲基化也需要SAM,当甲基化发生在赖氨酸或精氨酸残基时,反应由组蛋白甲基转移酶(HMT)催化。因此,SAM的丰度或有效性直接影响DNA和组蛋白的甲基化状态。
相反,DNA和组蛋白去甲基化酶的去甲基化活性会引起DNA和组蛋白甲基化事件的逆转。组蛋白去甲基酶分为两组:赖氨酸特异性去甲基酶家族和含有Jmjc的家族蛋白,均为黄素腺嘌呤二核苷酸依赖的氧化酶。JmjC家族去甲基酶是一种亚铁离子依赖的氧合酶,使用a-酮戊二酸酯(aKG)作为酶激活的辅助因子。值得注意的是,催化辅助因子FAD和αKG由TCA代谢途径生成。同样,DNA 去甲基化酶TET家族蛋白的激活也需要FAD和aKG。相比之下,其他TCA循环代谢物,包括琥珀酸和富马酸,则作为JmjC家族去甲基酶的拮抗剂。因此线粒体中的TCA代谢途径可以直接参与基因组的表观遗传调控。
组蛋白乙酰化是另一种重要的表观遗传机制,它参与了DNA复制、损伤等染色质依赖过程修复,转录激活,细胞周期和基因调控。两类酶参与组蛋白乙酰化的动态调控,分别是组蛋白乙酰转移酶(HAT)和组蛋白去乙酰化酶(HDAC)。乙酰辅酶a是通过氧化磷酸化和辅助合成代谢过程产生能量的关键代谢产物之一。有趣的是,乙酰辅酶a作为HATs的底物,HATs将乙酰辅酶a的乙酰基转移到组蛋白的赖氨酸残基上。这种反应主要与转录激活有关,对癌细胞等快速增殖细胞至关重要。因此,细胞乙酰辅酶a水平的变化密切影响HAT介导的组蛋白乙酰化。
同样地,组蛋白乙酰化的逆转是由一组称为HDACs的酶进行的。他们从组蛋白赖氨酸残基上除去乙酰基。这导致组蛋白紧密包裹DNA,因此功能与帽子相反。细胞内乙酰化水平归因于HAT和HDAC活性之间的精细平衡。不同的细胞代谢物拮抗HDACs的活性。其中butyrate是一种强效拮抗剂,可抑制HDACs I、II和IV的活性。butyrate是由菌落细菌产生的,菌落细菌主要发酵膳食纤维。肿瘤的代谢,如糖酵解增加乳酸的产生,有助于肿瘤微环境中局部酸性pH值的生成。已知这种情况可促进组蛋白去乙酰化。有趣的是,这种情况有利于癌细胞的侵袭性、前转移表型。此外,低组蛋白乙酰化水平与癌症患者较差的预后相关。另一种代谢物NAD+作为HDAC III介导的组蛋白去乙酰化反应的催化辅因子。总结的概念如图2所示。
2.3癌症代谢酶的遗传和表观遗传改变
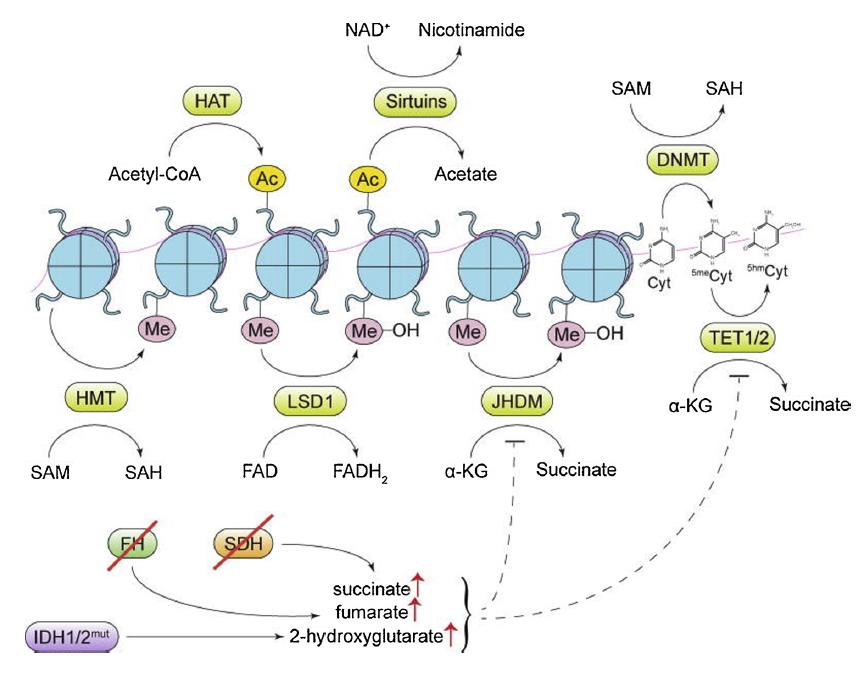
几项研究表明,代谢酶的突变使细胞发生肿瘤。这些突变促进了癌代谢物的产生,最终影响DNA和组蛋白的表观遗传学调控。NADP+依赖的异柠檬酸脱氢酶(IDH1和IDH2)、琥珀酸脱氢酶(SDH)和延胡索酸水合酶(FH)突变频繁。这些代谢酶的失活突变导致2-羟基戊二酸盐、琥珀酸盐和富马酸盐分别堆积。这些突变具有致癌性质,琥珀酸和富马酸都抑制TET和Jmj-C家族蛋白的酶活性。携带IDH1/IDH2突变的癌细胞表现出DNA和组蛋白的高甲基化。胶质瘤和血癌经常在IDH1和IDH2中表现出致癌突变。烟酰胺n -甲基转移酶(NNMT)是另一种代谢酶,催化甲基部分从SAM转移到烟酰胺,从而将SAM分解代谢为1-甲基烟酰胺(1MNA),在多种癌症中异常表达,与增强迁移和侵袭行为有关。过度表达NNMT的癌细胞表现出SAM和组蛋白甲基化水平的改变,同时获得了更具侵略性的表型。NNMT催化的反应阻碍了SAM介导的DNA和组蛋白甲基化过程。整个过程如图3所示。
除了基因突变外,表观遗传事件也有助于癌症代谢酶的改变。这种代谢酶的例子包括己糖激酶亚型2 (HK2)和果糖-1,6-双磷酸酶(FBP1)。启动子低甲基化等表观遗传事件是胶质母细胞瘤和肝癌中HK2上调的原因。启动子甲基化导致胃癌、肝癌和结肠癌组织中FBP1的沉默。虽然增加HK2水平有助于增强糖酵解通量,但在癌细胞中糖异生受FBP1调控。
3. 靶向代谢治疗癌症
近年来,癌症药物发现领域的进展集中在癌细胞利用的几种有效代谢途径的抑制剂上。抑制某些关键代谢酶的活性具有很大的潜力。以糖酵解、线粒体代谢、谷氨酸代谢和自噬等与癌细胞存活和进展有关的代谢途径为靶点,为新药物发现提供了有效的策略。






