小小细胞神通大-间充质干细胞
作为一种多能干细胞,间充质干细胞(MSCs)具有自我更新和多向分化的能力,临床应用广泛。今天,小编就和大家分享一篇发表在The Journal of Clinical Investigation的文章,见识下小小细胞的神通。

思维路线:

结果:
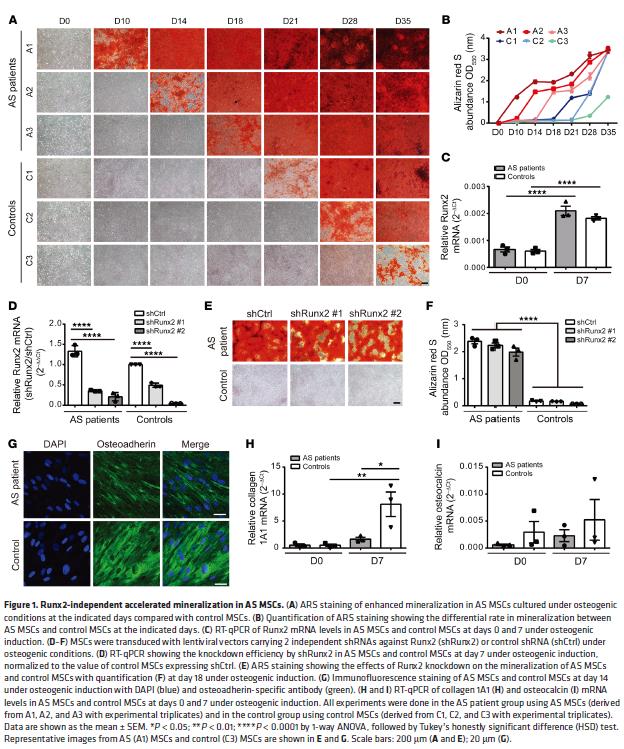
1. 来自于肌腱末端病的 AS (强直性脊柱炎)MSCs表现出独立于Runt相关的转录因子2的矿化加速作用
MSC具有自我更新并分化为多个间充质谱系包括成骨细胞,脂肪细胞和软骨细胞的能力。建立来自3名有肌腱末端病的AS患者MSC细胞(AS MSC)的离体培养模型,钙沉积和磷酸盐染色结果显示有增加的矿化率。Wnt 和BMP通路均未加速矿化,尽管Runx2表达在AS和对照组MSC之间无差别。敲低Runx2不影响矿化。成骨诱导后,Runx2下游成骨细胞标志物C在AS MS的表达不高。独立于Runx2的矿化加速作用可能有助于AS的病理表型。
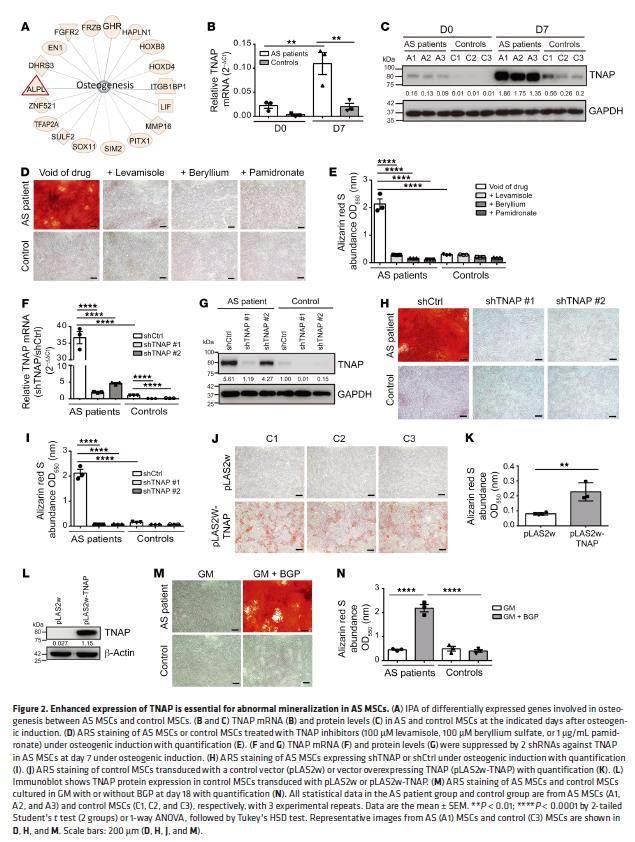
2.TNAP的表达增强对于AS MSC中异常矿化至关重要
分析成骨诱导第0、3和7天时两组的基因表达,建立骨生成途径中的基因网络,发现组织非特异性碱性磷酸酶(TNAP)表达和碱性磷酸酶(ALP)活性的升高与AS MSC中加速的矿化密切相关。TNAP抑制剂可有效阻断AS MSC中加速的矿化,当TNAP的表达被沉默时观察到现象,TNAP过表达增强矿化。
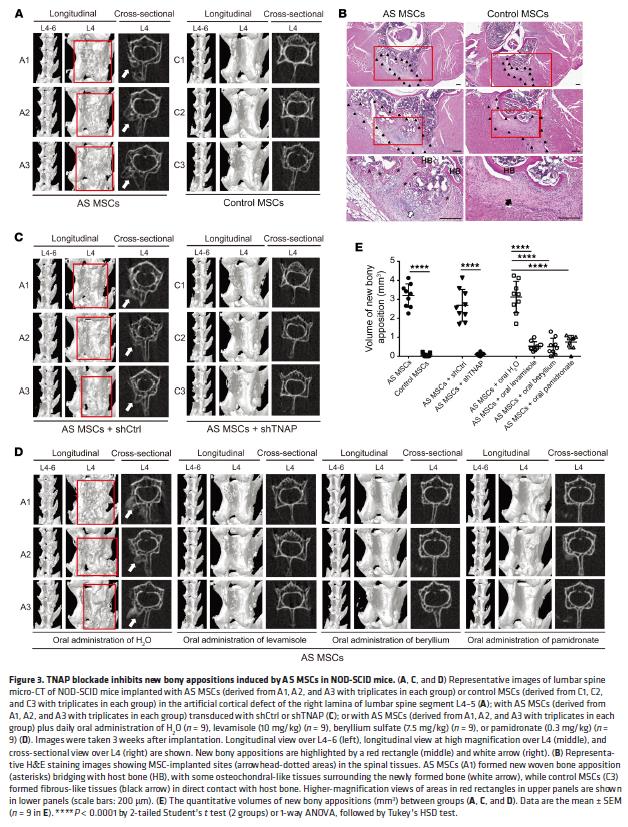
3. 阻滞TNAP抑制了NOD-SCID小鼠中AS MSC所诱导的新骨形成
建立了一个基于AS MSC的体内疾病模型模仿病理性骨质形成,用于检测TNAP抑制剂的治疗潜力。NOD-SCID小鼠植入AS MSC有新骨形成,间充质干细胞与宿主骨形成骨样桥接,TNAP沉默时这种效应被阻断,口服TNAP抑制剂也有此现象。
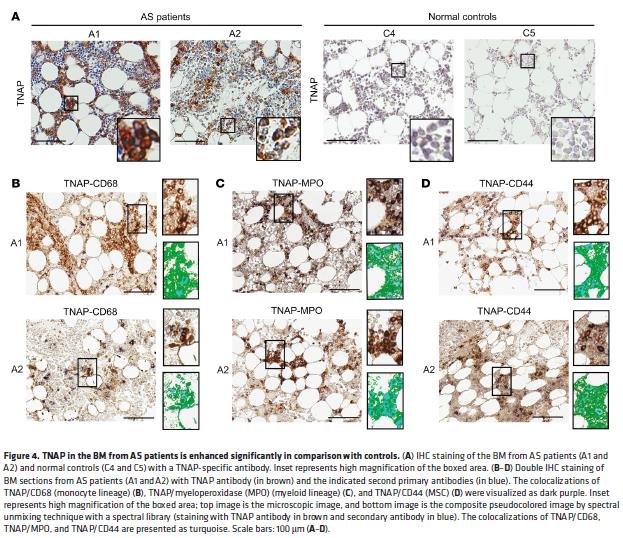
4. AS患者BMSC和血清中的TNAP明显升高,血清骨特异性TNAP水平与AS患者的放射学严重程度相关
AS患者的BMSC中TNAP表达增加,大多数TNAP阳性细胞是单核细胞(CD68 +)或骨髓(髓过氧化物酶阳性)谱系,或是MSCs(CD44 +)。AS患者的血清骨特异性TNAP(BAP)高于健康对照组,BAP水平和放射严重程度存在正相关。血清BAP水平可能是预后的生物标志物
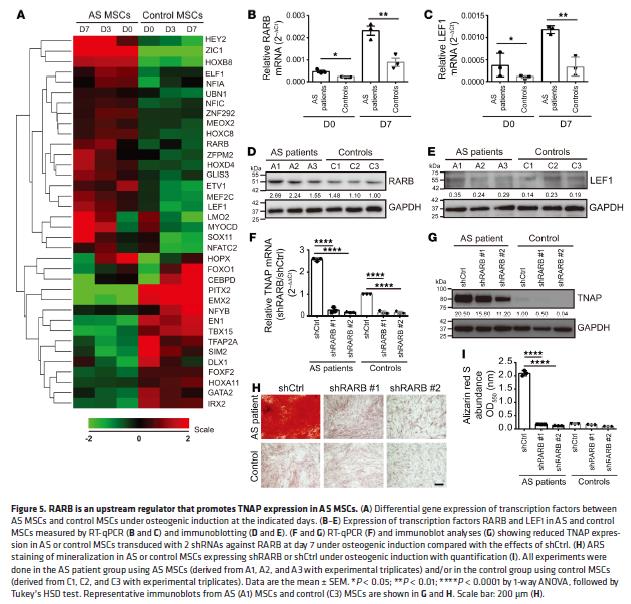
5.转录因子RARB的上调促进了AS MSC中TNAP的表达
分析上调MSC中TNAP的调控机制,使用转录类别分析了微阵列数据,发现36个差异表达基因,只有(RARB)在成骨诱导下AS MSCs中的表达增加。在MSCs中敲除RARB后,TNAP表达和ALP活性降低。RARB敲除可抑制AS MSCs中增强的矿化作用。
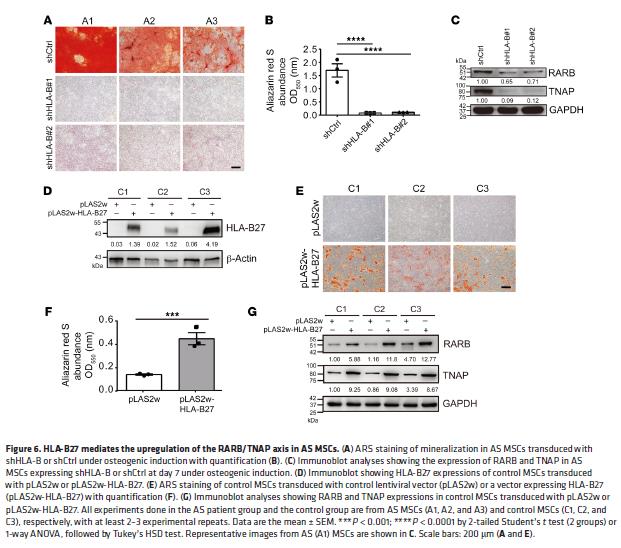
6.HLA-B27介导AS MSC中 RARB / TNAP轴的上调
敲除AS MSC中的HLA-B抑制增强的矿化,伴随着RARB和TNAP的表达减少。HLA-B27过表达诱导矿化作用增强,增加RARB和TNAP水平。
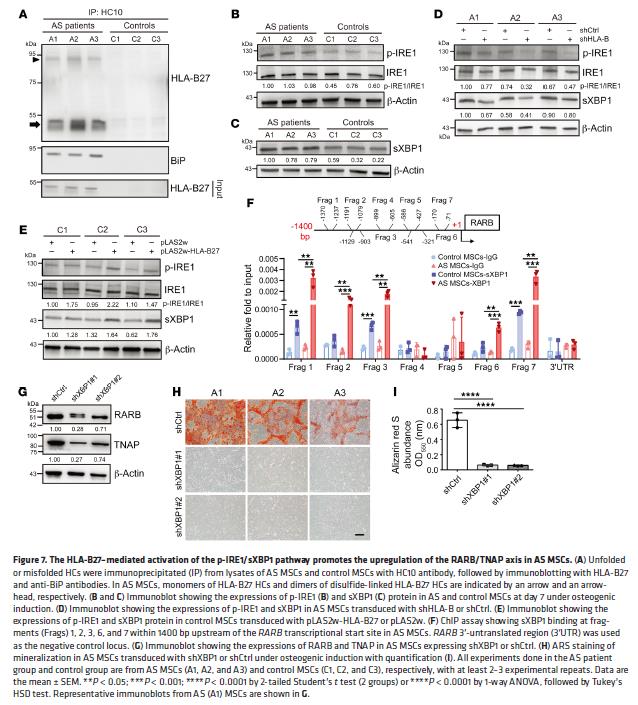
7.HLA-B27介导的p-IRE1 / sXBP1途径的激活上调AS MSC中的RARB / TNAP轴
检测HLA-B27错折叠和UPR途径是否参与AS MSC中RARB / TNAP轴的上调。AS MSC中有二硫键连接的HLA-B27 HC二聚体(错折叠)和HLA-B27 HC单体(未折叠)。HC10反应性与UPR相关,在AS MSC中观察到升高的ATF4和sXBP1表达。由于ATF4是PERK的下游目标,AS MSCs的矿化作用增强不受PERK抑制剂的影响。磷酸化的IRE1(p-IRE1)催化从未剪接的XBP1(uXBP1)mRNA中去除内含子,从而在XBP1编码序列中移码为更具转录活性的sXBP1。与对照组相比,AS MSC中p-IRE1 / sXBP1的表达升高,在HLA-B敲低后表达降低,HLA-B27过表达则增强表达。这些数据表明,p-IRE1 / sXBP1轴是HLA-B27的下游靶点。ChIP分析进一步揭示XBP1与RARB启动子结合,敲除XBP1降低了RARB / TNAP的表达,废除了AS MSC的矿化作用。
总结:AS MSC中的p-IRE1 / sXBP1 / RARB /TNAP途径的激活在脊柱强直中发挥重要作用。






