缺氧胶质瘤细胞分泌的外泌体miR-301a的作用机制
最近的证据表明,miRNAs可以被释放到细胞外微环境中,并通过外泌体介导细胞与细胞之间的通讯。今天小编带大家了解近期发表于Molecular therapy上的一篇关于缺氧胶质瘤细胞分泌的外泌体miR-301a通过靶向TCEAL7激活Wnt/β-catenin信号并促进放疗抵抗的文章。本研究的目的是鉴定参与胶质母细胞瘤(GBM)抗放疗的外泌体miR-301a(exo-miR-301a),并揭示其可能的机制。

技术路线:

结果:
1.exo-miR-301a由缺氧GBM细胞特异性表达和分泌
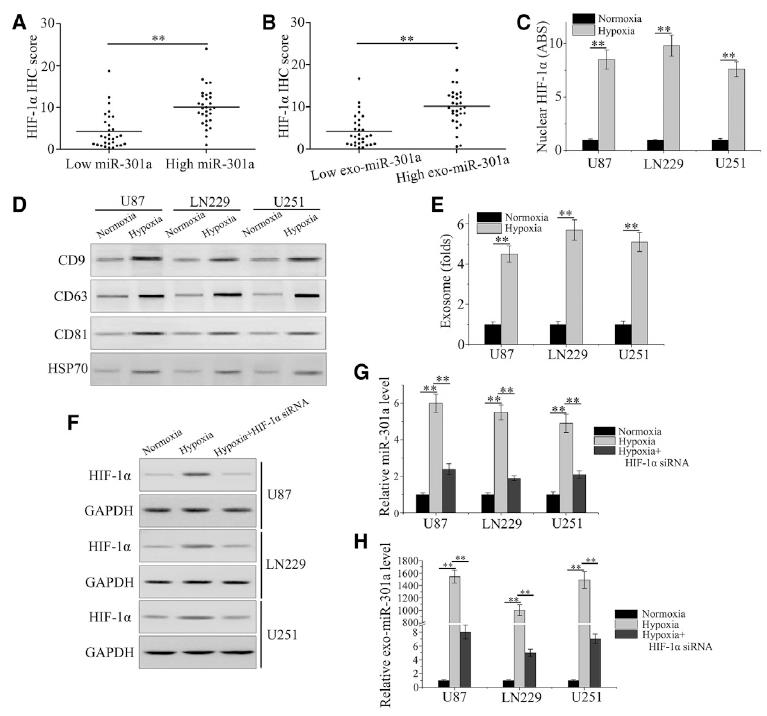
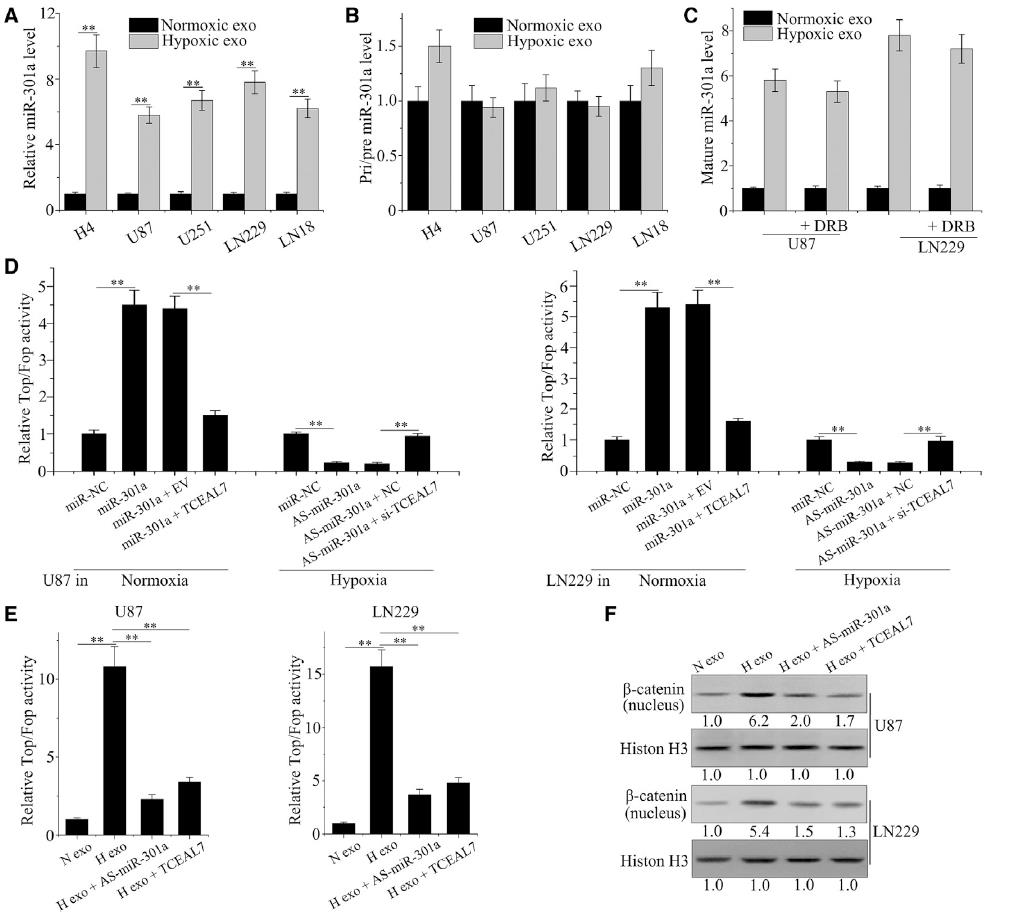
根据我们之前的观察,miR-301a在胶质瘤组织中显著上调。在此,我们检测exo-miR-301a在缺氧人GBM中的功能。HIF-1α表达作为缺氧生物标志物,与miR-301a在胶质瘤患者中的表达进行比较。HIF-1α水平高的患者miR-301a表达水平较高(图1A),血清exo-miR-301a的百分比根据HIF-1α免疫组化评分分布(图1B)。ELISA结果显示,GBM细胞对缺氧的反应是通过增加细胞核中HIF-1α的水平(图1C)。从正常或缺氧条件下暴露的GBM细胞中检测含有CD9、CD63、CD81和HSP70的外泌体标记物。如图1D所示,缺氧细胞中所有外泌体标记物的水平均高于常氧细胞。低氧条件也显著增加了外泌体中存在的囊泡数量,这可以通过纳米颗粒跟踪分析检测到(图1E)。为了探讨miR-301a表达增加与HIF-1α之间的关系,我们观察了miR-301a和exo-miR-301a在HIF-1α不同状态下的水平。缺氧诱导HIF-1α, siRNA干扰后降低(图1F)。缺氧显著增加了miR-301a和exo-miR-301a的表达;同时,HIF-1α的下调显著降低了miR-301a和exo-miR-301a的表达(图1G和1H)。综上所述,我们证明exo-miR-301a是由缺氧GBM细胞特异性分泌的,与HIF-1α状态有关。
2.来自缺氧胶质瘤细胞的exo-miR-301a直接作用于常氧胶质瘤细胞中的TCEAL7
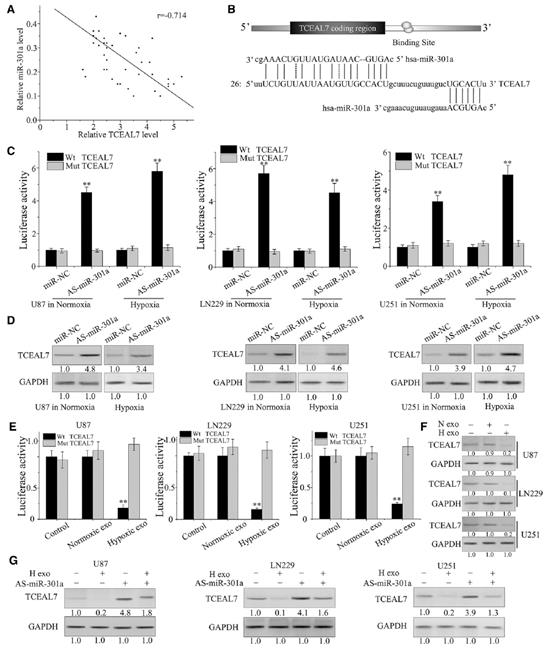
为了探讨miR-301a在TCEAL7调控中的作用,我们检测了exo-miR-301a与TCEAL7蛋白在胶质瘤患者中的关系。TCEAL7水平与miR-301a的表达水平呈负相关(图2A)。为了证实miR-301a与TCEAL7的直接结合,设计荧光素酶报告实验,利用含有野生型(WT)和突变体(MT)的荧光素酶报告质粒TCEAL7 3’UTRs与miR-301a结合位点进行。TCEAL7 3‘UTR包含miR-301a的两个高度保守的靶位点,第一个靶位点被证明是结合位点(图2B)。如图2C所示,与TCEAL7- 3’UTR突变组相比,miR-301a在常氧和缺氧条件下均显著干扰了转染luc -TCEAL7-UTR的细胞的荧光素酶活性。与荧光素酶报告实验结果一致,在常氧和缺氧条件下,转染As-miR-301a导致TCEAL7表达显著下降(图2D)。此外,我们还检测了正常培养的GBM细胞中TCEAL7的表达。与对照组和常氧外泌体组相比,缺氧外泌体处理降低了荧光素酶活性(图2E)。此外,与正常组和对照组相比,缺氧外泌体处理显著改变了TCEAL7蛋白水平(图2F)。通过转染As-miR-301a,可以阻止缺氧衍生的外泌体对TCEAL7下调的影响(图2G)。
3.TCEAL7在胶质瘤恶性肿瘤中经常下调
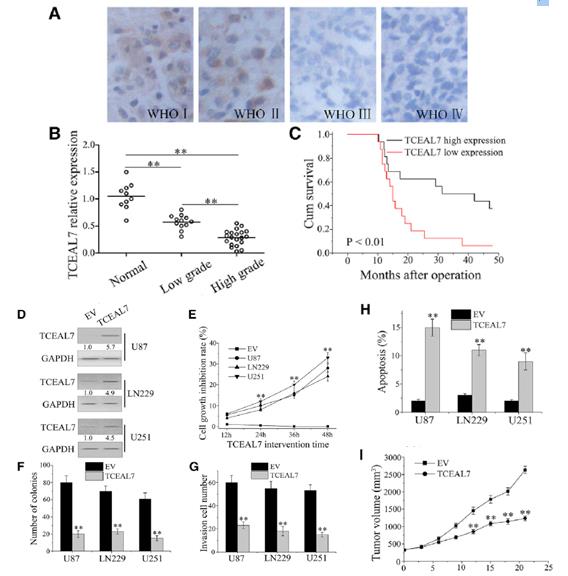
在相似的组织中检测到TCEAL7蛋白水平,并随着恶性肿瘤程度的增加而下调(图3A)。采用qPCR技术分析TCEAL7在胶质瘤及正常脑组织中的表达。如图3B所示,TCEAL7在胶质瘤组织中的表达低于正常组织,且随着病理分级的升高而降低。生存分析显示TCEAL7高表达患者的生存率明显高于TCEAL7低表达患者(图3 C)。与对照组相比,在TCEAL7载体组中TCEAL7蛋白水平显著升高(图3D)。 MTT结果显示,经TCEAL7处理的细胞存活率低于阴性对照组细胞(图3E)。克隆实验表明,转染TCEAL7载体的细胞在软琼脂上形成的菌落明显少于对照组(图3F)。此外,上调TCEAL7表达可显著降低GBM细胞侵袭能力(图3G)。采用Annexin V/propidium iodide(PI)双染色,TCEAL7载体中凋亡细胞比例显著增加(图3H)。接下来,我们建立了皮下肿瘤U87细胞株,如图3I所示,两组在肿瘤大小的前9天无明显差异;然而,从第10天开始,与对照组相比,TCEAL7载体组的异种移植瘤的大小明显减小。
4.TCEAL7通过与β-catenin结合负调控Wnt/β-catenin转录通路,而不抑制β-catenin的稳定性
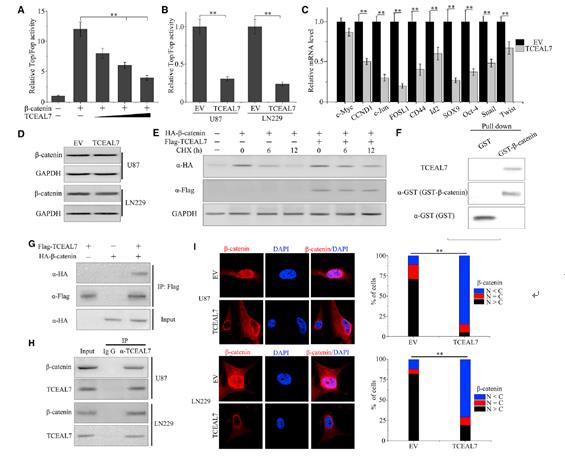
为了研究TCEAL7与Wnt/ β-catenin信号通路之间的相互作用,我们首先研究了TCEAL7过表达对H4细胞中β-catenin/T细胞因子(TCF)转录活性的影响。β-catenin的加入显著增强了TOP FLASH活性。然而,TCEAL7的过表达抑制了β-catenin刺激的TOP FLASH报告基因的活性(图4A)。另外,通过TOP/FOP reporter构建的高级别胶质瘤细胞U87和LN229中检测到,TCEAL7的高表达显著抑制了Wnt/β-catenin活性(图4B)。然后我们检测TCEAL7是否调控wnt靶向基因的表达。结果表明,在TCEAL7过表达细胞中,wnt靶向基因的表达水平显著降低(图4C)。但过表达TCEAL7并没有抑制β-catenin蛋白水平(图4D)。为了进一步研究TCEAL7过表达对β-catenin稳定性的影响,我们进行了环己酰亚胺追踪实验。结果显示过表达TCEAL7的细胞与对照细胞相比,β-catenin没有显著变化(图4E)。为了深入了解TCEAL7抑制表面TCF活性的机制,我们研究了TCEAL7是否与β-catenin发生物理作用。结果表明纯化后的TCEAL7与GST-β-catenin共沉淀,但不单独与GST共沉淀(图4F)。此外,HA-β-catenin与FLAG-TCEAL7共沉淀(图4G)。内源性β-catenin与内源性TCEAL7共沉淀,在U87和LN229细胞中形成复合物(图4H)。最后,当我们增加TCEAL7在胶质瘤细胞中的表达时,我们检测了β-catenin的核易位。免疫荧光图4I显示,与空白对照相比,TCEAL7过表达阻断了β-catenin从细胞质向细胞核的易位。
5.从缺氧胶质瘤细胞中提取的exo-miR-301a转移到正常胶质瘤细胞中,通过靶向TCEAL7增加Wnt/ β-catenin信号的活性
为了证实缺氧胶质瘤细胞分泌的miR-301a可以通过外泌体转移到正常细胞中,我们测量了不同胶质瘤细胞经正常或缺氧处理后分泌的外泌体miR-301a水平。在源自受体缺氧细胞的外泌体中,成熟miR-301a的细胞水平升高(图5A),但未观察到pri-或pre-miR-301a在外泌体摄取方面的变化(图5B)。此外,经外泌体处理的细胞中miR-301a的水平没有受到RNA聚合酶II抑制剂的显著影响(图5C)。我们研究了Wnt/β-catenin的转录活性,以阐明TCEAL7参与exo-miR-301a介导的Wnt/β-catenin信号通路。图5D和图5E显示,miR-301a模拟转染和缺氧胶质瘤细胞源性外泌体暴露显著增加了Wnt/β-catenin信号的表达和转录活性。相反,高水平的TCEAL7降低了miR-301a模拟物或暴露于缺氧外泌体诱导的Wnt/β-catenin活性。同样,在缺氧细胞中抑制TCEAL7可以消除As-miR-301a在TOP-FOP检测中的作用。此外,As-miR-301a和TCEAL7载体挽救了缺氧细胞来源的外泌体对Wnt/β-catenin活性的影响(图5F)。
6.miR-301a参与缺氧外泌体共培养胶质瘤细胞的放射敏化
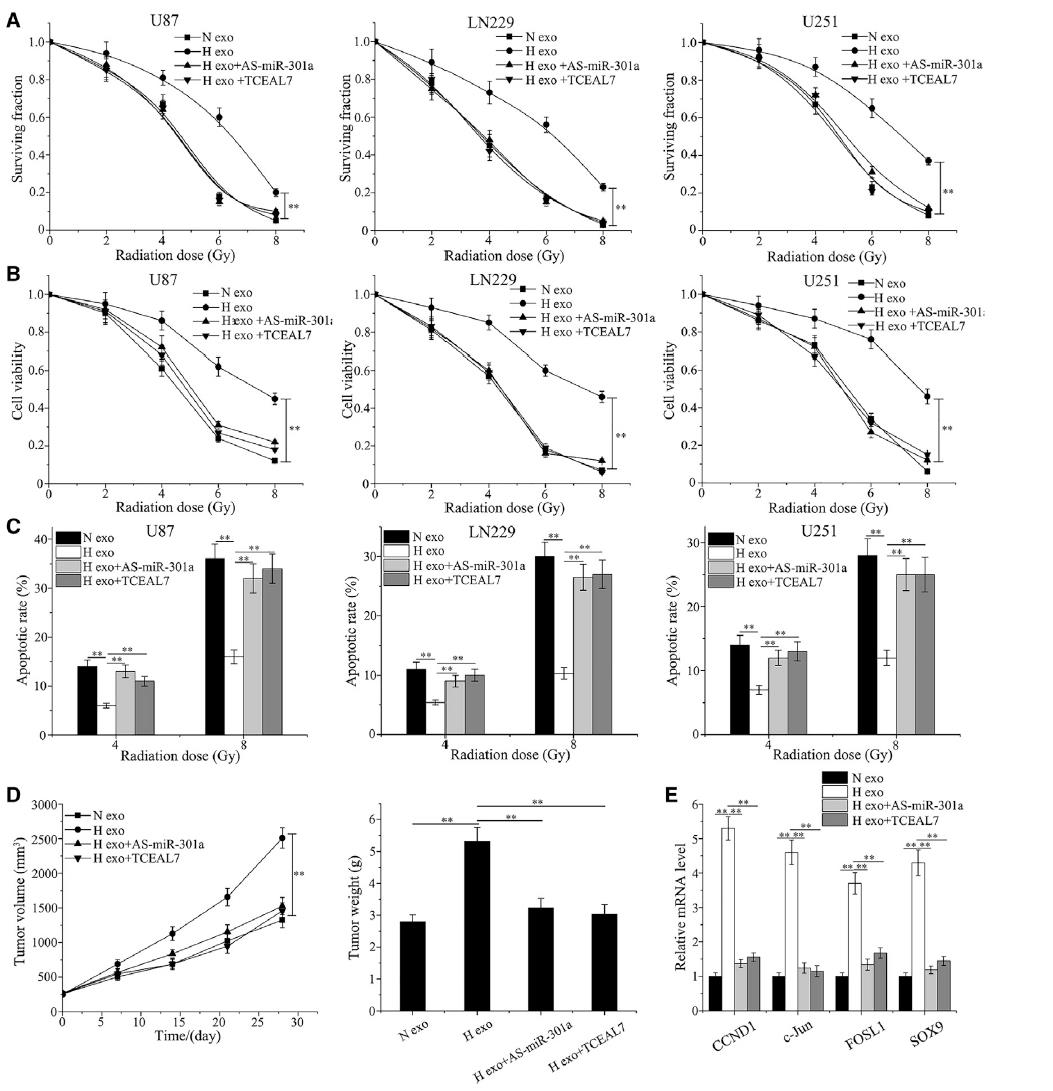
为了探讨缺氧的exo-miR-301a水平是否介导胶质瘤细胞的放射敏化,我们检测了细胞辐照后的生存能力。结果表明,缺氧外泌体组与常氧细胞相比,在辐射诱导的存活率方面无明显下降,且表现出抗辐射能力。此外,miR-301a下调或TCEAL7升高显著增加细胞对辐射的敏感性(图6A)。此外,与常氧外泌体组相比,缺氧外泌体组在细胞活力方面不能被进一步抑制;然而,当转染As-miR-301a或TCEAL7载体时,情况发生了逆转(图6B)。我们进一步研究了miR-301a对辐照后细胞凋亡的影响。结果表明常氧外泌体培养组被4-或8-Gy照射诱导的凋亡细胞比例明显高于缺氧外泌体组,另外伴有As- miR -301a或TCEAL7载体时,凋亡能力得到恢复(图6C )。为了便于体外实验,利用U87胶质瘤细胞系建立皮下肿瘤,进一步评估miR-301a在低氧胶质瘤耐辐射中的作用。在异种移植瘤生长试验中,与对照组相比,缺氧外泌体组中辐射不能显著降低肿瘤生长,体外检测分析显示,As-miR-301a或TCEAL7载体增强了肿瘤抑制作用(图6D)。然后进行qPCR检测受Wnt/β-catenin通路转录调控的mRNA水平。Wnt/β-catenin下游基因在缺氧外泌体条件下被激活;然而,As-miR-301a或TCEAL7可以显著抑制过表达(图6E)。
总结:
exo-miR-301a是缺氧胶质瘤细胞特征性表达和分泌的,是Wnt/β-catenin的一个强有力的调节剂,然后通过靶向抑癌基因TCEAL7降低放疗敏感性。这可能为GBM患者的细胞耐肿瘤治疗放疗提供一个新的靶点。






