CPX诱导细胞死亡和保护性自噬
结直肠癌(CRC)是世界范围内最常见的癌症之一。Ciclopirox olamine (ciclopirox olamine,CPX)最近被确认为有希望的抗癌候选药物,但其具体的作用机制还未得到进一步的研究和解释。近日,一篇名为为“CPX Targeting DJ-1 Triggers ROS-induced Cell Deat and Protective Autophagy in Colorectal Cancer”的文章在杂志《Theranostics》上发表,该文章旨在研究CPX在结直肠癌中的作用,为下调DJ-1作为CPX抗癌活性的重要机制提供了实验基础,并为靶向细胞保护性自噬作为潜在的化疗策略提供了证据。
摘要:
方法:体外和体内检测CPX对CRC细胞的潜在细胞毒性。在对照和CPX处理的CRC细胞之间测定整体基因表达模式、ROS水平、线粒体功能、自噬、凋亡等。
结果:发现CPX在体外和体内都通过抑制增殖和诱导凋亡来抑制CRC的生长。CPX的抗癌作用与下调DJ-1有关,过表达DJ-1可逆转CPX对CRC细胞的细胞毒性。DJ-1的缺失导致线粒体功能障碍和ROS积累,从而导致CRC生长抑制。细胞保护性自噬同时被激活,从药理或基因上阻断自噬可以进一步增强CPX的抗癌效果。
结论:研究表明,DJ-1丢失诱导的ROS积累在CPX介导的CRC抑制中起关键作用,为通过调节补偿性保护性自噬来治疗CRC提供了进一步的理解。
技术路线:

结果:
一、CPX 抑制CRC增殖并诱导其凋亡
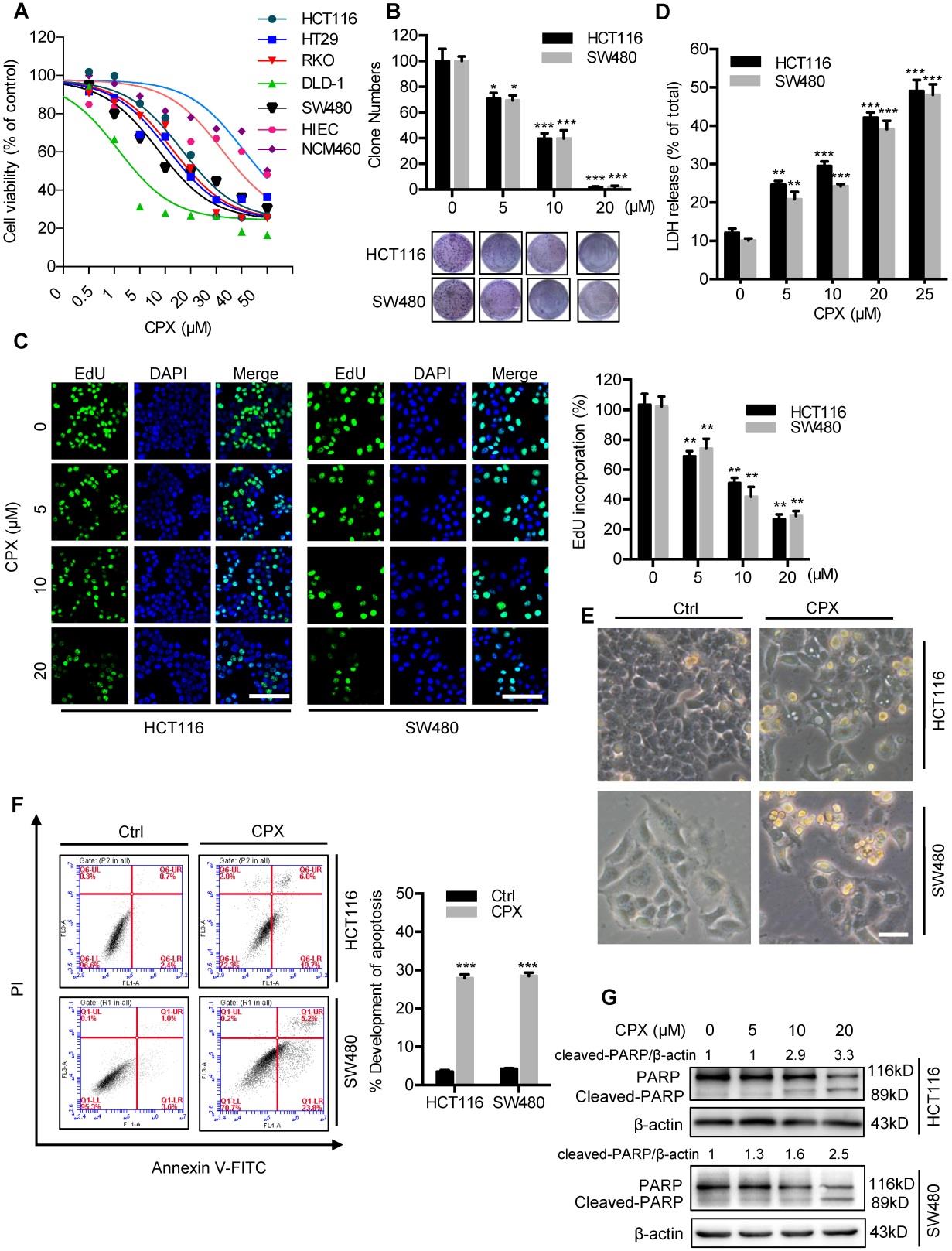
为了验证CPX是否对CRC具有抗肿瘤作用,采用CCK8试验评估不同种人类CRC细胞系在CPX治疗下的细胞存活率。
图1A:HCT116,DLD-1,RKO,HT29,SW480,HIEC和NCM460细胞用指定浓度的CPX处理24小时,用CCK8试剂盒测定细胞活力。图1B:克隆形成实验分析细胞增殖率。HCT116和SW480细胞用所指示浓度的CPX处理24小时,处理后将细胞接种于6孔板中2周,并计数集落数量。图1C:用所指示浓度的CPX处理CRC细胞24小时后,进行EDU测定。对EDU掺入进行定量。图1D:HCT116和SW480细胞在指示浓度CPX作用24小时后脱氢酶(LDH)释放的分析。
结论:CPX通过诱导细胞凋亡发挥抗肿瘤活性。
为了评估凋亡是否参与了CPX诱导的CRC细胞毒性,检测CRC细胞的形态学变化。
图1E:CPX处理与否HCT116和SW480细胞24小时后的形态学变化。图1F:用20μMCPX处理HCT116和SW480细胞24h,固定,Annexin V/PI染色,流式细胞仪分析。对细胞凋亡率进行定量分析。图1G:HCT116和SW480细胞的PARP免疫印迹分析。
结论:CPX在体外CRC细胞中表现出显著的抗肿瘤作用。
二、CPX诱导的DJ-1下调参与CPX的抗CRC作用
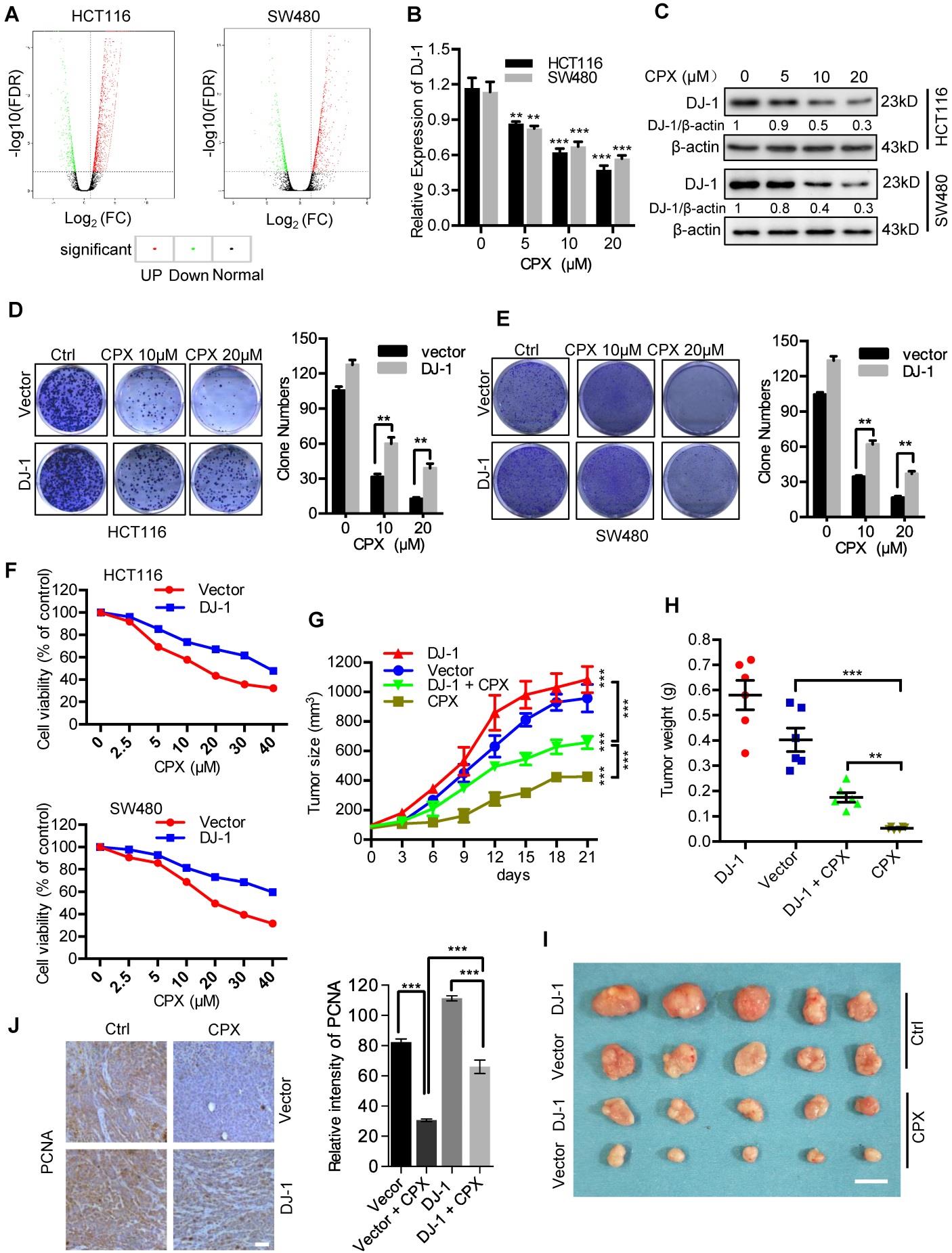
为了阐明CPX诱导CRC抑制的分子机制,确定了CPX处理细胞的整体基因表达模式,并使用RNA-seq将其与对照进行了比较。
图2A:CPX为变量处理24小时的HCT116和SW480细胞中DEGS的火山图分析。红色区域表示显着过度表达,绿色区域表示显着下调。图2B:对CPX为变量处理24小时的HCT116和SW480细胞进行定量逆转录聚合酶链反应,检测DJ-1mRNA的表达。图2C:免疫印迹分析DJ-1在CRC细胞中的表达,指示浓度的CPX为变量处理24小时。
为了研究CPX诱导的DJ-1下调是否参与CRC抑制,评估了在CPX处理下稳定过表达DJ-1的CRC细胞的细胞存活率和增殖。
图2D&E:稳定高表达DJ-1及CPX指示浓度处理的载体的CRC细胞集落形成实验。图2F:用CCK8试剂盒测定细胞活力。图2G-J:将稳定高表达DJ-1和Vector的HCT116细胞接种于裸鼠皮下(n=6)。在指定时间点监测肿瘤体积(G),并在euthanasia后测量肿瘤重量(H)。(I)经载体或CPX(25 mg/kg/天)处理的小鼠产生的独立肿瘤的图像。(J)PCNA免疫组织化学染色的代表性图像和PCNA染色相对强度在异种移植物中的定量。
结论:CPX诱导的DJ-1下调参与了CPX的抗CRC作用。
三、DJ-1下调诱导的ROS是CPX抗CRC作用的机制之一
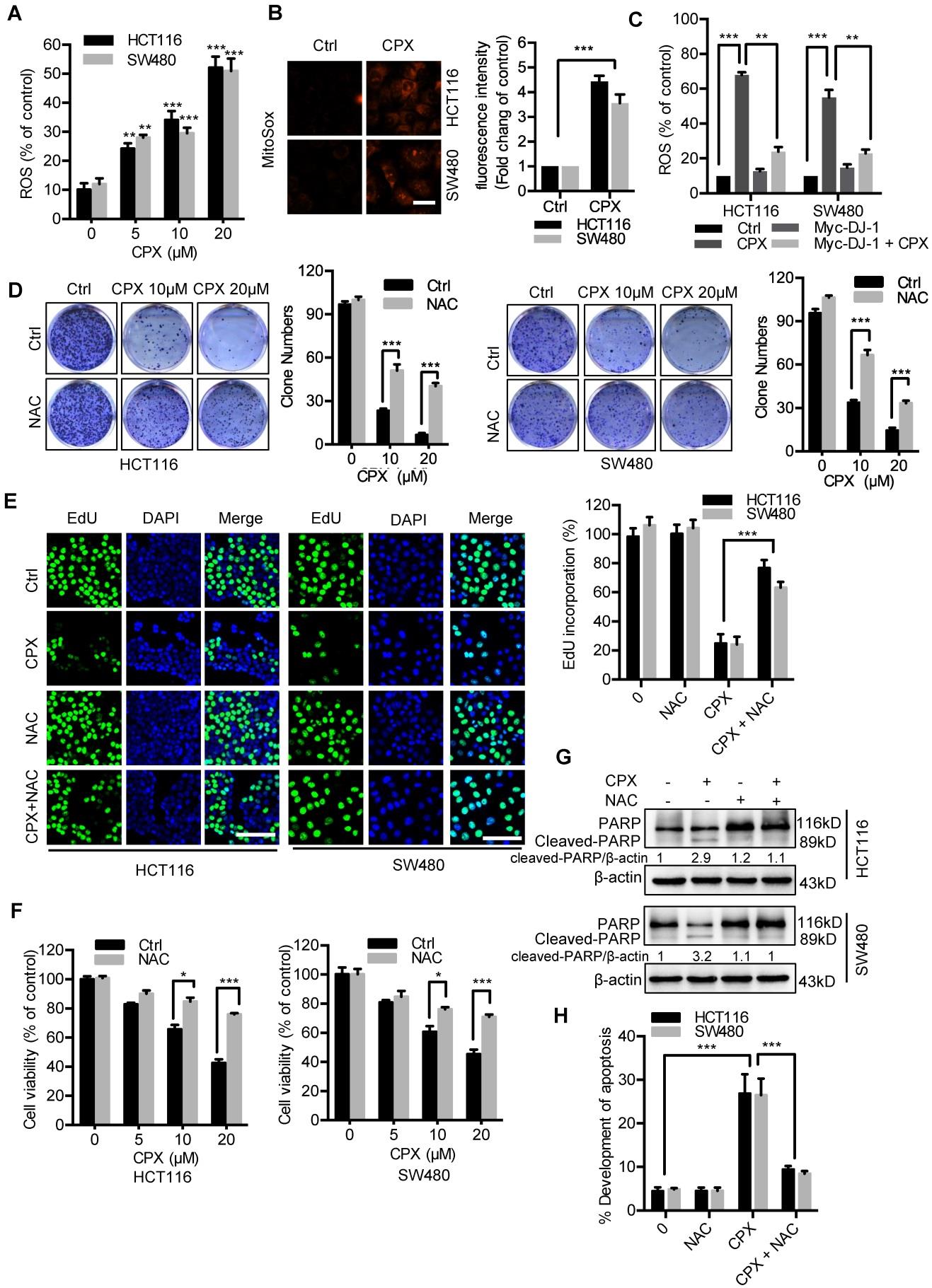
先前的研究表明,降低DJ-1会导致抗氧化反应受损,检测CPX诱导的DJ-1下调是否可以增加细胞ROS水平。
图3A:通过荧光微板读取器(Thermo Science)分析DCFH-DA染色显示用指示浓度CPX处理的CRC细胞中的ROS水平。图3B:用MITOSOX Red测定CPX处理后线粒体ROS水平。图3C:用流式细胞术检测20μMCPX处理24小时为变量,过表达Myc-DJ-1和Vector的大肠癌细胞的ROS水平。图3D:5 mM NAC为变量的情况下,用指示浓度的CPX处理CRC细胞的菌落形成试验。图3E:在20μM CPX处理24小时为变量的情况下,用或不用5 mM NAC处理的大肠癌细胞的EDU测定。对EDU掺入进行定量。图3F:CCK8比色法测定5mM NAC为变量的情况下,用所指示浓度的CPX处理CRC细胞24小时后的细胞存活率。图3G:CPX(20μM)、载体、、NAC(5 MM)处理的HCT116和SW480细胞中PARP表达的免疫印迹分析。图3H:固定CPX(20μM)、载体、NAC(5 MM)处理的HCT116和SW480细胞,Annexin V/PI染色,然后用流式细胞仪分析。对细胞凋亡的发展进行定量。
结论:CPX下调DJ-1并诱导细胞ROS积累,从而促进凋亡细胞死亡。此外,NAC的处理还降低了CPX的促凋亡效应,如Annexin V/PI染色和裂解的PARP水平(图3G和3H)所证明的。
四、CPX诱导CRC细胞线粒体功能障碍促进ROS积累
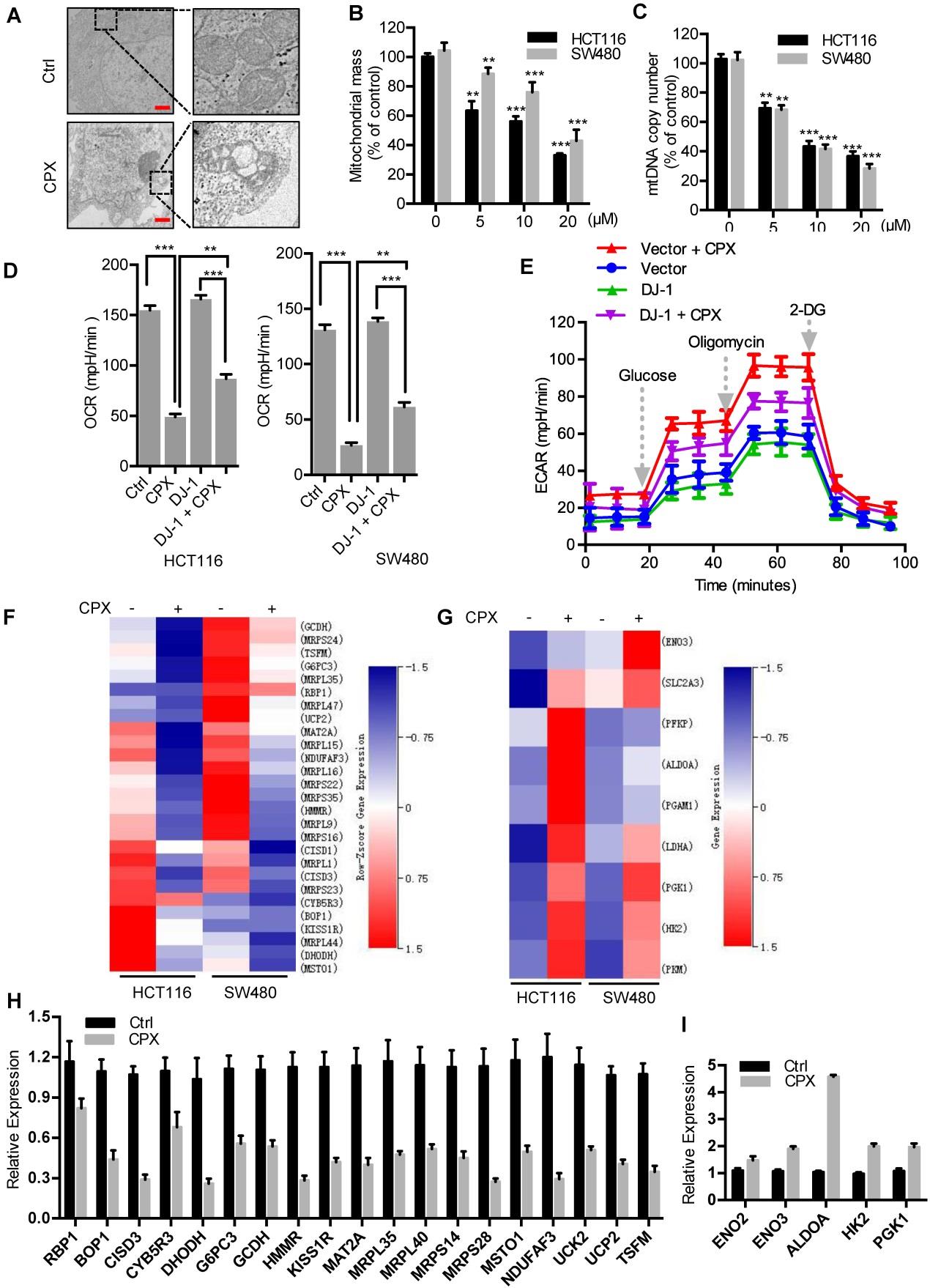
在上述研究发现,CPX诱导ROS积累。
如图3B所示,线粒体(ROS产生的主要来源)在CPX处理的CRC细胞中产生更多的超氧化物。为了评估CPX是否在CRC细胞中诱导线粒体改变,检查线粒体的形态、数量和功能。图4A:20μM CPX为变量处理的HCT116细胞的透射电镜图像。图4B:通过荧光微板仪(Thermo science),用MITOTracker Green分析经20μM CPX为变量处理24小时的大肠癌细胞线粒体量与线粒体膜电位变化的关系。图4C:用qRT-PCR检测20μM CPX为变量处理24小时后HCT116和SW480细胞的线粒体DNA拷贝数。图4D:用空载体或Myc-DJ-1质粒转染大肠癌细胞24小时,以20μM CPX为变量处理24小时,然后接种于平板12小时后进行OCR分析。基础OCR在含10 mM葡萄糖,1 mMNa-Pyruvate和2 mM谷氨酰胺的XF Base培养基中进行分析(pH调节至7.40±0.05,37℃)(n=3)。图4E:将10 mM葡萄糖、1μM寡霉素和50mM 2-脱氧葡萄糖(2-DG)注射于如(D)处理的HCT116细胞(n=3)后,在含有2 mM谷氨酰胺的XF Base培养基中进行糖酵解应激试验(37℃时pH调节为7.40±0.05)。图4F&G:热图显示20μM cpx处理后参与氧化磷酸化(F)和糖酵解评估(G)的基因的归一化强度值,P值<0.0 5。图4H&I:qRT-PCR分析20μM CPX处理后HCT116细胞氧化磷酸化(H)和糖酵解(I)相关基因的表达。
结论:CPX诱导线粒体功能障碍以促进ROS在CRC细胞中的积累。
接下来研究了DJ-1在ROS产生和线粒体功能中的作用。
图4D:在CPX治疗后,DJ-1的过表达部分恢复了CPX诱导的OCR抑制。图4E:在CPX治疗后,DJ-1的过表达减弱CPX诱导的ECAR升高。
结论:DJ-1在CPX诱导的线粒体功能障碍中起重要作用。
五、CPX诱导CRC细胞自噬
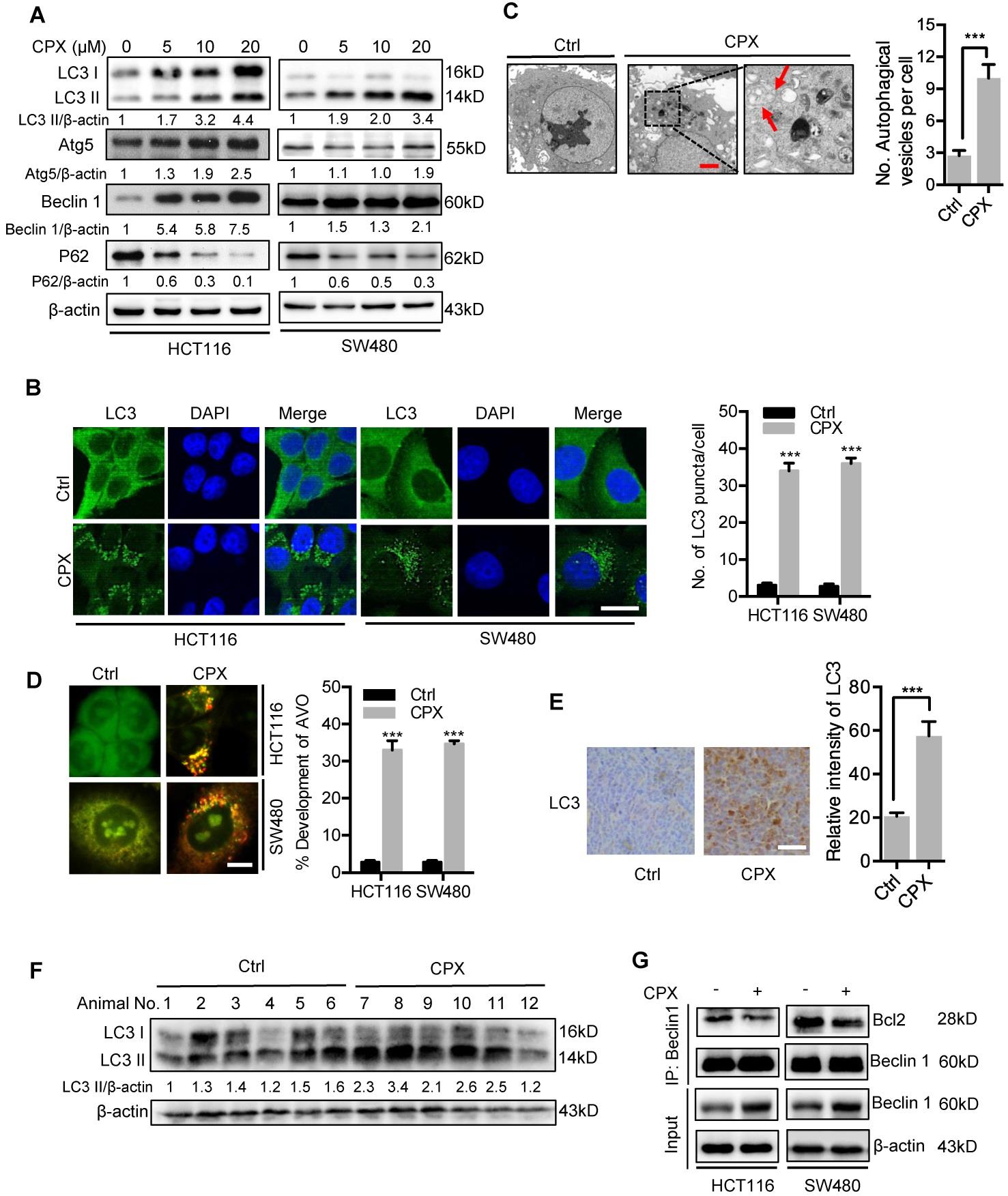
药理学调节自噬在癌症治疗中有巨大的潜在应用。因此,研究CRC细胞中的自噬是否受CPX的调节,首先检查了CPX处理的CRC细胞中自噬相关基因的蛋白质水平。
图5A:用指示浓度的CPX处理CRC细胞24小时后, LC3,ATG5,Beclin1和p62表达的免疫印迹分析。图5B:20μM CPX为变量处理细胞24小时,通过免疫荧光分析显示和定量内源性LC3点的形成。图5C:用透射电子显微镜在如(B)中所示处理的HCT116细胞中检测自噬小泡。图5D:左侧,通过吖啶橙染色测定如(B)中所示处理的细胞自噬情况。右,每个细胞酸性囊泡细胞器(AVO)的总数。图5E:来自载体或CPX处理的小鼠的HCT116异种移植物中LC3表达的IHC分析的代表性图像。图5F:用免疫印迹法检测用载体或CPX处理的小鼠HCT116异种移植物中LC3的蛋白表达水平。
检测了两种自噬相关蛋白ATG5和Beclin 1的表达水平,以验证CPX是否促进自噬小泡的形成。
如图5A所示,CPX以剂量依赖的方式增强ATG5和Beclin 1的表达。此外,已有报道Beclin 1与Bcl-2相互作用的减弱是自噬启动过程中的关键事件。图5G:免疫共沉淀分析20μM CPX为变量处理24小时的大肠癌细胞中Beclin1和Bcl2之间的相互作用。
结论:CPX在体外和体内都能诱导CRC细胞自噬。
六、CPX促进CRC细胞自噬通量
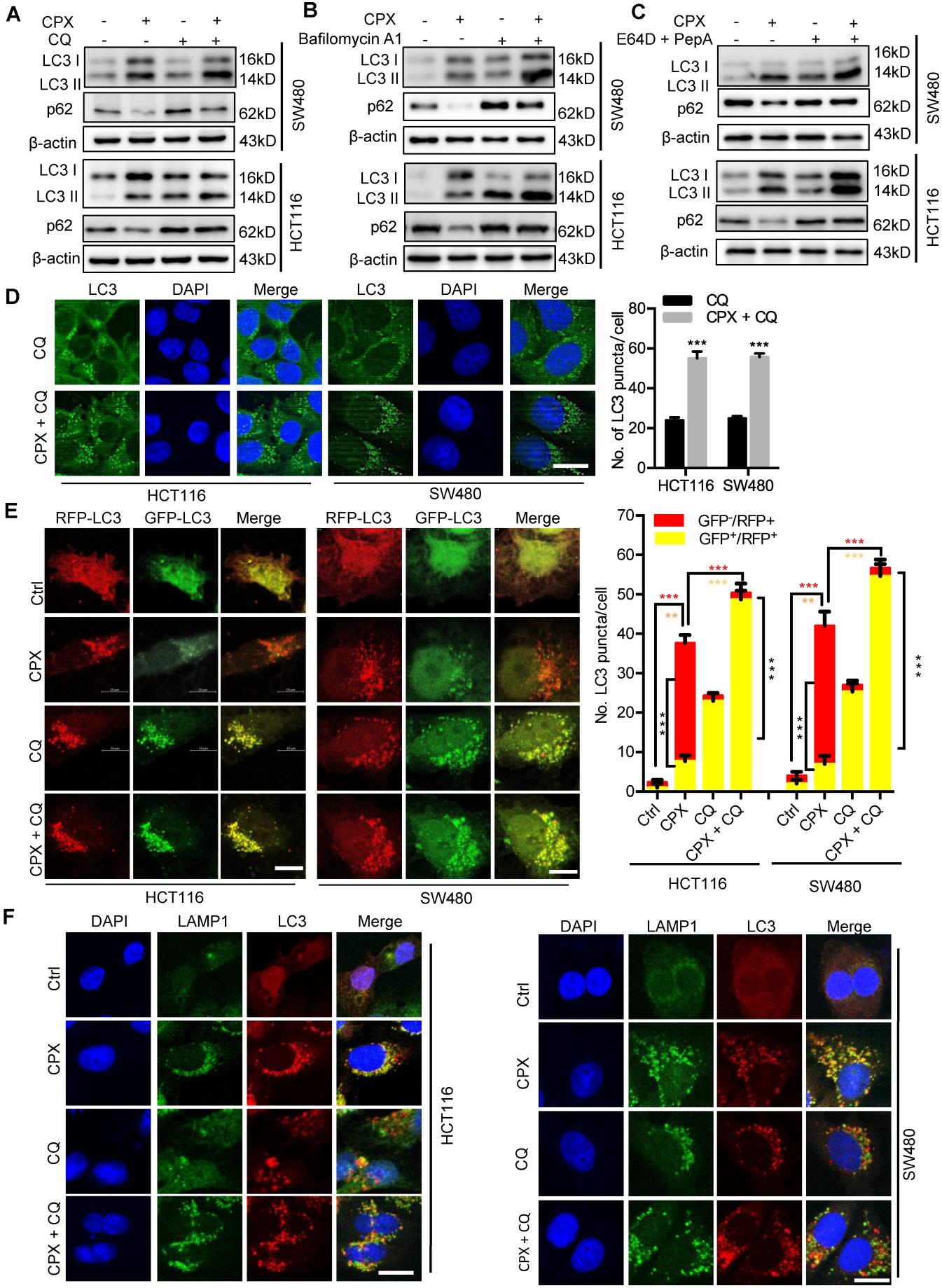
为了确定CPX是否诱导完全自噬通量,检测自噬底物p62的蛋白质水平。
如图5A所示, CPX处理细胞中p62水平降低,同时LC3-II水平增加,这意味着诱导了完全自噬通量。图6A:用载体、CPX(20μM)、CQ(10μM)或联合作用24小时。免疫印迹法检测LC3和p62的表达。图6B:用CPX(20μM)、Baf A1(100 NM)处理CRC24小时。免疫印迹法检测LC3和p62的表达。图6C:用E64D(10μg/ml)和PepA(10μg/ml)在CPX(20μM)为变量的情况下处理CRC24小时。免疫印迹法检测LC3和p62的表达。图6D:用免疫荧光分析CQ(10μM)、Cpx(20μM)处理24小时后细胞的LC3点积聚情况。对LC3点的数量进行定量。图6E:瞬时转染串联 mRFP-GFP标记的LC3并用载体、CPX(20μM)、CQ(10μM)或联合处理24小时的细胞的免疫荧光分析。定量表示自溶酶体(GFP-/RFP+)的红色斑点与表示自噬小体(GFP+/RFP+)的黄色斑点的比率。图6F:免疫荧光分析内源性LC3和LAMP1在经载体、CPX(20μM)、CQ(10μM)或联合处理24小时后在CRC中的共定位。
结论:CPX在CRC细胞中诱导了完全自噬通量。
七、抑制自噬增强CPX的抗CRC作用
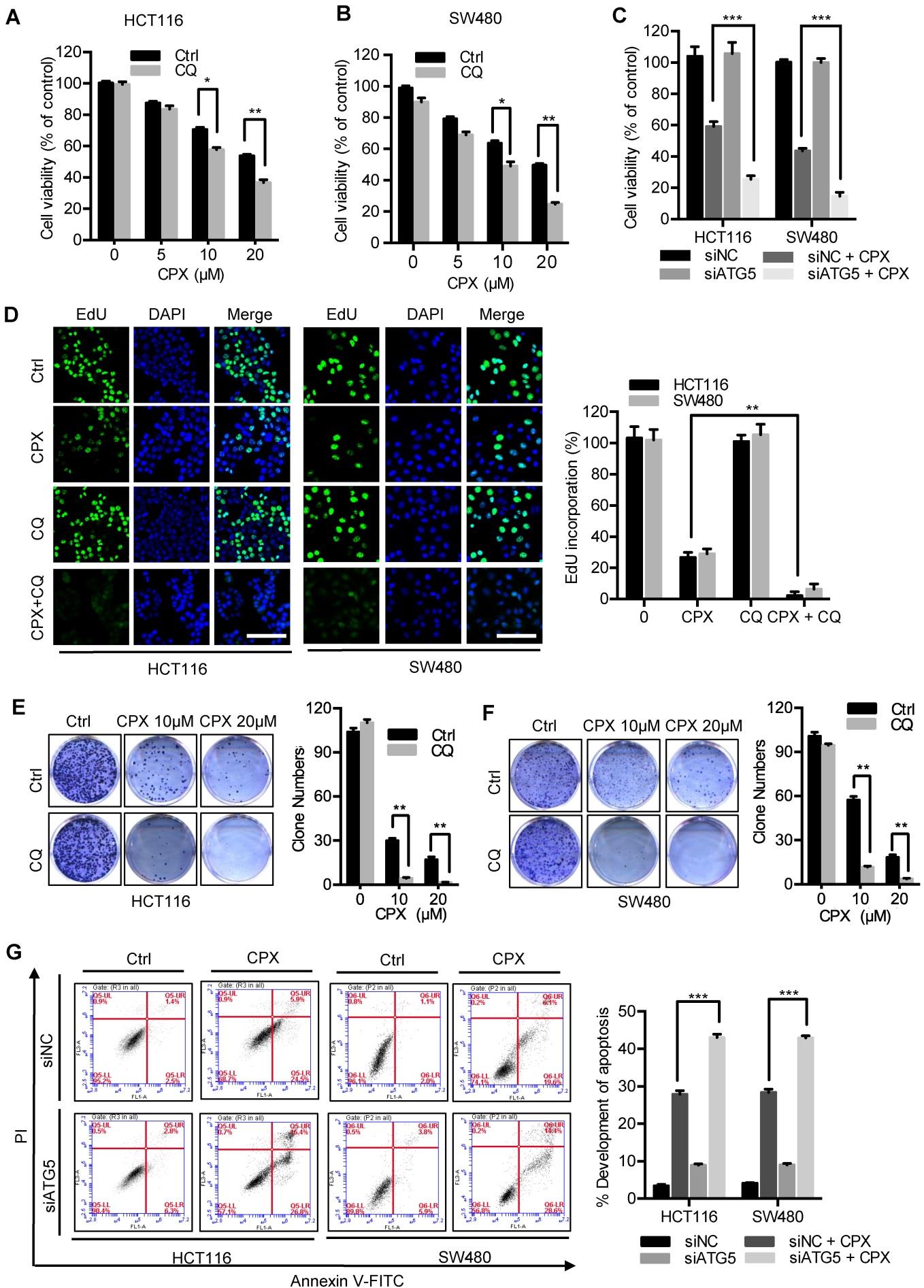
为了评估自噬是否参与了CPX的抗CRC作用,用CPX和自噬抑制剂CQ联合处理CRC细胞。
图7A&B:以10μM CQ为变量,用CCK8比色法检测指示浓度的CPX处理CRC24小时后的细胞存活率。图7C:用CCK8比色法检测转染siNC或siATG5 24小时后再以20μM CPX为变量处理24小时的CRC细胞的细胞存活率。图7D:20μMCPX、10μM CQ处理24h后的大肠癌细胞的EDU测定。对EDU掺入进行定量。图7E&F:HCT116细胞和SW480细胞以10μM CQ为变量的情况下用指定浓度的CPX处理。菌落形成实验检测细胞增殖情况。图7G:用siNC或siATG5转染大肠癌细胞24小时,然后以20μM CPX为变量再处理24小时。固定细胞,Annexin V/PI染色,流式细胞仪分析。对细胞凋亡的发展进行定量。
结论:抑制自噬增强CPX的抗CRC作用。
八、RUNX1对DJ-1的转录抑制作用
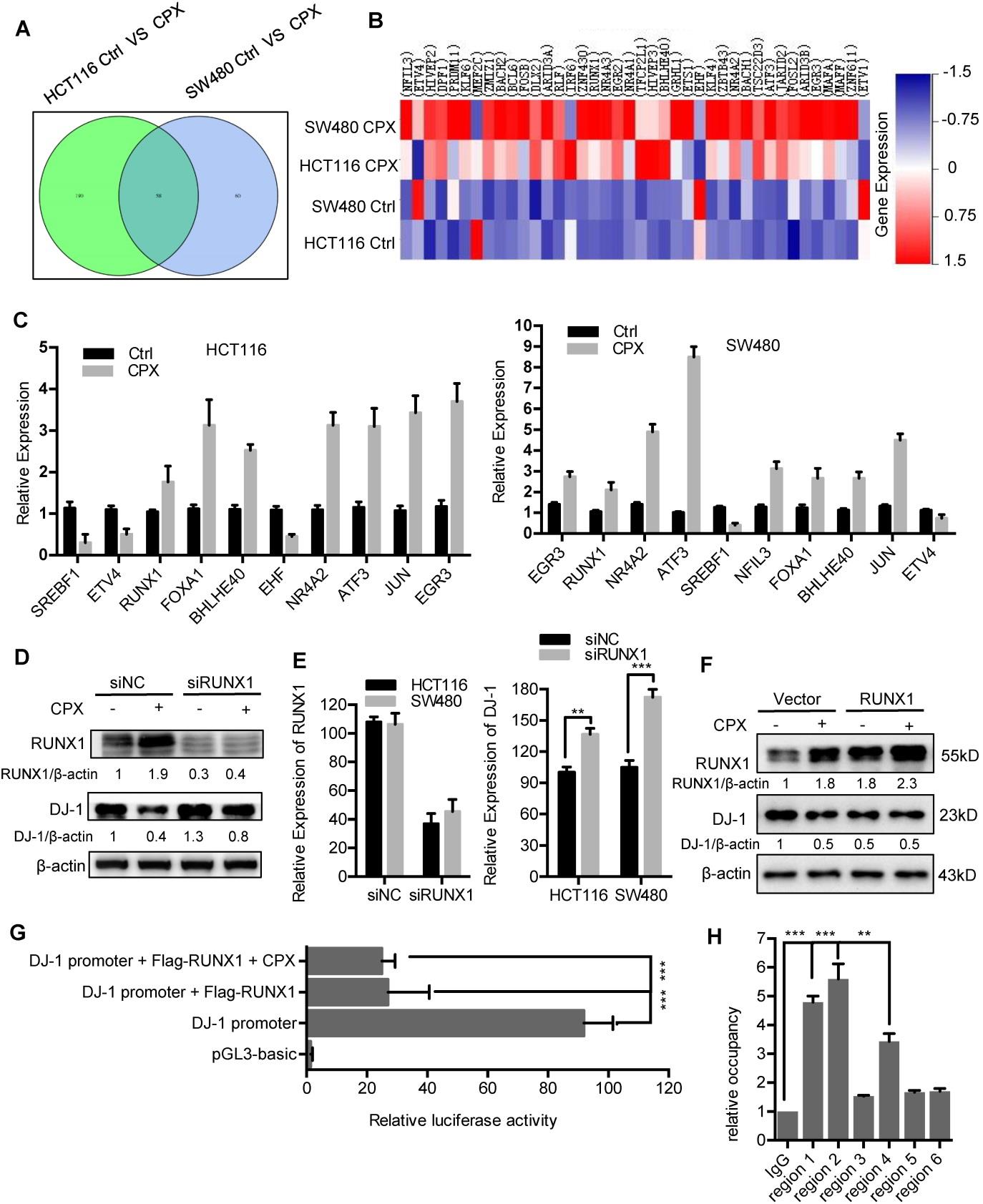
CPX处理明显抑制DJ-1mRNA的表达(图2B)。为了探索DJ-1是否在转录水平下调,在HCT116和SW480细胞中使用转录组测序分析CPX处理下转录因子的表达。图8A:在HCT116 Ctrl VS CPX和SW480 Ctrl VS CPX之间进行转录因子的Venn图分析。图8B:以20μM CPX为变量处理的HCT116和SW480细胞中与DJ-1启动子结合的转录因子的归一化强度值的热图表示。图8C:在HCT116和SW480细胞中进行qRT-PCR,以确定(B)中基因的mRNA水平。
为了验证这些转录因子中的哪些介导了DJ-1的抑制,干扰那些使用特定siRNA的转录因子。
图8D:将siRUNX1转染HCT116细胞24小时,然后以20μM CPX为变量处理24小时。免疫印迹法检测DJ-1蛋白水平。图8E:用siNC或siRUNX1转染HCT116细胞24h,qRT-PCR检测DJ-1和RUNX1mRNA的表达。图8F:免疫印迹分析瞬时转染载体或FLAG-RUNX1质粒24小时后然后以20μM CPX为变量再处理24小时DJ-1和RUNX1在HCT116细胞中的表达。图8G:在以20μM CPX为变量的情况下,瞬时转染载体或Flag-RUNX1质粒的HCT116细胞中DJ-1启动子的荧光素酶报告研究。
为了研究RUNX1是否直接结合到DJ-1启动子上,用染色质免疫沉淀(CHIP)法检测RUNX1是否与DJ-1启动子结合。
图8H:将转染RUNX1质粒48小时的HCT116细胞染色质与RUNX1抗体进行芯片分析,然后用qRT-PCR扩增DJ-1启动子的不同RUNX1结合位点区域。相对于IgG计算富集量。
结论:CPX诱导的DJ-1抑制在很大程度上是由于RUNX1的上调,RUNX1通过直接与其启动子结合来转录抑制DJ-1。






