环状RNA circPPP1R12A编码的蛋白通过Hippo-YAP信号通路促进结肠癌的发病和转移
栏目:最新研究动态
发布时间:2020-01-07
circRNA通常通过作为miRNA海绵调节基因表达,但circRNA编码的肽段在肿瘤作用仍不明确......
环状RNA(circRNA)在肿瘤进展过程中起着重要的调节作用。circRNA通常通过作为miRNA海绵调节基因表达,但circRNA编码的肽段在肿瘤作用仍不明确。近期,来自苏州大学的研究团队在Molecular Cancer期刊上发表题名为A novel protein encoded by a circular RNA circPPP1R12A promotes tumor pathogenesis and metastasis of colon cancer via Hippo-YAP signaling的文章。该文章揭示了结肠癌(CC)进程中circRNA circPPP1R12A的编码肽段的作用,circPPP1R12A-73aa通过激活Hippo-YAP信号通路促进了CC的肿瘤发病和转移。

1、CC组织和细胞中circRNA的表达谱和筛选
使用circRNA基因芯片确定10例结肠癌患者癌和癌旁组织circRNA表达谱。在CC与癌旁组织间共有126个差异表达的circRNA;与癌旁组织相比,在CC组织中有110个circRNA上调,有16个circRNA下调。这些circRNAs大多位于外显子区域。hsa_circ_0000423(circPPP1R12A)在CC组织中上调最为明显,由位于12q21.2 PPP1R12A基因24、25外显子反向拼接而成。接下来通过qRT-PCR检测20例CC患者癌和癌旁组织中circPPP1R12A表达,确定其表达升高。与正常人结肠粘膜上皮细胞系NCM460细胞相比,circPPP1R12A表达在CC细胞系(HT-29,HCT-116,SW480,SW620,LoVo,SW48,DLD-1,Caco2和HCT-15)中明显上调。
使用circRNA基因芯片确定10例结肠癌患者癌和癌旁组织circRNA表达谱。在CC与癌旁组织间共有126个差异表达的circRNA;与癌旁组织相比,在CC组织中有110个circRNA上调,有16个circRNA下调。这些circRNAs大多位于外显子区域。hsa_circ_0000423(circPPP1R12A)在CC组织中上调最为明显,由位于12q21.2 PPP1R12A基因24、25外显子反向拼接而成。接下来通过qRT-PCR检测20例CC患者癌和癌旁组织中circPPP1R12A表达,确定其表达升高。与正常人结肠粘膜上皮细胞系NCM460细胞相比,circPPP1R12A表达在CC细胞系(HT-29,HCT-116,SW480,SW620,LoVo,SW48,DLD-1,Caco2和HCT-15)中明显上调。

2、CC细胞和组织中circPPP1R12A的存在和亚细胞分布的特征
实验根据circPPP1R12A特征设计了两组引物。一组(divergent primers,发散引物)用于扩增环状转录物,而另一组(convergent primers,收敛引物)用于检测线性转录物。结果表明,收敛引物可以用于cDNA和gDNA扩增,而发散引物只能用于cDNA扩增。为了进一步证实circPPP1R12A的存在,使用RNase R降解试验评估circPPP1R12A对RNase R处理的抗性。结果显示,通过RNase R处理降解了PPP1R12A的线性转录物,而这种处理未能降解circPPP1R12A的环状转录物。核质量分离测定法和FISH分析结果显示93%以上的circPPP1R12A出现在HCT-116和LoVo细胞的细胞质中。还通过原位杂交技术检测100例CC患者癌和癌旁组织中circPPP1R12A的表达。结果表明circPPP1R12A在CC组织中的表达高于正常组织,并且这种表达上调与更高的TNM分期呈正相关。并且生存曲线表明,circPPP1R12A表达较高的患者的总生存期较短。

3、circPPP1R12A促进细胞增殖
在两个低circPPP1R12A表达的CC细胞系(DLD-1和Caco-2)中通过质粒过表达了circPPP1R12A,并通过PCR验证过表达效率。CCK8和集落形成的结果表明,circPPP1R12A过表达加速了DLD-1和Caco-2细胞的细胞增殖。划痕实验和Transwell结果表明,过表达circPPP1R12A也增强DLD-1和Caco-2细胞的迁移和侵袭能力。此外,在两个高表达circPPP1R12A的CC细胞系(HCT-116和LoVo)中通过质粒过表达了circPPP1R12A。通过CCK8和集落形成结果证明,circPPP1R12A过表达加速了HCT-116和LoVo细胞的细胞增殖。但是,circPPP1R12A过表达未能在划痕实验和Transwell中显示对CC细胞迁移和侵袭能力的影响。
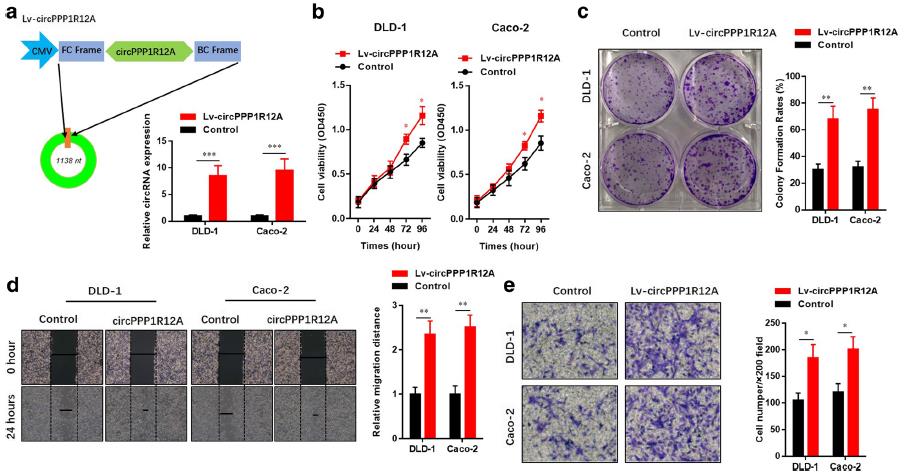
4、敲低circPPP1R12A可抑制CC细胞的增殖,迁移和侵袭能力
接下来,研究敲低circPPP1R12A对细胞增殖,迁移和侵袭性的影响。通过PCR证验证敲低效率,circPPP1R12A的敲低影响了两个高表达细胞系的增殖(图和集落形成的能力。在划痕和Transwell测定中,circPPP1R12A的敲低显著影响HCT-116和LoVo细胞的迁移和侵袭能力。这些结果表明,circPPP1R12A在CC细胞的增殖,迁移和侵袭中发挥了关键作用。

5、CircRNA circPPP1R12A编码一个小的未鉴定蛋白
circRNA circPPP1R12A最初是在circRNA Db数据库中标注的,因此发现circPPP1R12A具有一个短的216 nt的小ORF,具有编码73个氨基酸肽段的潜力。在人类circPPP1R12A中,环化产生了起始密码子AUG,该起始密码子与遗传密码一起开始翻译。circPPP1R12A的ORF应该被翻译成73个氨基酸的蛋白,称之为circPPP1R12A-73aa。设计标记的过表达载体(Lv-flag-circPPP1R12A),突变一个位点的载体(Lv-flag-circPPP1R12A-Mut)和过表达circPPP1R12A-73aa mRNA的载体。PCR验证DLD-1和Caco-2细胞过表达效率,WB检测DLD-1和Caco-2细胞circPPP1R12A-73aa蛋白表达情况。通过LC-MS / MS从证实circPPP1R12A翻译了circPPP1R12A-73aa,并确定了circPPP1R12A-73aa的独特的氨基酸序列。在LC-MS / MS结果中,从10 kDa条带中鉴定出超过76%的circPPP1R12A-73aa序列。另外,鉴定了由circPPP1R12A翻译独特的氨基酸序列为“ GRLRHVNCLSPGVQD”。

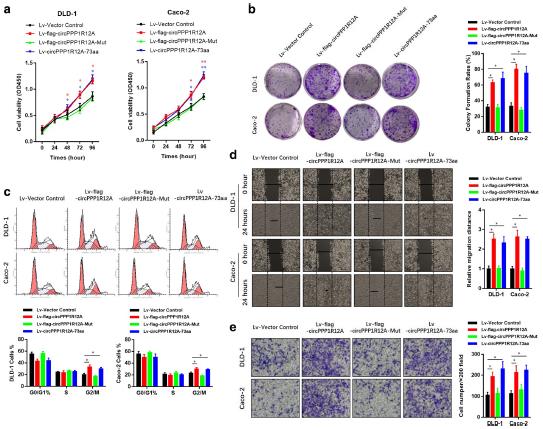
6、CircPPP1R12A-73aa在体外和体内促进CC的增殖和转移能力
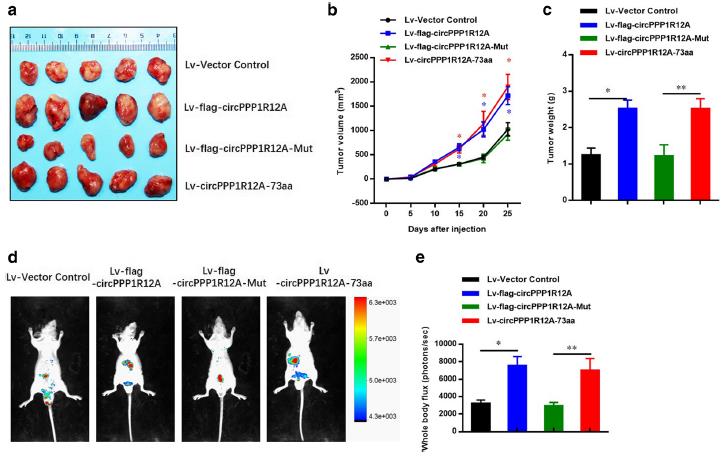
为了进一步探索circPPP1R12A-73aa的生物学功能,在低表达CC细胞系DLD-1和Caco-2中稳转上述过表达载体。CCK8、集落形成实验和细胞周期结果证实过表达circPPP1R12A和circPPP1R12A-73aa增加的细胞增殖能力。然而突变的circPPP1R12A的过表达组中,不能翻译circPPP1R12A-73aa,不能增加DLD-1和Caco-2细胞的增殖能力。划痕实验和Transwell结果中,过表达circPPP1R12A和circPPP1R12A-73aa增强了迁移和侵袭的能力,突变体circPPP1R12A的过表达未能提高这些能力。这些数据表明,如果没有circPPP1R12A编码蛋白circPPP1R12A-73aa参与,circPPP1R12A并不能直接调控CC细胞的增殖。接下来,利用异种移植肿瘤模型进一步研究了circPPP1R12A-73aa在体内CC细胞生长中的作用。过表达circPPP1R12A和circPPP1R12A-73aa组中肿瘤体积和重量明显大于载体对照组和突变组。并且在小鼠生物发光成像结果中,突变组的肿瘤肝转移显著减少。这些数据表明, 是circPPP1R12A编码的circPPP1R12A-73aa促进了CC细胞的增殖和转移,而不是circPPP1R12A。
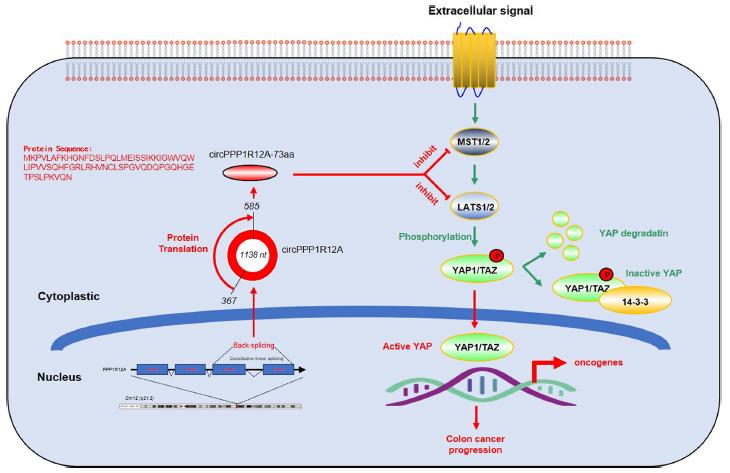
7、circPPP1R12A-73aa通过激活hippo-YAP信号通路促进CC的增殖,迁移和侵袭能力
对四组稳转DLD-1细胞进行RNA测序分析,筛选出差异表RNA,以确定可能的信号通路。通过KEGG通路分析,筛选出差异信号通路。Hippo-YAP作为最丰富的信号通路接受下一步WB验证。YAP1是Hippo信号通路中的转录共激活子,而YAP1诱导的转录反应在癌细胞的增殖和转移中至关重要。为了验证YAP1激活是否为癌细胞的circPPP1R12A-73aa诱导的生长和转移的关键,在过表达circPPP1R12A-73aa的DLD-1和Caco-2 DLD-1和Caco-2和Caco-2细胞系中加入YAP1抑制剂肽17,实验结果肽17显著抑制了因circPPP1R12A-73aa过表达引起的CC细胞的增殖、迁移和侵袭的能力增强。

结论:
CC组织和细胞的细胞质中发现了circRNA circPPP1R12A高表达。circPPP1R12A编码的circPPP1R12A-73aa促进了CC细胞在体内与体外增殖和转移,而不是circPPP1R12A。circPPP1R12A-73aa通过激活Hippo-YAP信号通路提高了CC细胞的增殖,迁移和侵袭能力。
CC组织和细胞的细胞质中发现了circRNA circPPP1R12A高表达。circPPP1R12A编码的circPPP1R12A-73aa促进了CC细胞在体内与体外增殖和转移,而不是circPPP1R12A。circPPP1R12A-73aa通过激活Hippo-YAP信号通路提高了CC细胞的增殖,迁移和侵袭能力。






