lncRNA Paupar通过调节PAX6的活性来促进α细胞的发育和功能
许多研究强调了胰高血糖素分泌失调在高血糖症和糖尿病病因中的作用。 因此,了解胰腺胰岛细胞发育和功能的机制对于发现糖尿病的新疗法具有重要意义。 在这项研究中,胚胎小鼠胰腺和成年小鼠胰岛之间的比较转录组分析确定了几个胰腺lncRNA,这些胰腺lncRNA与必需的胰腺转录因子(包括Pax6相关的lncRNA Paupar)非常接近,并通过实验证实了其分子功能。本文于今年10月发表在Cell Metabolism (IF:22.415)杂志上。
主要结果如下:
1、小鼠胰腺中调节发育的lncRNA鉴定
为了鉴定胰腺中受时间和空间调控的lncRNA,在成年小鼠胰岛和胚胎第15.5天(e15.5)小鼠胰腺(EP)上进行了RNA-seq。如图1A识别出572个候选lncRNA。 使用下列标准来定义2,728个胰腺lncRNA:(1)长度> 200个核苷酸(nt),(2)与蛋白质编码区不重叠,(3)与假基因不重叠(Karro等,2007 ),以及(4)较低的预测编码概率(图1B)。FPKM 法处理过滤(图1C)。这些参数产生了572个高信度胰腺lncRNA(图1D)。两个阶段之间的比较转录组学表明,胰腺中大约一半lncRNA(279或48.7%)受到发育调控:108个lncRNA显着富集EP和171个lncRNA中的SNP在成年胰岛中显着富集(图1E)。为了获得这些基因的功能,使用GREAT识别蛋白编码的基因(图1F),并对包括9个胰腺转录因子在内的基因做GO分析(图1G)。
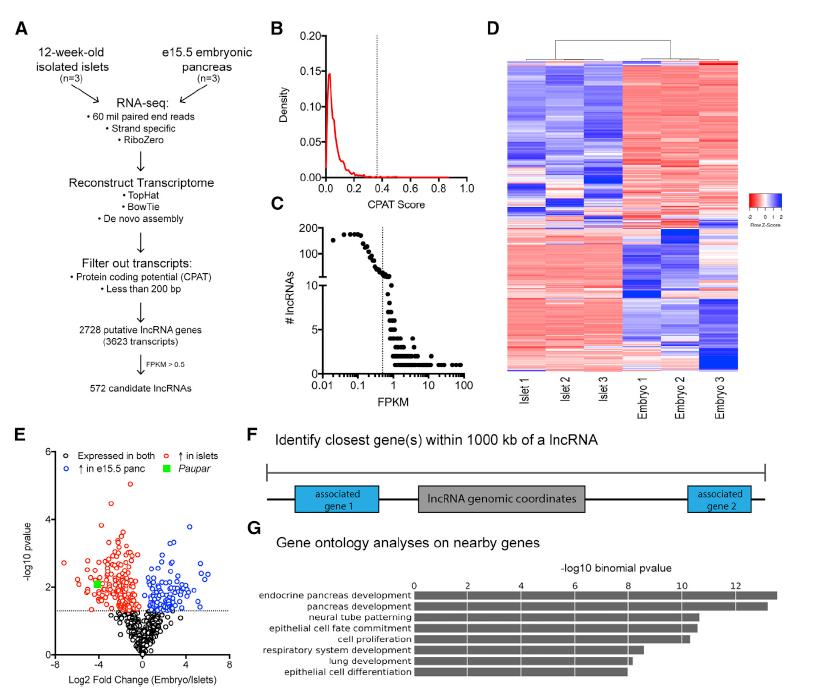
图1系统鉴定小鼠胰腺中发育调节的lncRNA
2、Paupar是在胰腺α细胞中富集的一种细胞核lncRNA
Paupar是一个3482 nt基因,从Pax6上游反义转录8 kb,包含在Pax6os1的第一个内含子中,是一个未知功能的反义RNA(图2A)。Paupar位于小鼠2号染色体上和人类11号染色体上的同义保守区域(UCSC LiftOver)。在其基因和与推定启动子相对应的区域(图2A)中,有许多与lncRNA相似的功能。除了在人类中调控发育和保守外,我们还确定了db / db小鼠(T2D模型)的胰岛中Paupar的表达降低了2倍,这表明Paupar可能在胰岛功能障碍中起作用(图2B)。图2C和D是Paupar表达的时空特异性和组织特异性。与其他胰岛细胞类型相比,FACS纯化的小鼠α细胞和非α胰岛细胞的表达分析证实Paupar在细胞中高度富集,而Pax6在两个细胞群中均表达相同(图2E)。 Gcg和Ins2在α和β细胞中的表达水平证明了样品的纯度(图2E)。图2F说明Paupar主要富集在细胞核。

图2 Paupar是在胰腺α细胞中富集的一种细胞核lncRNA
3、Paupar调节Pax6 α细胞靶基因
Paupar的表达谱促使我们研究其在细胞中的调节功能。 三组独特的反义寡核苷酸(ASO)成功将αTC细胞中的Paupar RNA下调了57%(图3A)。与以前在N2A细胞中报道的相反,这里观察到Paupar敲低Pax6表达没有变化(图3A),这表明Paupar RNA不影响Pax6转录。而Paupar敲低导致几个Pax6 α细胞靶基因下调,包括Gcg,MafB,Arx和NeuroD1(图3A)。 此外,Paupar 敲低的量与Gcg(图3B)和MafB(图3C)表达的减少呈正相关。这些表明,PAX6介导的α细胞基因调控对αTC中Paupar水平敏感。

图3 Paupar lncRNA调控α细胞PAX6靶基因,并与几种参与选择性剪接的核蛋白相互作用
4、Paupar lncRNA与核蛋白相互作用参与选择性剪切
为了进一步探究Paupar调控α细胞PAX6靶基因的分子机制,对RNA靶点进行捕获杂交分析(CHART)鉴定Paupar的相互作用组。两组Paupar 生物素寡糖(COs)均从αTC核提取物中下拉到Paupar RNA(图3D和3E),但Paupar COs并没有拉低Gapdh或TBP (图3D和3E),证明CHART富集是由RNA介导的。基因/蛋白相互作用的检索软件显示Paupa相互作用56个中的25个与Paupa相互作用的蛋白被预测至少与另一个与Paupa相互作用的蛋白作用(图3F)。这些蛋白显著富集于几个图3G途径中。根据Paupar与12个带注释的富含丝氨酸和精氨酸的剪接因子(SRSF)中的8个之间的直接交互作用(图3F),预测到完整的Paupar转录本具有1,685个SRSF结合位点。几个最重要的SRSF位点位于Paupar基因座区域内,该区域在整个胎盘哺乳动物中具有高度序列保守性(图3H,灰色矩形)。与Nkx2-2和Malat1相比,Paupar具有更多的SRSF结合位点,且Z值更高(图3H)。总之,以上结果说明Paupar在α细胞中起调节选择性剪接的作用。
5、Paupar促进Pax6选择性剪接成激活Pax6 α细胞靶基因所需的亚型
图4A是Pax6的两种亚型示意图,尽管非定量RT-PCR可检测到细胞中的两种同工型(图4B),但鉴于较短的Pax6同工型的扩增会产生两种同工型产物,我们只能量化Pax6 5a的表达(图4A,黑色箭头)。 为了直接测试Paupar是否促进Pax6的可变剪接,我们对来自Paupar缺陷型αTC的RNA进行了qRT-PCR。 结果发现,Paupar KD并未导致总Pax6 mRNA水平的变化,但观察到Pax6 5a的显着特异性降低(45%)(图4C)。 此外,Paupar介导的Pax6剪接调控直接通过RNA-RNA相互作用而不是通过SR剪接因子间接发生,因为Paupar和Pax6 RNA之间的关联可以通过RNase处理部分消除(图4D)。PAX6 ChIP测序结果显示,对照中,PAX6与26,244个基因组位点相关,在Paupar KD之后,大约10%的PAX6位点(2,046个峰)显示出不同的结合(图4E)。在Paupar KD上表现出差异结合的区域在启动子<1 kb的区域中较少,而更主要地位于基因间区域(图4F)。对2046个差异结合的PAX6位点100 kb内的基因进行的GO分析显示,主要富集在细胞功能相关的生物过程组分中,包括葡萄糖稳态,离子转运调节,和细胞对葡萄糖刺激的反应(图4G)。为了确定Paupar KD是否引起PAX6介导的细胞基因调控的整体变化,将与差异结合的PAX6位点相关的基因与已发布的富含在α细胞的基因数据集进行比较。发现有60个基因具有统计学上的显着重叠(图4H),重叠的60个基因包含Paupar KD失调的几个基因,如Gcg和MafB(图3A)。这些结果,以及Paupar KD引起Pax6 5a的特异性下调,而不是总的Pax6 mRNA的表达下调(图4E),证明Paupar通过替代剪接赋予Pax6 5a的α细胞特异性调控功能。
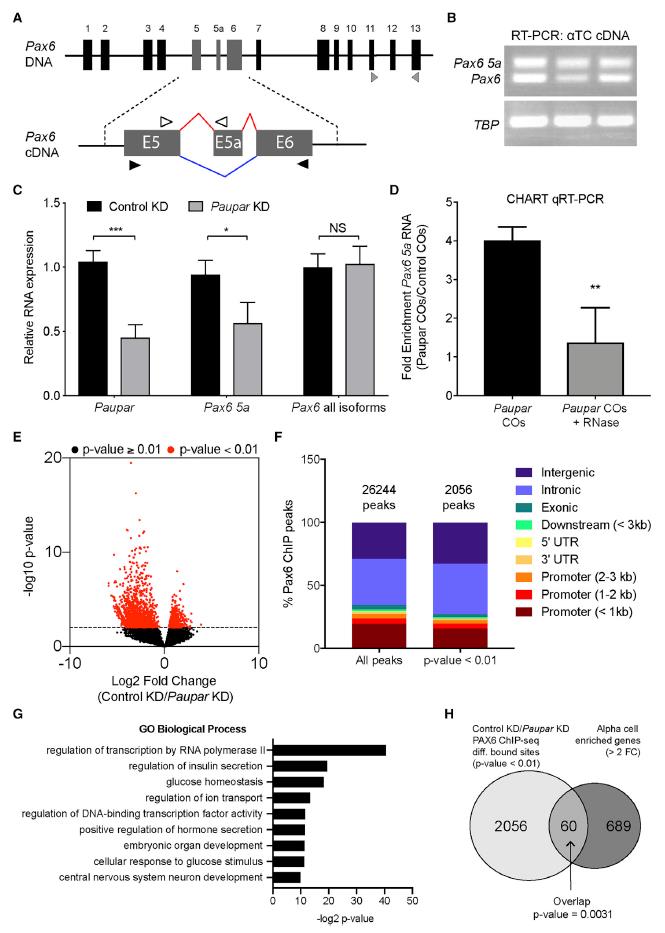
图4 Paupar促进Pax6选择性剪接成激活Pax6 α细胞靶基因所需的亚型
6、Paupar敲除小鼠损害α细胞的发育和功能
利用体内胰岛素耐受性测试(ITT)来评估Paupar KO小鼠对急性低血糖反应的能力,与WT小鼠相比,Paupar KO小鼠降血糖明显,这表明KO小鼠恢复基线血糖水平的效率较低(图5A和B)。另外,Paupar KO小鼠不能应对低血糖症可能是由于胰高血糖素分泌受损,为了测试这一点,在ITT之前和期间测量了血浆胰高血糖素。胰岛素注射后30分钟,Paupar KO小鼠的血浆胰高血糖素相对于WT小鼠降低了2.5倍(图5C),表明Paupar KO小鼠在低血糖反应中分泌的胰高血糖素明显减少。响应低葡萄糖反应,Paupar KO小鼠的分泌的胰高血糖素比野生型胰岛少60%(图5D)。为了确定这种钝化的胰高血糖素分泌是否是由于胰岛胰高血糖素含量降低所致,测量了胰岛胰高血糖素的总含量,发现Paupar KO胰岛的胰高血糖素总含量显着低于对照(图5E)。这些发现表明,Paupar KO胰岛细胞生理功能受损部分是由于胰高血糖素含量降低所致。与生理表型一致,对Paupar WT和KO胰腺进行形态分析发现,细胞占Paupar WT胰岛的13%(图5F),但仅占Paupar KO胰岛的6%(图5F和G),相当于α细胞群体平均减少了2.25倍(图5H)。我们还观察到与WT小鼠(71%)相比,Paupar KO小鼠(79%)β细胞面积相对于胰岛面积有适度增加(图5I-5K)。Paupar WT和KO小鼠之间的平均胰岛大小没有可测量的差异(图5L-5N)。以上结果表明,Paupar是细胞正常发育和功能所必需的。
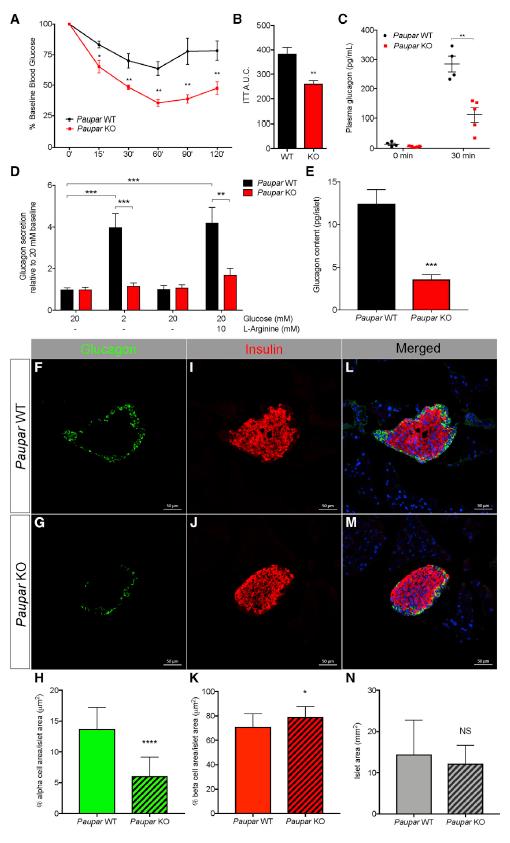
图5 Paupar敲除小鼠损害α细胞的发育和功能
7、Paupar在体内调节必须的α细胞基因
对Paupar WT和KO6周龄小鼠的胰岛进行全转录组分析,得到3,106个差异表达基因(DEG)(图6A)。与α细胞特异性表型一致,DEG占所有已记录的富含α细胞的基因的10%以上(图6B)。此外,DEG包括许多细胞功能所需的因子和许多已知的PAX6a细胞靶标,包括转录因子(Arx,MafB,Irx1和Irx2)控离子通道(Kcnq2,Kcnip3)和胞吐机制(Sytl5和Sytl2)(图6C)。与体外研究一致,Paupar KO小鼠的细胞Pax6 5a以及PAX6 α细胞靶基因显着下调,而总Pax6 mRNA水平未发生变化(图6D)。这些结果进一步证明Paupar介导的对PAX6 α细胞靶基因的调控是Pax6剪接而非转录水平。为了扩展对Paupar介导的PAX6靶基因调控的了解,确定了胰岛中Paupar调控的3,056个基因与αTC中Paupar KD引起的PAX6结合改变的相关基因(2,056个)的关系。分析显示两个数据集之间328个基因显着重叠(图6E),包括许多必需的细胞基因,例如MafB,Arx,Irx1和Irx2,它们的失调可以直接解释Paupar KO小鼠的表型。
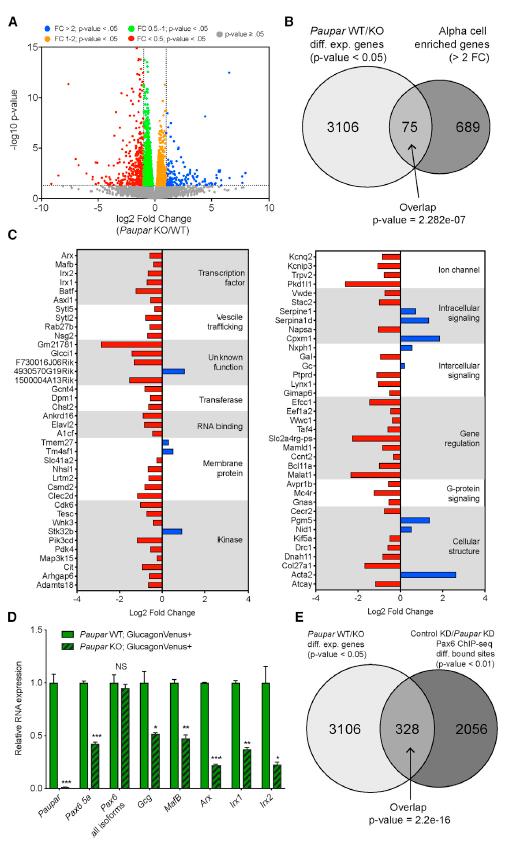
图6 Paupar在体内调节必须的α细胞基因
基于综上研究,作者提出一个模型,其中Paupar通过调节PAX6 a细胞靶基因所需的Pax6 5a亚型的选择性剪接来促进细胞功能(图7)。
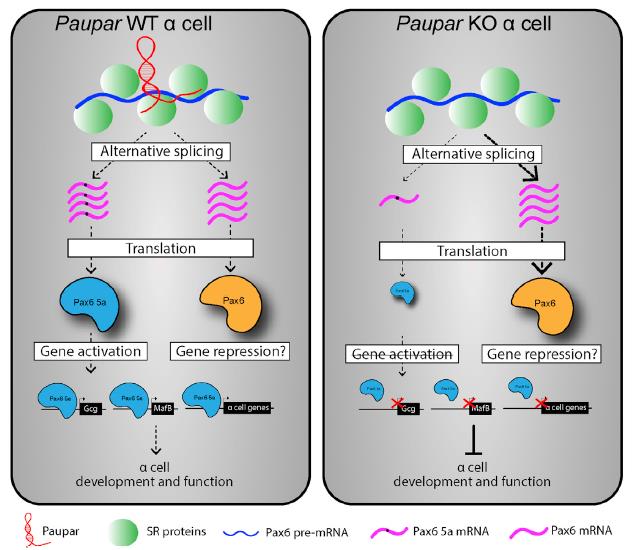
图7 Paupa介导的pax6 α细胞靶基因调控模型
总而言之,本文对α细胞富集的lncRNA的分子和功能表征表明,lncRNA可能代表重要的组织和/或细胞受限治疗靶标,以调节更广泛表达的蛋白质的细胞特异性亚型的产生和功能。
参考文献:
Singer Ruth A., Arnes Luis., Cui Yi., Wang Jiguang., Gao Yuqian., Guney Michelle A., Burnum-Johnson Kristin E., Rabadan Raul., Ansong Charles., Orr Galya., Sussel Lori., (2019). The Long Noncoding RNA Paupar Modulates PAX6 Regulatory Activities to Promote Alpha Cell Development and Function., Cell Metab., undefined, undefined.






