揭秘BRG1与自噬依赖性氧化应激的关系
BRG1,SWI/SNF染色质重塑复合物的ATPase亚基,是维持肠上皮细胞(IECS)内稳态以防止炎症和肿瘤发生所必需的,是直接调控Atg16l1,Ambra1,ATG7和Wipi2转录的关键调节因子,对自噬体生物发生非常重要。BRG1缺陷型IECS的缺陷自噬导致过量的活性氧(ROS),从而导致屏障完整性的缺陷。自噬是综合应激反应的核心组成部分,影响许多炎症性疾病,包括炎症性肠病(IBD)和结直肠癌(CRC)。虽然核心机制已知,但自噬的表观遗传调节的分子基础及其在结肠炎中的作用在很大程度上仍未确定。近期,一篇名为“BRG1 attenuates colonic inflammation and tumorigenesis through autophagy-dependent oxidative stress sequestration”的文章,在杂志《Nature Communications》上发表。该文章的研究重点是确定BRG1在结肠炎和结直肠肿瘤发生的小鼠模型中解决炎症的成人功能。使用损失和获得功能的方法,证明BRG1确保结肠内稳态和耦合自噬依赖的ROS反应。结果突出表明BRG1作为一个内稳态检查点,抑制炎症相关的CRC。
![说明: C:\Users\y505\Desktop\BRG1 attenuates colonic inflammation and tumorigenesis through autophagy-dependent oxidative stress sequestration\1]06${V}3B)NMM2W{K7%3Q5.png](https://img1.dxycdn.com/2020/0116/905/3391170711552001818-14.jpg)
技术路线:

结果:
一、IBD患者上皮细胞BRG1表达降低
BRG1减少和IBD发病机制之间存在因果关系。
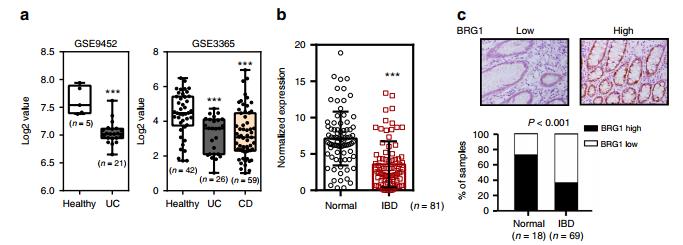
图一 IBD患者BRG1表达降低。a健康对照和IBD标本中BRG1 mRNA的盒图(使用数据集GSE9452和GSE3365)。 b RT-qPCR分析IBD标本和健康受试者(n=81)中BRG1mRNA的表达。 c上图显示BRG1染色图像,下图显示正常和炎症性肠病活检中上皮BRG1的表达(χ2检验)。染色指数使用10分量化标度,分数>4被认为是较高的水平。
二、成年Brg1IEC-AKO小鼠自发发展结肠炎
为了避免BRG1丢失导致的早期发育缺陷,采用VillinCre-ERT2/+小鼠在2个月龄时通过给药tamoxifen的方法来切除BRG1。右旋糖酐硫酸钠(DSS)是一种诱导实验性结肠炎的化学物质,具有IBD的临床特征。
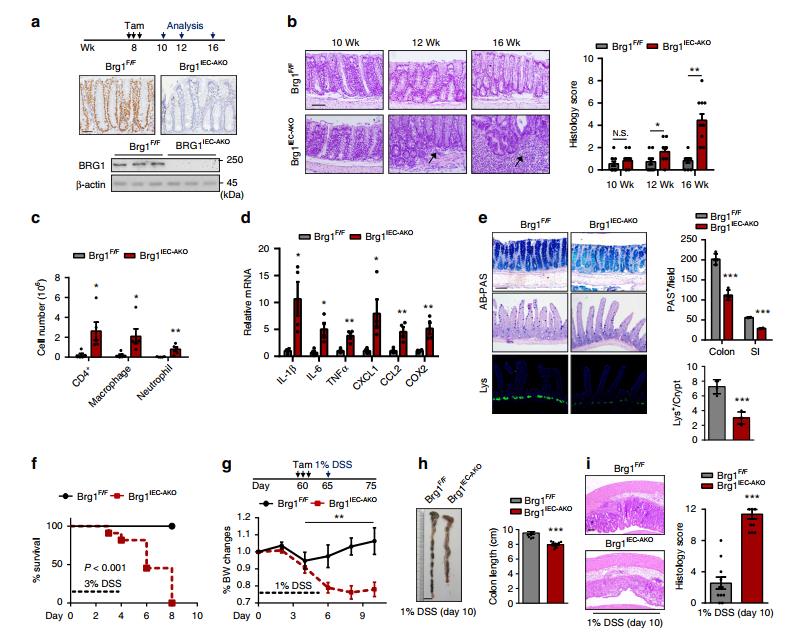
图二 BRG1在成人肠道中的缺失导致结肠炎的发展。用tamoxifen治疗2个月大的小鼠(Brg1flox/flox或VillinCre-ERT2;Brg1flox/flox),从而产生Brg1F/F或Brg1IEC-AKO小鼠。a显示了BRG1表达的免疫组织化学(上图)和免疫印迹(IB)分析(下图)。 b在指定的时间点显示Brg1F/F和Brg1IEC-AKO小鼠中远端切片的代表性组织学图像,并显示组织病理学的半定量评分(n=12,每个基因型)。箭头:免疫细胞浸润。 c从16周龄小鼠(BRG1消融后2个月)分离的结肠固有层细胞通过流式细胞术(n=4)进行分析。 d 16周龄小鼠结肠匀浆的RT-qPCR分析以评估细胞因子和趋化因子的产生(每个基因型n=6). e来自3月龄小鼠(BRG1切除后1个月)的小肠的Alcian blue-Periodic acid Schiff(AB-PAS;杯状细胞)染色和溶菌酶(Lys;Paneth细胞)染色以及右侧显示的定量结果 (n=5)。 f 3%DSS处理后Brg1IEC-AKO小鼠与Brg1F/F小鼠存活率比较(n=10)。 g-i小鼠饮水中添加1%DSS喂养,并记录体重(g)和结肠长度(h)的损失(n=10)。(i)从第10天1%DSS处理的小鼠收集的中远端结肠组织的H&E染色切片,以及在右侧显示的组织学评分定量。
三、Brg1丢失驱动炎症相关CRC
Brg1IEC-AKO小鼠遭受持续炎症的观察,促使研究BRG1在结肠炎相关肿瘤发生中的作用。因此,首先用单剂量的DNA甲基化试剂AOM治疗小鼠,以确定它是否能使Brg1IEC-AKO小鼠发展肿瘤。为证实Brg1IEC-AKO小鼠中发生的慢性炎症促进上皮异型增生,接下来通过注射AOM诱导CRC,随后进行三个周期的1%DSS治疗。在整个DSS治疗期间记录体重的变化,并在AOM治疗12周后确定肿瘤负担。
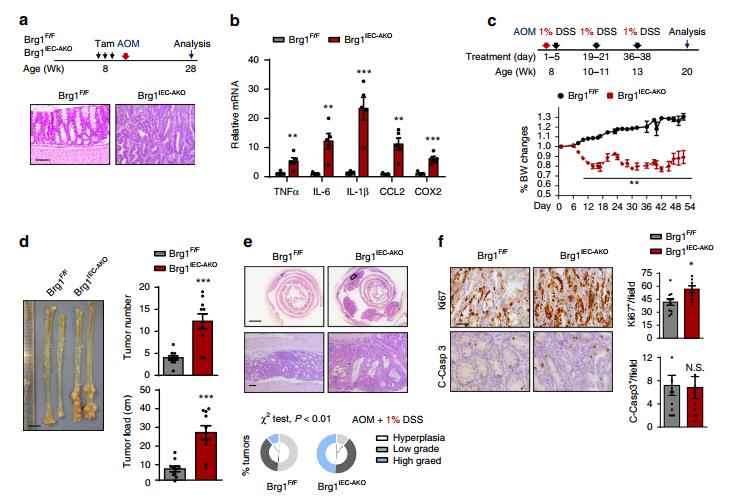
图三 BRG1缺失促进炎症相关的CRC。 a AOM单独治疗方案。Brg1F/F和Brg1IEC-AKO小鼠7个月龄结肠H&E染色切片的代表性图像(每个基因型n=10)。 b RT-qPCR分析7月龄小鼠全结肠匀浆中指示基因的相对mRNA水平(每个基因型n=5)。 c Brg1F/F和Brg1IEC-AKO小鼠于第0天(2月龄)注射AOM,并按指示用1%DSS治疗3个4天周期。体重变化记录如下(n=10每基因型)。 d AOM注射12周后,处死小鼠检测肿瘤负荷(n=10)。 e每种基因型中结肠的代表性图像和肿瘤的总体分级(χ2检验)(每种基因型n=10)。 f显示了来自20周龄AOM/1%DSS处理的Brg1F/F和Brg1IEC-AKO的肿瘤中Ki67和裂解的caspase-3染色的代表性图像(每个基因型n=4)。
四、BRG1过表达从结肠炎和结肠炎中保护小鼠
为确定BRG1表达的升高是否可以密切地保护小鼠免受结肠炎的侵袭,构建条件性Brg1过表达小鼠(R26BRG1/+)。为了诱导急性炎症,我们用3%的DSS处理小鼠。
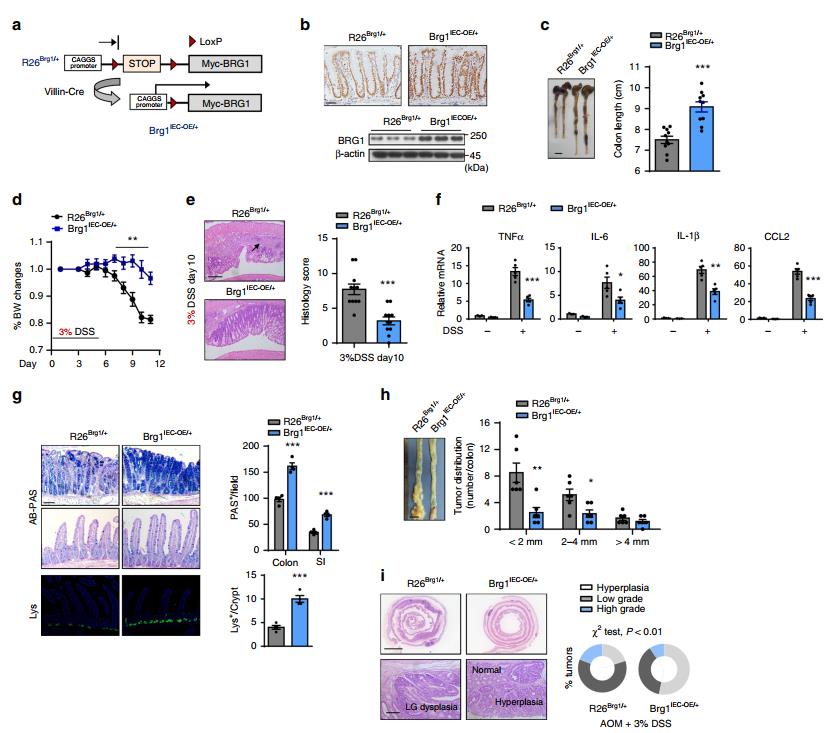
图四 BRG1在IECS中过表达可保护小鼠免于结肠炎和肿瘤发生。a R26Brg1/+小鼠方案和BRG1在IECS(Brg1IEC-OE/+)小鼠中的条件性过表达。 b R26Brg1/+和Brg1IEC-OE/+小鼠结肠组织BRG1表达的免疫组化和Western blotting分析。 c,d DSS治疗5天,记录结肠长度(C)和体重(D)(n=10)。 e 经3%DSS处理的R26Brg1/+和Brg1IEC-OE/+小鼠的代表性中远端结肠切片和组织学评分(右)(n=10)。箭头表示免疫细胞浸润。 f RT-qPCR分析未处理或DSS处理的小鼠(第5天,每个基因型n=4)全结肠匀浆中指示基因的相对mRNA水平。 g来自3%DSS处理的小鼠肠道的Alcian blue-Periodic acid Schiff(AB-PAS;杯状细胞)染色和溶菌酶(Lys;Paneth细胞)染色,定量结果显示在右侧(n=5)。2月龄的小鼠接受AOM治疗,随后进行3个周期的3%DSS治疗。 h AOM治疗3个月后小鼠的宏观图像,以及基于大小的肿瘤数量在右侧面板中量化(每种基因型n=10)。 i H&E染色结肠切片的代表性图像如图所示;右侧为肿瘤的百分比分级(n=10,χ2检验)。
五、BRG1介导ROS稳态调节屏障完整性
肠屏障功能障碍经常导致肠道炎症。通过在严重结肠炎发病前检查紧密连接蛋白1(ZO-1)、Claudin-1和E-cadherin的分布或表达来研究BRG1丢失是否损害了屏障完整性(3月龄小鼠检查)。由于上皮细胞死亡是导致屏障完整性的主要因素之一,因此评估Brg1IEC-AKO小鼠中细胞存活的可能缺陷。为了解BRG1在结肠内稳态中的机制作用,使用从7周龄Brg1F/F和Brg1IEC-AKO小鼠分离的IECS进行了表达谱分析,在这个时间点BRG1缺失还没有导致结肠炎。因此,表达改变可能反映了结肠中BRG1丢失的主要影响。为了提供更多的证据证明ROS是BRG1介导的结肠炎中的必要参与者,进行实验以确定阻断ROS是否可以逆转由BRG1丢失引起的炎症表型。为此,3月龄Brg1F/F和Brg1IEC-AKO小鼠在2个月龄时删除BRG1后接受NAC治疗1个月。
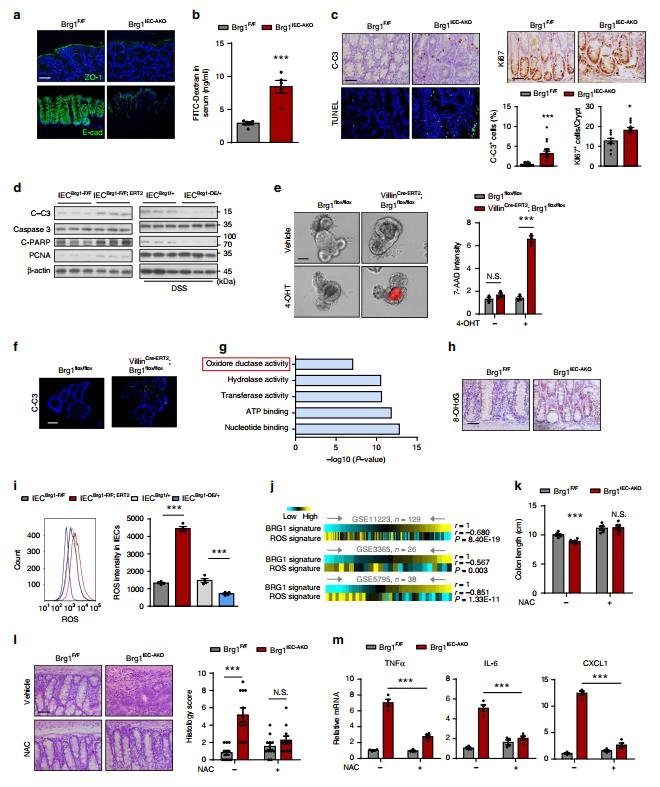
图五 BRG1介导ROS反应,控制细胞凋亡和结肠炎症。a-c样品均来自12周龄Brg1F/F和Brg1IEC-AKO小鼠(注射tamoxifen后1个月)。 (a) 结肠切片中具有代表性的ZO-1和E-cadherin染色。 (b) 由血清中FITC-葡聚糖浓度测定结肠通透性(n=5/基因型)。 (c) TUNEL,裂解的caspase-3和Ki67染色(n=4)。 d IECS分离自Brg1flox/flox和VillinCre-ERT2;Brg1flox/flox或5天DSS处理的R26Brg1/+和Brg1IEC-OE/+小鼠,BRG1缺失通过细胞中的4-OHT处理实现。相应的命名为IECBrg1-F/F、IECBrg1F/F-CreERT2或IECBrg1/+、IECBrg1-OE/+。 e来自Brg1flox/flox和VillinCre-ERT2的有机化合物;Brg1flox/flox小鼠。培养5天后,用4-OHT处理或不用4-OHT处理,48小时后对7-AAD染色的有机物(RED)进行成像(左)。每种有机物的荧光密度的定量(右)。 f C-Casp3染色的有机切片,如所示。 g 7周龄Brg1F/F和Brg1IEC-AKO小鼠(注射tamoxifen1周后)IECS基因表达变化的GO项分析。 h 7周龄Brg1F/F和Brg1IEC-AKO小鼠8-OHdG染色。 i直方图和MFI量化从小鼠分离的IECS中的ROS,BRG1缺失通过4-OHT处理实现(n=4每个基因型)。 j IBD标本中BRG1信号与ROS信号的相关性(Pearson‘s法)。 K-m 12周龄Brg1F/F和Brg1IEC-AKO小鼠在BRG1缺失1个月后给予NAC处理,1个月后进行分析。结肠长度 (k), H&E (l)和RT-qPCR分析(m) ,如所示(n=5每基因型)。
六、BRG1作为IECS中的自噬检查点
为了阐明BRG1调节ROS的分子基础,从2个月龄的野生型IECS中提取BRG1结合的染色质,进行免疫共沉淀并进行深度测序分析。CHIP-SEQ分析表明,12119个基因(26349个峰)在6kb的注释基因范围内具有BRG1占有率。为了将染色质结合与转录调节相关联,chip-seq数据与表达谱对齐。一些证据表明,受损的自噬会导致氧化应激。因此,推断BRG1通过调节自噬调节ROS稳态。为了测试这种可能性,2个月龄Brg1flox/flox和VillinCre-ERT2;Brg1flox/flox或Rosa26Brg1/+和Brg1IEC-OE/+小鼠的结肠中分离出IECS。为了在全基因组范围内区分BRG1结合位点和BRG1功能位点,在Brg1F/F和Brg1IEC-AKO IECS中进行了H3K9ac(活性基因转录的组蛋白标记)chip-seq。
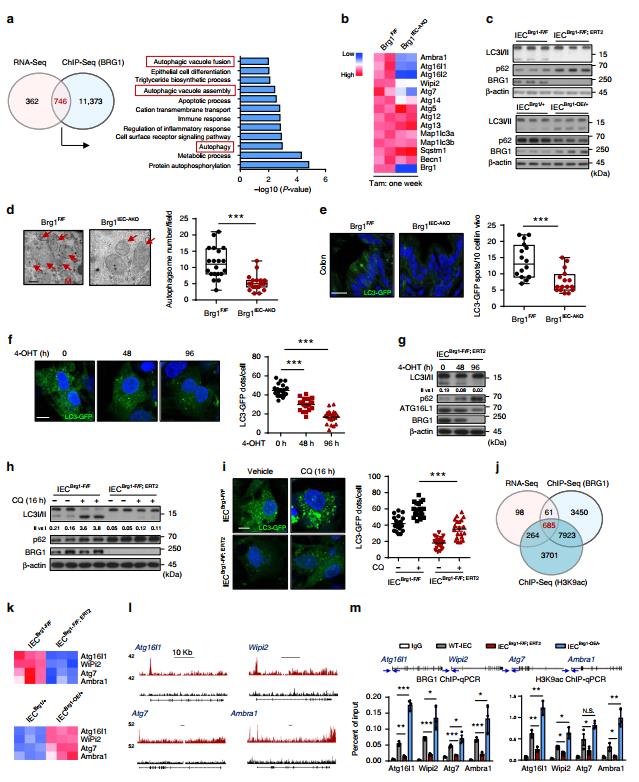
图六 BRG1调节IECS中的自噬以控制ROS和结肠炎症。从Brg1flox/flox,VillinCre-ERT2;Brg1flox/flox或R26Brg1/+和Brg1IEC-OE/+小鼠中分离IECS,并且通过细胞中的4-OHT处理来实现BRG1缺失(以下称为IECBrg1-F/F,IECBrg1-F/F-CreERT2或IECBrg1/+,IECBrg1-OE/+)。a显示BRG1结合基因的数量并显示BRG1-KO IECS表达变化的Venn图(BRG1消融的1周)。右图显示了重叠基因的GO术语分析。 b heatmap总结了与自噬调节相关的基因表达的RNA-seq结果。 c免疫印迹显示LC3转换和p62水平。 d透射电镜检测自噬小体,并对7周龄Brg1F/F和Brg1IEC-AKO小鼠(BRG1缺失1周;每个基因型n=5)的结肠进行定量。箭头表示自噬小体,M:线粒体。 e 7周龄Brg1F/F和Brg1IEC-AKO小鼠结肠LC3-GFP染色。 F,g LC3-GFP染色(f)和IECBrg1F/F-CreERT2经4-OHT处理的指示蛋白的IB分析,如图(g)所示。 h,i 加或不加氯喹(CQ 10μM)处理的IECBrg1-F/F和IEC-CreERT2中的IB分析(h)和LC3-GFP染色(i)。 j Venn图显示与BRG1,H3K9ac结合的重叠基因,并显示BRG1-KO IECS中的表达变化。 k RT-qPCR分析IECS中指示的基因(BRG1KO或过表达),并通过热图(n=3)总结结果。 l 从野生型小鼠分离的IECS中Atg16l1,Wipi2,ATG7和Ambra1基因位点的BRG1 chip-Seq信号的快照。 m 芯片-qPCR分析IECS中Atg16l1,Wipi2,ATG7和Ambra1基因位点的BRG1结合和H3K9ac编码,如所示(n=5,每个基因型)。箭头指示芯片-qPCR引物对的位置。
七、BRG1调节自噬以控制IECS中的ROS反应
鉴于ATG16L1在自噬小体形成和结肠炎中的功能和临床重要性,评估在BRG1缺失的IECS中Atg16L1的下调是否确实导致了失控的ROS反应和细胞存活缺陷。因此,使用寡核苷酸在IECBrg1-F/F和IECBrg1-F/F;CreERT2中敲除(KD)Atg16l1。除了Atg1611外,BRG1直接调节Wipi2,ATG7和Ambra1,它们对自噬小体生物发生也很重要。为了进一步阐明结肠炎症中brg1和自噬之间的功能依赖性,产生了有条件地消融切除IECs 中自噬蛋白ATG5的VillinCre/+;Atg5flox/flox小鼠(Atg5IEC−/−).肠道微生物区系在疾病发展和进展过程中起着驱动炎症反应的重要作用。为了排除肠道微生物群参与BRG1缺乏引起的肠道屏障损害的可能性,通过用含有抗生素鸡尾酒的饮用水治疗Brg1IEC-AKO和Brg1F/F小鼠3周,然后用1%的DSS治疗,产生了肠道微生物区系枯竭小鼠。通过16S rDNA测序证实肠道微生物区系耗尽。
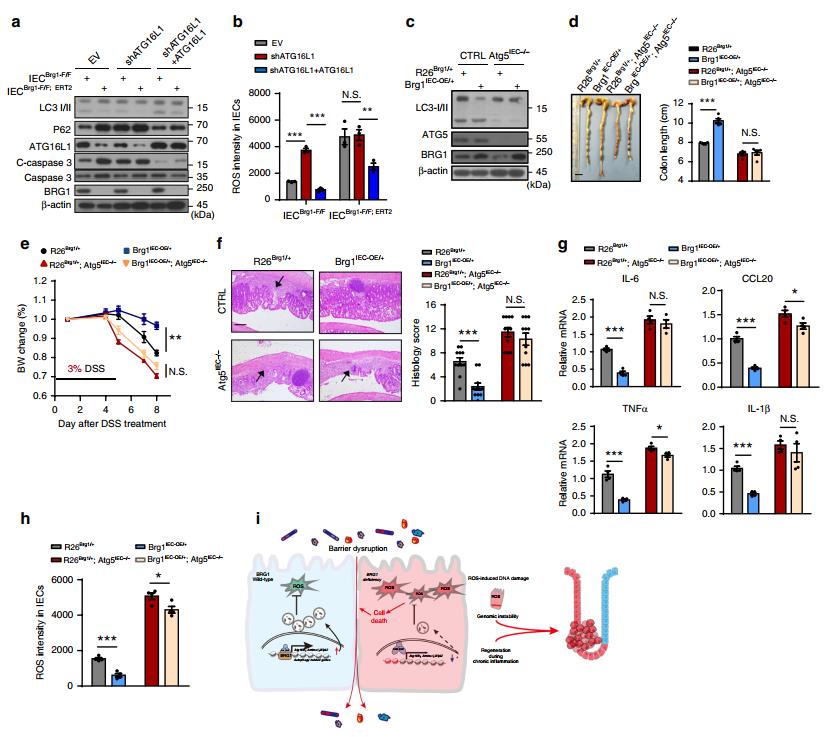
图七 BRG1保护结肠炎症依赖于自噬的调节。a IECBrg1-F/F(对照)或IECBrg1-F/F-CreERT2(BRG1 KO)中指示蛋白的IB分析,带有或不带有ATG16L1敲除或恢复。 b 如图所示,IECS中ROS水平的量化(每个基因型n=4)。 c 从小鼠分离的IECS中BRG1,ATG5和LC3的免疫印迹分析。 d-h在饮水中给药DSS5天。结肠长度(d)和体重(e)记录在IECS中具有或不具有ATG5缺失的R26Brg1+和Brg1IEC-OE/+小鼠中(n=8)。 f DSS治疗9天后,来自所指示的小鼠基因型的结肠切片的组织学。 g RT-qPCR分析DSS处理小鼠结肠匀浆中相对mRNA表达水平(第9天;每个基因型n=5)。 h如所示,量化小鼠IECS中的ROS水平(每基因型n=4)。 i BRG1直接控制IECS中Atg16l1,Wipi2,ATG7和Ambra1等多层面自噬成分基因。因此,成年BRG1在IEC中的丢失导致自噬不足,导致过量的活性氧(ROS),从而损害屏障完整性并促进炎症。代偿性再生加上ROS诱导的DNA损伤促进了CRC的恶性进展。






