浅谈外泌体与骨转移
导语:
骨转移是某些原发于骨组织以外的恶性肿瘤转移至骨组织引起的以疼痛、骨折为主要表现的病理现象。骨转移是一种长期症状,可行手术、放疗改善症状,但疗效较差。近日,一篇有关原发性前列腺癌的骨转移的文章进入人们视野,小编和大家浅谈下外泌体和骨转移的相关研究。

思维路线:

结果:
1.前列腺癌(PCa)衍生的外泌体促进小鼠骨骼中的肿瘤生长
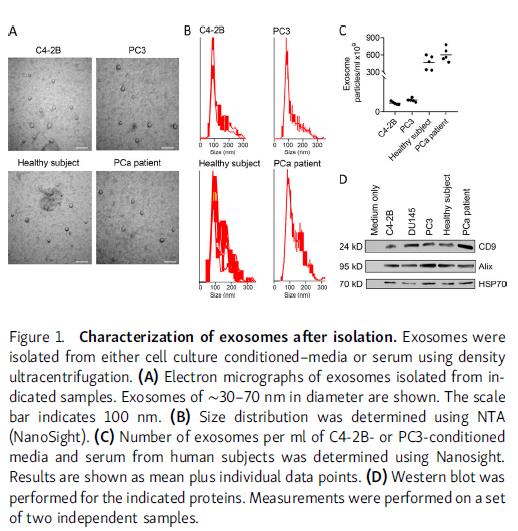
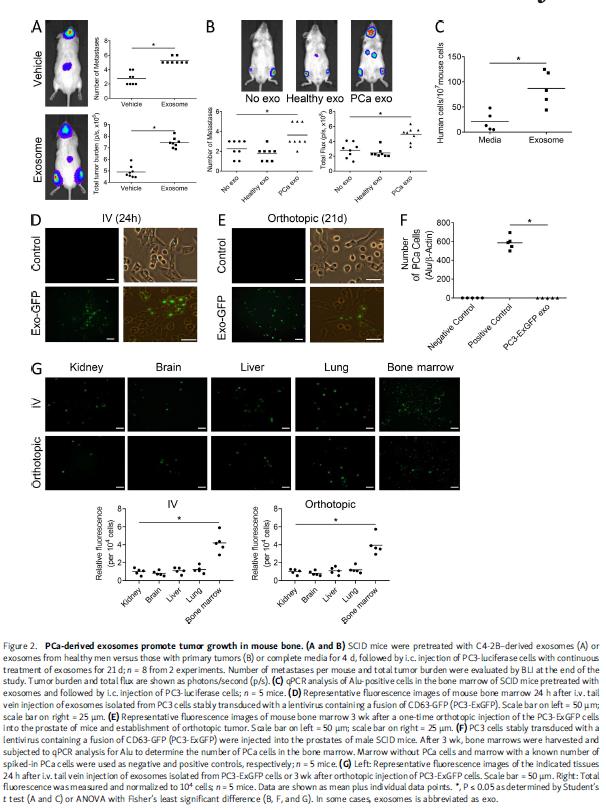
从肿瘤细胞和健康人癌症病人血清中分离外泌体,直径在60-150nm范围内,发现人血清中外泌体含量相对较高,表达外泌体相关蛋白CD9,ALIX和HSP70。对小鼠进行外泌体预处理,心内注射(左心室)PCa细胞,发现PCa外泌体诱导转移位点的数量增加,总肿瘤负荷增加。外泌体预处理使定植到骨髓中的PCa细胞比率增加至115%。,注射可以表达荧光外泌体的细胞,能检测到它们在骨髓基质细胞(BMSCs)中的存在,发现外泌体存在于所有组织中,在骨髓基质的水平高于其他组织。
2. PCa衍生的外泌体诱导骨基质细胞,增加PCa肿瘤细胞增殖与侵袭
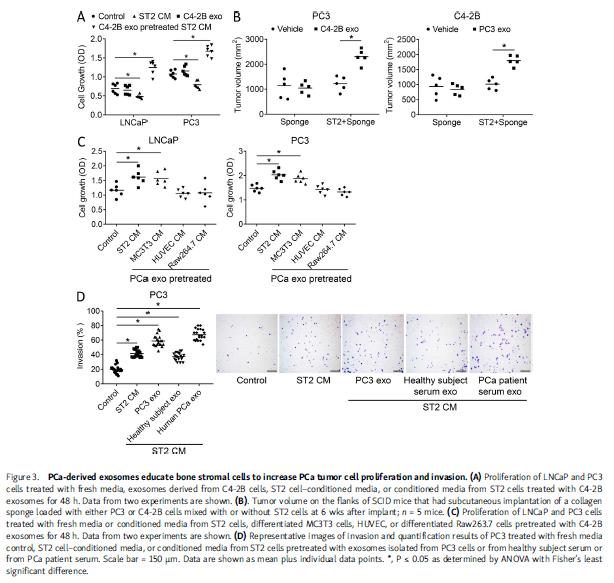
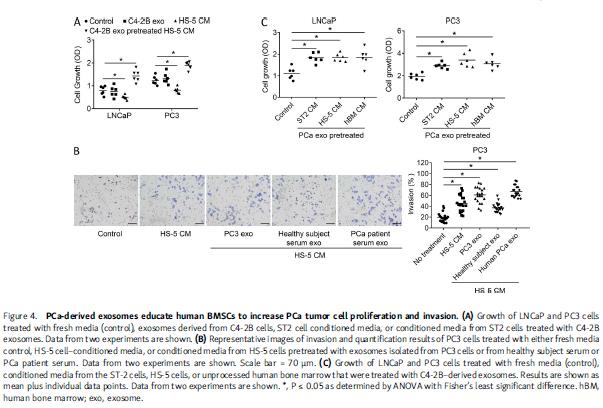
为研究外泌体是否通过微环境间接促进PCa进程,评估外泌体改变骨髓基质细胞影响PCa细胞生长能力的程度。基质细胞的条件培养基能抑制PCa细胞生长,相反,PCa外泌体预处理的基质细胞培养基则促进PCa细胞生长。将装载有PCa细胞和含有或不含基质细胞的海绵皮下植入小鼠侧翼,然后PCa外泌体处理小鼠,发现单独外泌体或基质细胞均不影响PCa生长,而在充满基质细胞的海绵中,外泌体诱导PCa生长。外泌体对成纤维基质细胞作用最大,然后是成骨细胞,对内皮细胞或破骨细胞没有影响。基质细胞培养基会促进PCa侵袭,PCa细胞外泌体预处理后的基质细胞培养液进一步增加PCa细胞的侵袭能力。使用HS-5人骨髓基质细胞系进行重复实验有相同发现。
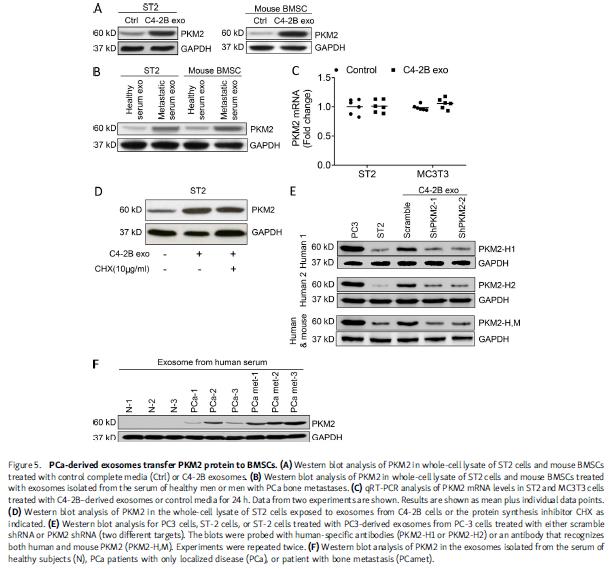
3. PCa衍生的外泌体增加基质细胞中PKM2表达
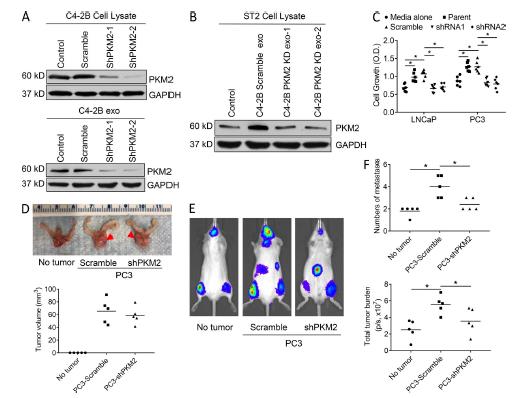
质检测外泌体诱导基质细胞蛋白质组发生的变化,变化幅度最大是一种糖酵解酶PKM2。PCa外泌体增加ST2细胞和原代BMSC中PKM2蛋白的表达,不诱导PKM2 mRNA转录。蛋白质合成抑制剂CHX处理基质细胞,在存在或不存在CHX的情况下,PCa衍生外泌体均诱导相似的基质细胞中PKM2水平,表明外泌体将PKM2蛋白转移到基质细胞,而不是诱导PKM2 mRNA合成或蛋白质合成。患者外泌体表达PKM2蛋白,它的表达随着肿瘤的存在而增加,在肿瘤转移时进一步增加。PCa外泌体PKM2表达缺失导致PCa外泌体诱导PCa细胞生长的能力丧失,原发肿瘤中敲低PKM2,部分减弱了原发肿瘤增加转移数量和肿瘤负担的能力。这些结果表明原发性前列腺肿瘤促进转移,PKM2促进原发性肿瘤的促转移能力。
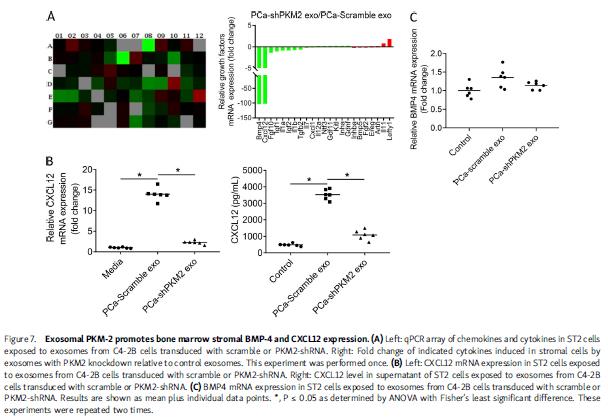
4.由PKM2诱导的BMSCs分泌CXCL12,PCa外泌体通过CXCL12促进PCa肿瘤生长
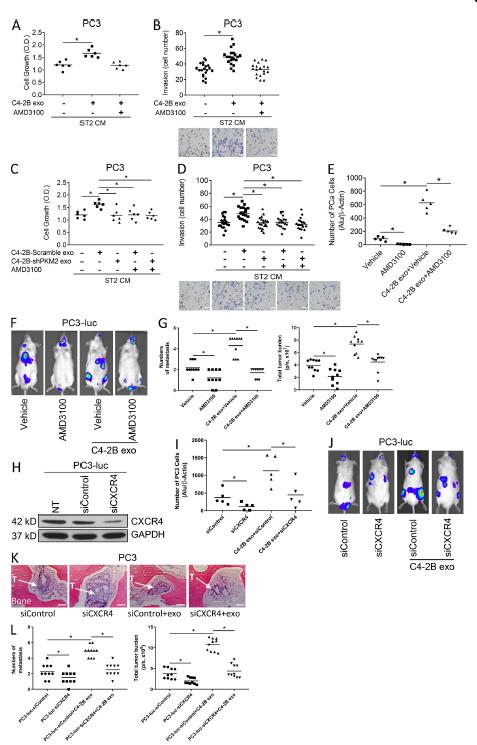
探讨PCa外泌体中的PKM2是否调节基质细胞产生可溶因子以促进PCa生长。检测对照或PKM2敲低PCa外泌体处理后,发现PKM2敲低改变了几种细胞因子的表达,BMP-4和CXCL12明显降低。PCa衍生的外泌体诱导CXCL12 mRNA和蛋白表达超过13倍。基质细胞中加入或缺乏AMD3100,用PCa外泌体处理基质细胞,收集基质细胞的培养基,孵育PCa细胞,发现来自PCa外泌体处理的基质细胞的条件培养基增加PC3和C4-2B细胞生长和侵袭;AMD3100能废除其诱导的增殖和侵袭。外泌体处理基质细胞的条件培养基可增加PC3细胞的增殖侵袭,PKM2敲低废除PCa外泌体诱导的基质细胞促PCa细胞增长侵袭的能力,AMD3100阻止了具有完整PKM2表达的PCa外泌体的诱导基质细胞促PCa细胞生长侵袭的能力。PCa外泌体增加PCa植入骨髓的能力,AMD3100减弱这种能力。体内验证也有同样发现,这些表明PCa外泌体的PKM2调节基质细胞中CXCL12的产生,促进PCa进展。
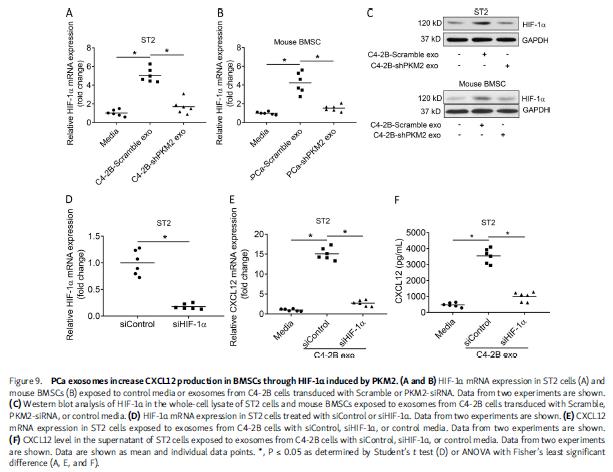
5.PCa外泌体以依赖于PKM2的方式通过缺氧诱导因子(HIF-1α)的诱导,促进基质细胞中CXCL12表达
PCa外泌体刺激ST2基质细胞系和原代小鼠BMSC中HIF-1α表达,PCa外泌体敲低PKM2明显降低HIF-1α表达。基质细胞中敲低HIF-1α,降低外泌体介导的诱导CXCL12的能力。
总结:
前列腺癌衍生的外泌体以PKM2依赖的方式刺激基质细胞中HIF-1α表达,进而诱导基质细胞中的CXCL12表达,调控肿瘤进展。






