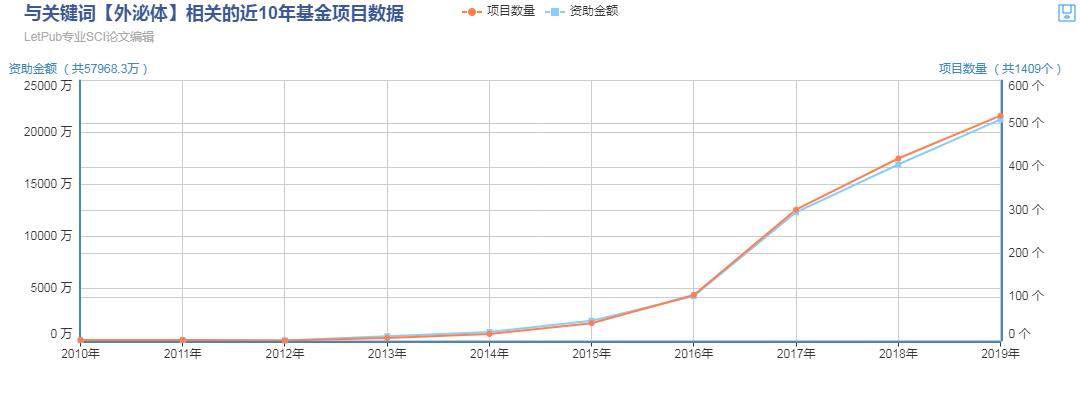
国自然热门领域之外泌体
外泌体是胞内多泡体与细胞膜融合后,释放到细胞外的膜性小囊泡,是细胞间信号传输的载体。外泌体最近几年受到广泛关注,成为生物医学科学研究的新宠儿。文章发表数目飞速增长,2019年外泌体相关课题中标五百余项。外泌体成为研究热点是大致可以认为从2014年开始。2013年,诺贝尔生理学或医学奖授予美国科学家詹姆斯·罗思曼、兰迪·谢克曼及德国科学家托马斯·祖德霍夫,以表彰其在细胞间囊泡运输调控机制领域作出突出贡献,将外泌体研究的热度推向高潮。
今天,以一篇NC文章为例,讲一下外泌体相关研究。今天这篇文献题目为:Circulating myocardial microRNAs from infarcted hearts are carried in exosomes and mobilise bone marrow progenitor cells。该文章证明了循环心肌心肌丰富的miR(myo-miR)和外泌体在心肌梗死(AMI)小鼠中的作用。

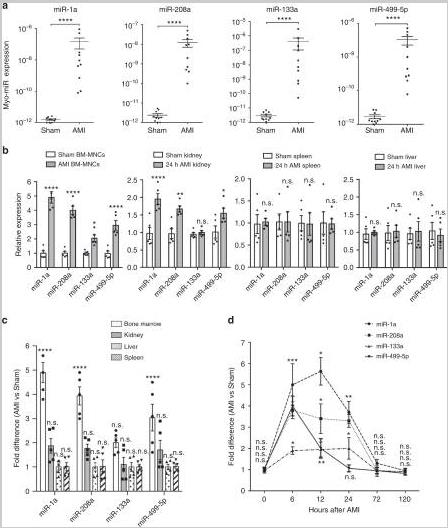
1、AMI后,PB中的Myo-miRs明显升高,并有效转移到BM-MNC中
手术诱导小鼠AMI,6小时后分离血浆,通过qRT-PCR测量myo-miRs。AMI小鼠中的四个myo-miRs,miR-1a,miR-133a,miR-208a和miR-499-5p的水平比假手术小鼠明显高。分析了不同器官对myo-miR的摄取, AMI小鼠中BM-MNCs和肾脏中myo-miRs的水平显着高于Sham小鼠。从梗塞的心脏释放的myo-miRs被选择性地转移到不同的器官,并更有效地转移到BM细胞中。BM-MNCs中myo-miR 6至12h积累达到峰值,在24 h时减少,并在72 h时恢复到基础水平。
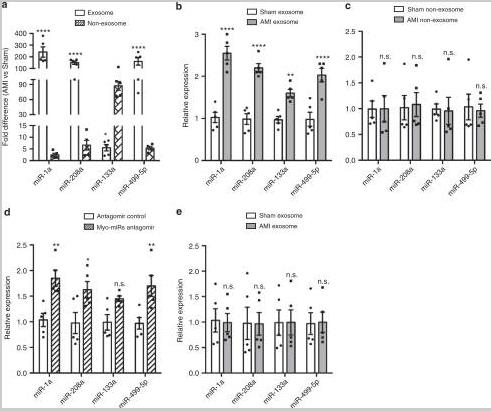
2、外泌体介导循环心肌miR转移到BM-MNC中
与Sham小鼠相比,AMI小鼠中外泌体中的四个myo-miRs水平显着更高,结果与人类一致。用AMI小鼠外泌体治疗的BM-MNCs中的myo-miRs水平显着高于Sham小鼠,而用AMI和Sham小鼠的非外泌体成分治疗的BM-MNCs之间没有观察到差异。然后给完整小鼠注射外泌体或从AMI或Sham小鼠中分离的非外泌体成分。myo-mir在用外显体处理的小鼠的BM-MNCs中显著增加,而不是用AMI小鼠的非外显体成分处理的小鼠。 这些数据表明,是外体而不是非外体血浆成分介导了AMI后循环心肌myo-mir向BM-mnc的转移。
3、Myo-miRs在体外下调BM-MNCs中的CXCR4表达
通过qRT-PCR、Western blotting和流式细胞术分析,任何单个myo-miR的过度表达都能下调BM-MNCs和MSCs中CXCR4的表达。双荧光素酶活性报告基因检测证实miR-1a靶向3'UTR的295-302位。但是,miR-133a,miR-208a或miR-499-5p没有调节CXCR4 3'UTR报告基因的活性,表明它们可能通过与3'UTR不相关的机制调节CXCR4表达。总体而言,这些数据表明,myo-miRs在体外抑制BM-MNC和MSC中CXCR4的表达,暗示了BM PC动员的潜在功能。
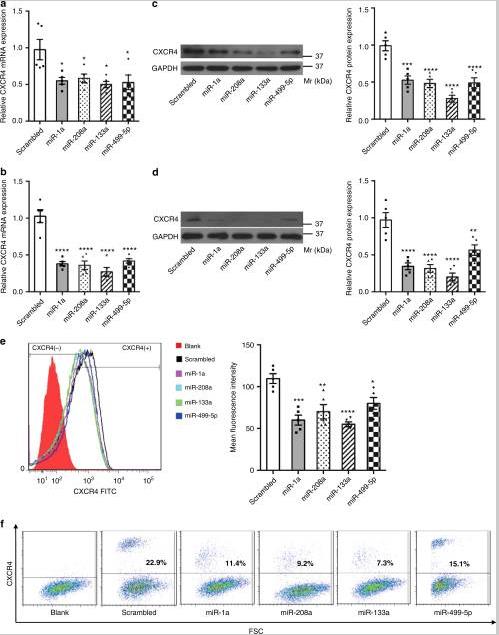
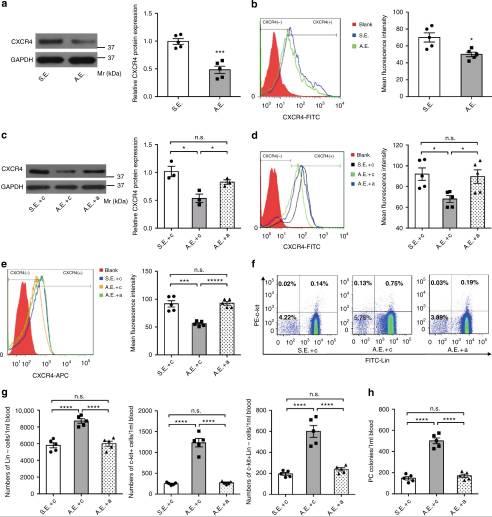
4、Myo-miRs的外体转移下调BM-MNCs中的CXCR4
将BM-MNC与从AMI或Sham小鼠分离的外泌体培养24小时。CXCR4的表达在用AMI小鼠的外泌体处理的BM-MNCs中显着降低,但在用Sham小鼠的外泌体处理后却没有降低。与myo-miRs特异性抑制剂共同治疗消除了AMI外泌体介导的CXCR4表达下调,表明该作用对myo-miRs具有特异性。在用来自AMI小鼠的外泌体治疗的小鼠的BM-MNCs(AMI-外泌体)中,CXCR4表达水平显着降低,而如果将外泌体供体小鼠用antagonomirs预处理,则该降低会减少。c-kit +,Lin –和Lin – c-kit +在用AMI外泌体处理的小鼠中,PB的细胞显着增加,但用antagomir预处理的小鼠(Antagomir-AMI外泌体)的Sham外泌体或AMI外泌体却没有增加。结果表明,外来体介导的myo-miRs转移下调了BM-MNC中的CXCR4表达,并有助于BM PC的动员。
好了这篇文献看完了,下回小编接着带大家看点别的,再见!






