Bcl-2通过GSDMD和MLKL分别调节pyroptosis和necroptosis
凋亡(apoptosis)是一种细胞控制的程序性细胞死亡方式,在维持内环境稳态、发育过程中发挥着重要作用。凋亡水平下调能导致癌症的发生,而上调则与感染、神经退行性疾病和自身免疫性疾病密切相关。在细胞调节凋亡的分子机制中包含intrinsic pathway和extrinsic pathway。Intrinsic pathway又称线粒体凋亡通路,是已Bcl2蛋白家族为调节核心的凋亡调节通路。根据功能和Bcl2 homology (BH) domains的组成,Bcl-2家族蛋白可分为三类。第一类:抗凋亡Bcl2蛋白,含结构域BH1、BH2、BH3、BH4,如Bcl-2、Bcl xl,通过与促凋亡成分直接作用抑制细胞凋亡。第二类:促凋亡蛋白Bax和Bak,含结构域BH1、BH2、BH3,直接参与MOM穿孔反应。第三类:BH3-only蛋白,如Bid、Bim、PUMA,能直接激活凋亡。在没有上游凋亡信号的情况下,抗凋亡蛋白与促凋亡蛋白结合进而抑制它们的激活。而在激活信号如生长因子缺失、辐射或毒素的刺激下,凋亡信号激活并引发下游caspase-9的激活,进而激活凋亡级联反应。
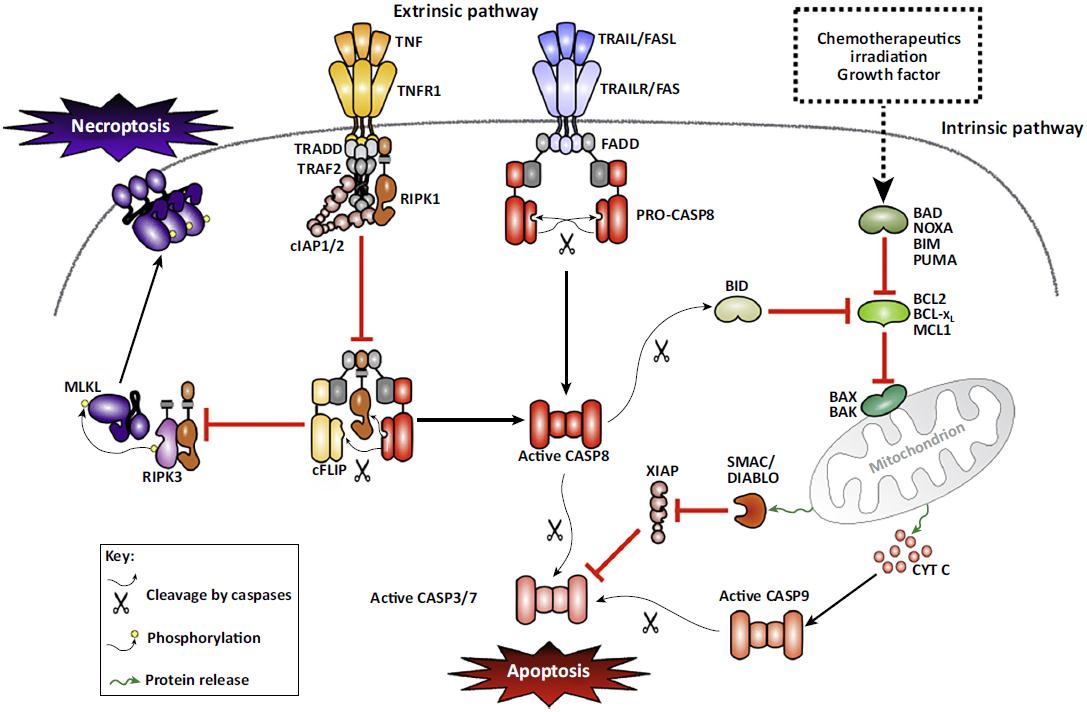
图1 凋亡信号通路[1]
新的研究鉴定了人体中caspase-1, 4 or 5以及小鼠中 caspase-1 and 11的底物GSDMD,被剪切的GSDMD的30kD的N-terminal domain激活了一种新的细胞死亡方式,焦亡(pyroptosis)[2]。坏死性凋亡(necroptosis)是由RIP1/RIP3/MLKL信号通路调节的死亡方式, MLKL的磷酸化活化转移至细胞质膜上是其激活的核心。
近期发表于Cell Death Discovery上的一文研究了三者间是否存在共同的调节作用[3]。该文作者提出问题:Bcl-2抑制凋亡的同时,是否也调节其他的细胞死亡方式?

图2 Bcl-2与GSDMD的BH3-like domain相互作用
作者首先通过序列分析指出GSDMD的N端含有BH3-like结构的特征序列:Hy-xxx-Hy-K/R-xx-Small-D/E-x-Hy。通过内源性IP、截短验证、体外pull-down实验,作者证明了Bcl-2能与GSDMD的N端直接结合。此外,作者也鉴定了GSDMD-L150Q和Bcl-2 G145A在两者相互作用中的核心作用。如图2所示。进一步的研究指出该结合能抑制caspases 1、4、5剪切GSDMD形成30kD的N-terminal片段。有趣的是,Bcl-2的作用下,GSDMD形成一种10kD左右的N端剪切体。生化实验表明该剪切形式是发生在GSDMD D87位点。虽然体内实验表明Bcl-2抑制GSDMD的D275剪切并促进D87剪切的发生,但体外实验显示Bcl-2也抑制caspase-3对GSDMD的D87剪切作用。在功能研究中中,作者指出Bcl-2的水平影响NLRP3介导的炎症激活。
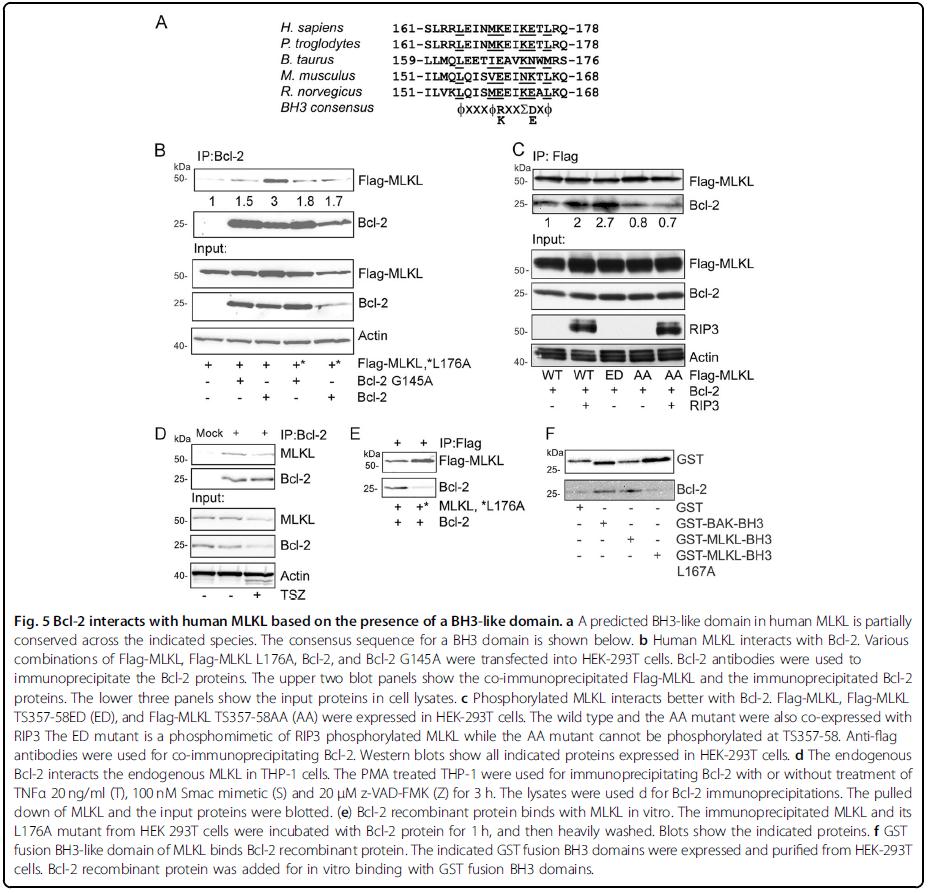
图3 Bcl-2与MLKL的BH3-like domain相互作用
在MLKL的165-176氨基酸中,作者也分析发现了BH3-like domain。体内外的实验也证明了Bcl-2与MLKL的BH3-like domain直接相互作用。如图3所示。而该作用能抑制RIP诱导MLKL的磷酸化和寡聚化。功能研究中,Bcl-2能抑制TSZ处理诱导的HT-29细胞坏死性凋亡。
最后,作者指出:这并不是Bcl-2与非Bcl2家族蛋白的BH3-like domain结合的首次报道。也有报道指出Bcl-2与Beclin-1的BH3-like domain结合并抑制自噬[4]。这项研究展示了两个新的实例。
参考文献:
1.Brumatti, G., et al., 'Did He Who Made the Lamb Make Thee?' New Developments in Treating the 'Fearful Symmetry' of Acute Myeloid Leukemia. Trends Mol Med, 2017. 23(3): p. 264-281.
2.Shi, J., et al., Cleavage of GSDMD by inflammatory caspases determines pyroptotic cell death. Nature, 2015. 526(7575): p. 660-5.
3.Shi, C.-S. and J.H. Kehrl, Bcl-2 regulates pyroptosis and necroptosis by targeting BH3-like domains in GSDMD and MLKL. Cell Death Discovery, 2019. 5(1).
4.Pattingre, S., et al., Bcl-2 antiapoptotic proteins inhibit Beclin 1-dependent autophagy. Cell, 2005. 122(6): p. 927-39.






