Ferrostatin-1抑制铁死亡的机制
铁死亡是一种由铁和脂质氢过氧化物引发的细胞死亡,并由GPx4预防。 (Fer-1)比酚类抗氧化剂更有效地抑制铁死亡。先前对Fer-1抗氧化效率的研究采用了动力学试验,其中重氮化合物产生被抗氧化剂清除的氢过氧自由基。然而,这种反应,考虑到断链效应,对于描述亚铁和脂质氢过氧化物依赖的过氧化的抑制作用帮助很小。
最近,一篇名为“Insight into the mechanism of ferroptosis inhibition by ferrostatin-1”的文章在杂志Redox Biology上发表,阐述了在亚铁存在的情况下,GPx4和Fer-1通过不同的机制产生最相关的抗铁死亡效应,即起始脂质氢过氧化物的消失。

摘要:
通过清除脂质氢过氧化物自由基,产生脂质氢过氧化物,亚铁引发新的过氧化链式反应。研究者们发现,当Fer-1抑制脂质体中由铁和微量脂质氢过氧化物引发的过氧化反应时,由预先存在的微量氢过氧化物产生的氧化物的模式实际上与在没有抗氧化剂的情况下观察到的彻底过氧化后观察到的模式相同。这支持了Fer-1的抗铁死亡活性实际上是由清除脂质过氧化氢生成的亚铁与其它重排产物所产生的烷氧基自由基的观点。值得注意的是,Fer-1在抑制铁依赖的脂质过氧化的同时不被消耗。新出现的概念是,是亚铁本身减少了Fer-1自由基。这一点得到了电分析证据的支持,即Fer-1与铁形成复合物,并通过钙黄绿素的荧光在细胞中进一步证实,表明Fer-1的存在降低了不稳定的铁。通过量子力学计算,还研究了铁抑素-铁配合物的伪催化循环的概念,证实了Fer-1还原烷氧基自由基模型和亚铁还原Fer-1自由基。
技术总结:

一. Ferrostatin-1和trolox具有明显不同的脂质过氧化抑制效率,而具有相同的断链抗氧化作用
比较trolox和Fer-1的抗氧化能力:I)产生脂质过氧化氢自由基的重氮化合物;II)抗坏血酸亚铁从脂质体中存在的微量脂质过氧化氢引发过氧化反应。将含有0.1 mM磷脂的挤出脂质体分散体(SLPC 18:0/18:2和SLPE 18:0/18:2,比例1:1)引入氧合细胞,并在存在FER-1或trolox的情况下与空气平衡。通过添加:ABIP或FeSO4-抗坏血酸启动过氧化。
图1A表明,在ABIP存在的情况下,Fer-1和trolox具有相同的断链能力(IC50分别=1.66μM和1.86μM,图1C)。相反,当Fe2+引发过氧化时,FER-1比trolox更有效(IC50分别=0.017μM和7.2μM,图1B和C)。结论:在模拟FT中发生的脂质过氧化模型中,脂质氢过氧化物自由基的清除效率并不反映抗氧化能力。
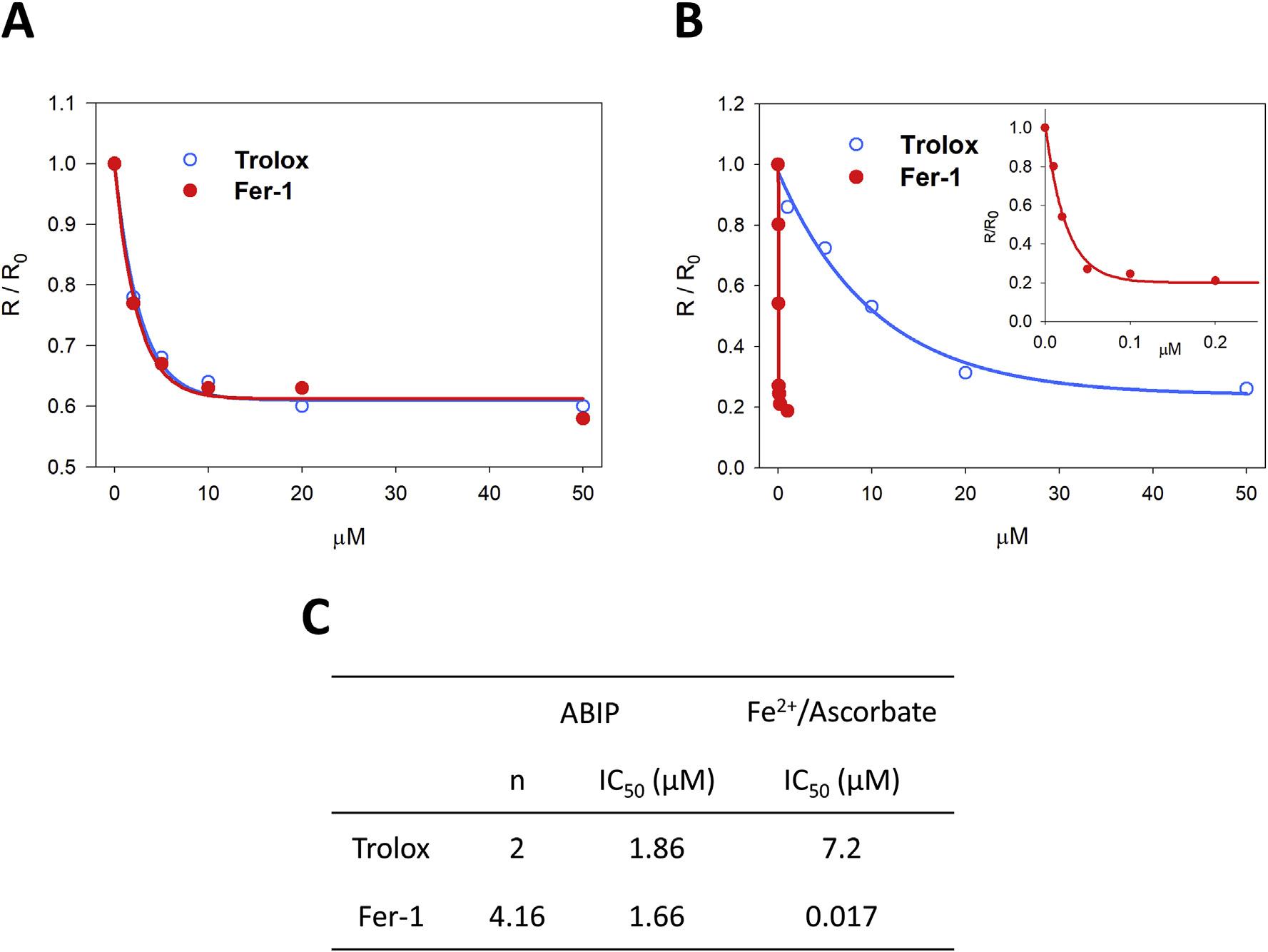
图一:铁或重氮在脂质体中诱导脂质过氧化的抑制。初始耗氧速率比R/R0与Trolox(蓝色空心圆)和FER-1(红色实心圆)浓度的关系符合Eq方程。含有0.1mM磷脂(SLPC:SLPE/1:1),不同量的trolox或Fer-1的脂质体溶液被8 mM ABIP(A组)或30μM抗坏血酸和4μM FeSO4(B组)在0.1MTris,0.15MKCl,pH7.0,在37°C时氧化。报告(C)从面板A和B计算的IC50值。
二. 脂质氧化产物的脂质组学分析
鉴定基于MS/MS光谱,结合保留时间。作为基本参考化合物,使用ALOX15产生的氢过氧化物,并用Gpx4-GSH还原。表1报告了检测到的最相关(>0.1%)氧化物种的列表。
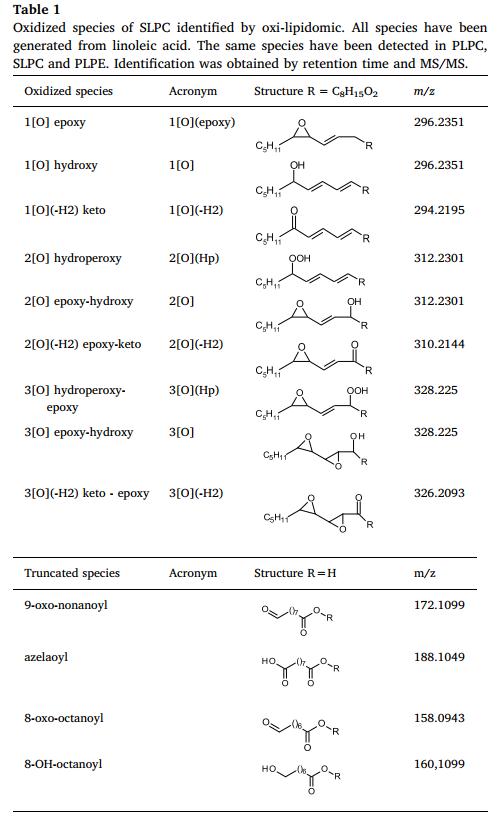
表一:用氧化脂质组学鉴定SLPC的氧化种类。所有物种都是由亚油酸产生的。在PLPC、SLPC和PLPE中检测到相同的物种。通过保留时间和MS/MS进行鉴定。
当脂质体被重氮化合物或Fe2+过氧化时,脂质过氧化产物的模式有很大的不同。30分钟后,约20%的磷脂被氧化修饰,氢过氧化物占重氮化合物氧化产物的70%,而铁引发的过氧化物不超过30%。
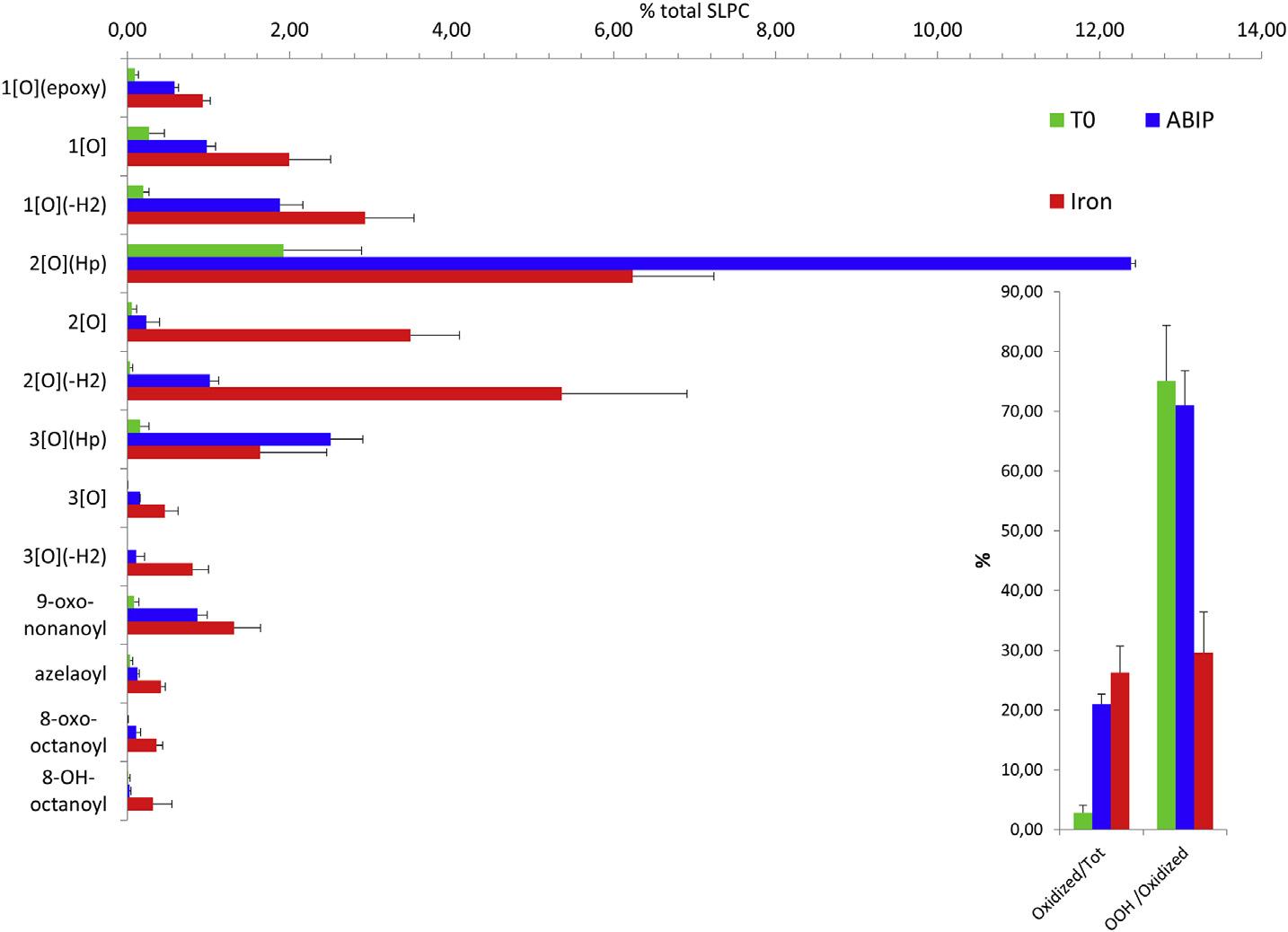
图二:重氮化合物或Fe2+/抗坏血酸诱导的脂质氧化模式。在时间0(T0)和用ABIP8 mM或Fe2+4μM加抗坏血酸30μM孵育30分钟后,测量相对于1-硬脂酰基-2-亚油酰基-sn-甘油-3-磷脂啉(SLPC)的含有0.1 mM磷脂的新鲜脂质体悬浮液(SLPC:SLPE/1:1)的氧化脂质模式。在插图中总结了总氧化种类占SPLC总量的百分比(左)和脂氢过氧化物占氧化种类总数的百分比(右)。数值代表20个独立实验的平均±标准偏差。
当Fe2+引发过氧化时,30分钟后脂质氢过氧化物仍是主要的脂质过氧化产物,但也产生大量的环氧酮、环氧羟基、酮、羟基、环氧氢过氧化物。Fe2+诱导的脂质过氧化的时间过程(图3A)显示所有的过氧化产物逐渐增加,而脂质体制剂中最初存在的脂质氢过氧化物(t=0)在暴露于Fe2+时突然减少,然后逐渐增加。这一结果完全符合脂质烷氧基自由基引发脂质过氧化的机制。当铁依赖的脂质过氧化被FER-1抑制时(图3B),脂质体中存在的脂质氢过氧化物消失,产生一系列氧化物种,其模式与不抑制过氧化时观察到的模式相同(图3A)。这一证据与fer1最相关的反应是清除激活脂质过氧化的PL-O•的观点一致。相反,对PL-OO•的清除,即断链效应,与增殖竞争,但也稳定了可逆的氧添加,生成新的过氧化氢,铁由此引发新的过氧化链反应。
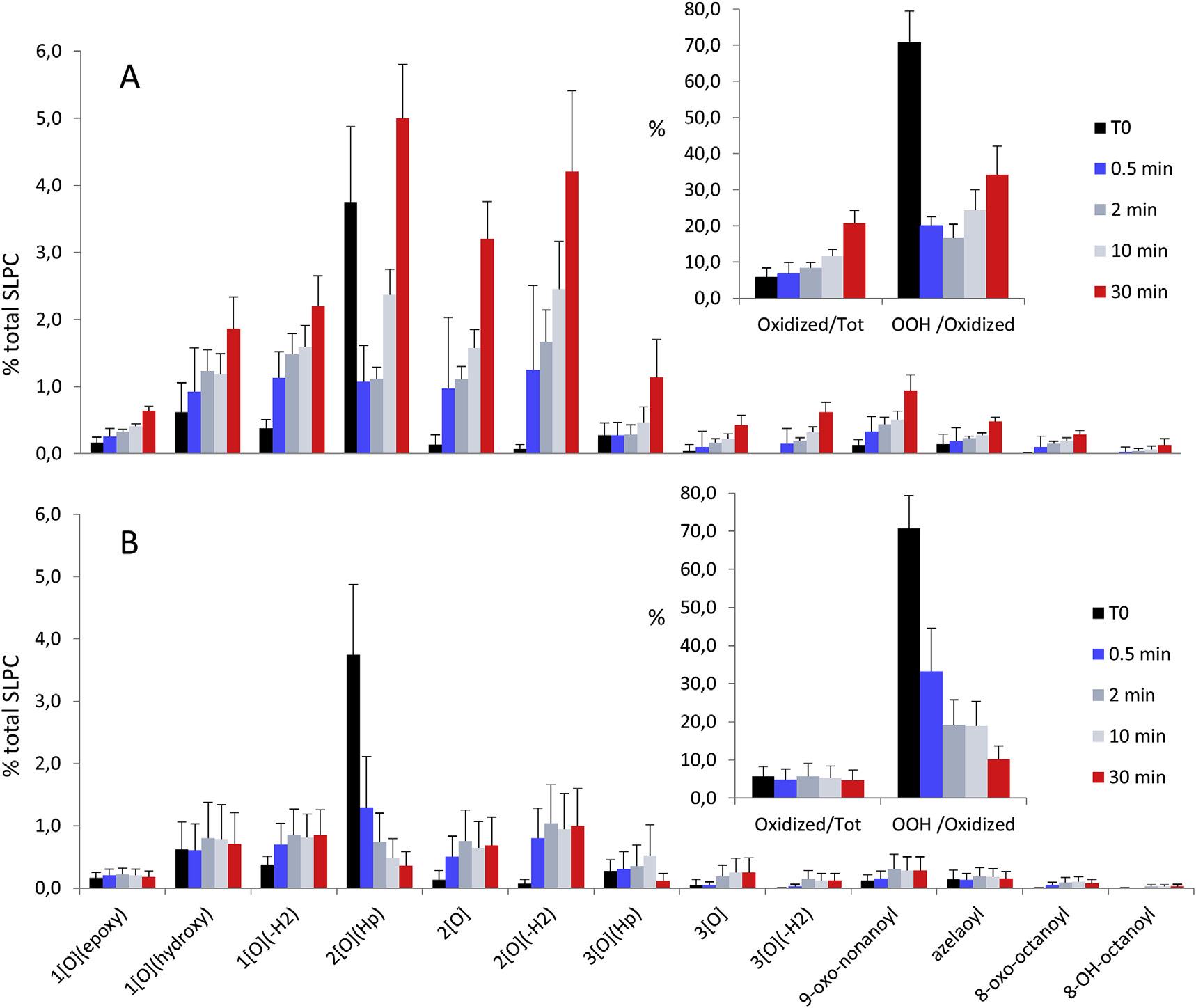
图三:Fe2+诱导SLPC氧化模式的时间进程,以及Fer-1效应。含有0.1mM磷脂(SLPC:SLPE/1:1)的脂质体悬浮液与Fe2+4μM和抗坏血酸30μM在不存在(A)或存在(B)0.5μM FER-1的情况下孵育30分钟。在添加前(T0)和添加后0.5,2,10,30分钟提取样品。在插图中,总结了总氧化种类占SPLC总量的百分比(左)和脂氢过氧化物占氧化种类总和的百分比(右)。数值表示3个独立实验的平均±标准偏差。
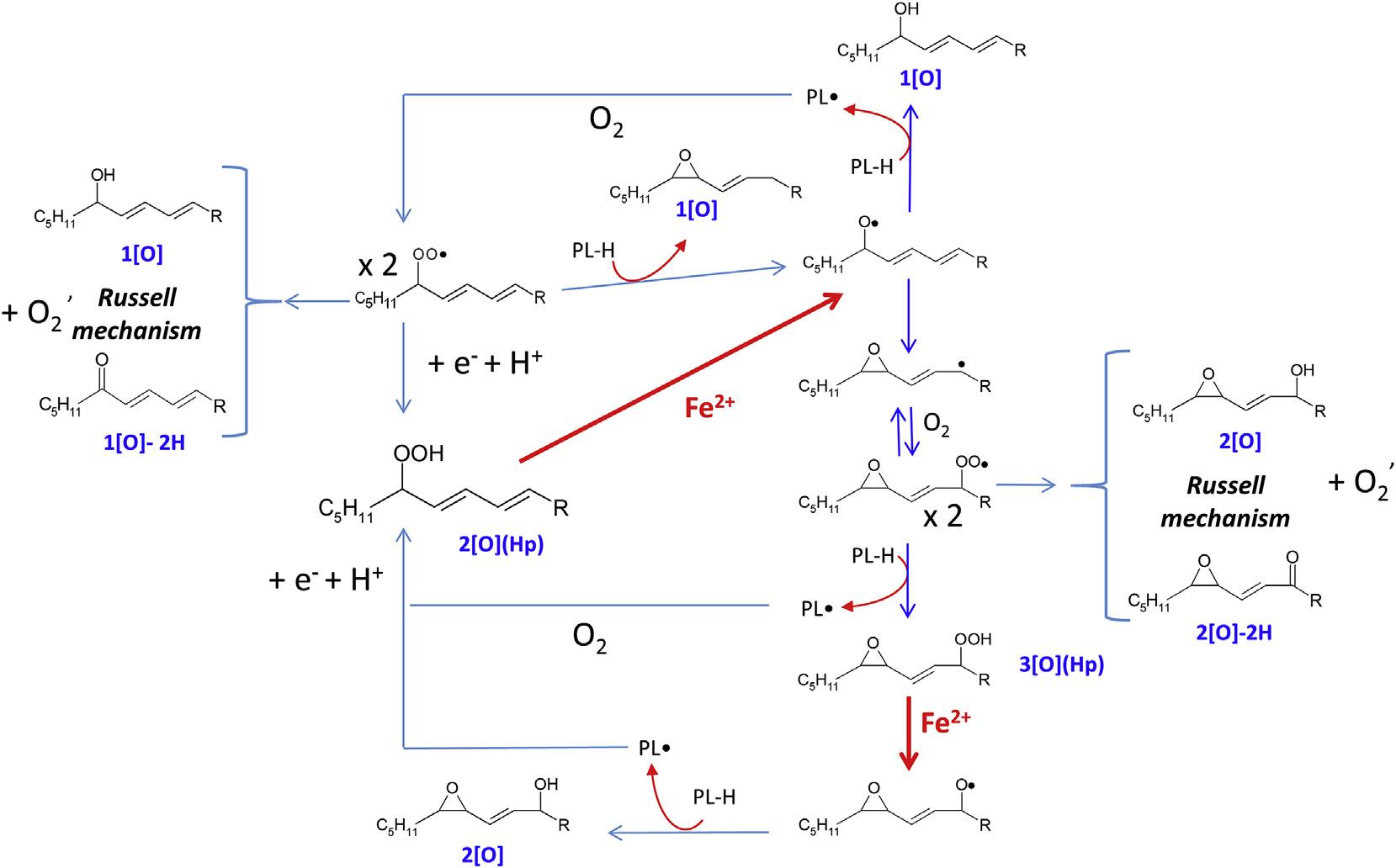
图四:Fe2+诱导脂质过氧化机制的示意图。
三. Ferrostatin-1可以抑制过氧化反应而不被消耗
Fer-1在抑制铁诱导的过氧化时没有被消耗。0.5μM FER-1在铁驱动的过氧化氢分解过程中不消耗,即使在存在15μM脂质氢过氧化物的情况下也是如此(图5)。假设:与烷氧基相互作用产生的fer1自由基可以被还原回来。验证:亚铁是这个反应中的电子供体。首先通过电分析测量Fer-1与铁的相互作用,然后通过量子力学计算氧化还原过程的能量学来验证该假设。其次,通过钙黄绿素荧光证实了Fer-1与铁在细胞中形成复合物。
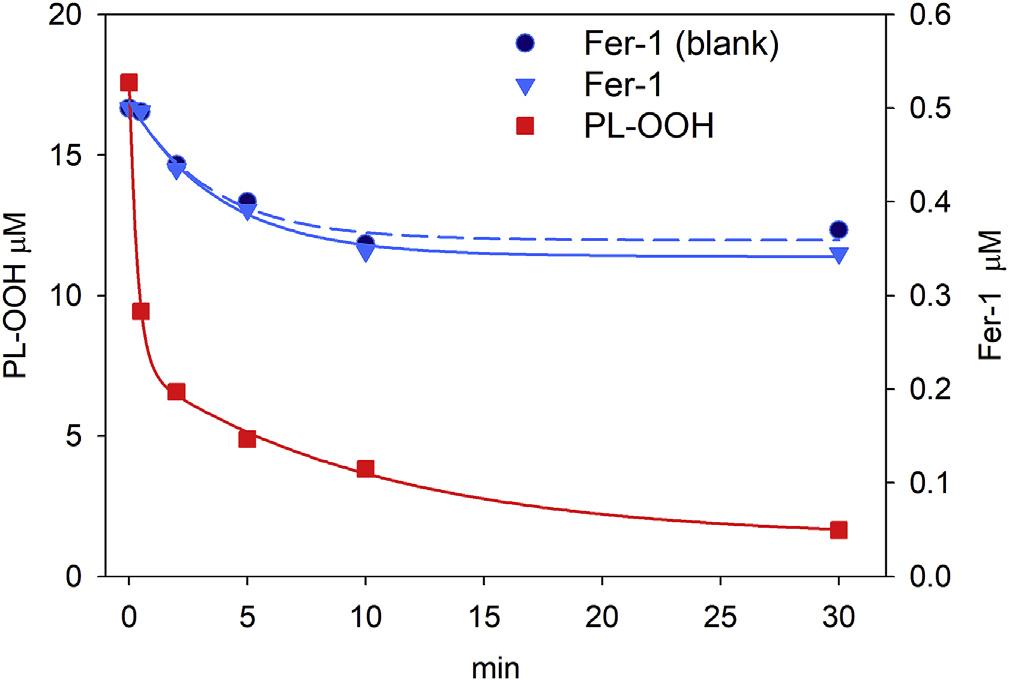
图五:脂质过氧化分解和铁存在下的Fer1消耗。含有0.1mM磷脂(SLPC:SLPE/1:1)的溶液在pH7.4的0.1MTris,0.15MKCl中,通过用Alox15预处理60min富集氢过氧化物,在37℃下用0.5 μMFer-1,30μM抗坏血酸和4μMFeSO4处理。用质谱对总PL-OOH(s正方形■) 和FER-1(三角形▼) 的时间过程进行了定量。空白是缓冲区中的FER-1(圆形●).
四. Fer-1与铁相互作用的电分析
在90%甲醇和LiClO4缓冲液(0.1M)中进行微分脉冲伏安法(DPV)测量。将Fe2+或Fe3+逐步加入到100μM FER-1,并记录产生的电流。在铁的存在下,FER-1的两个氧化峰都向更正的电位(阳极位移)移动(图6A和B)。峰电位的这些位移(ΔVP=VpFer-1+Fe-VpFer-1)取决于FER-1/Fe比率,满足预期的饱和动力学(图6C和D)。得到的双曲线方程与实验数据吻合较好。
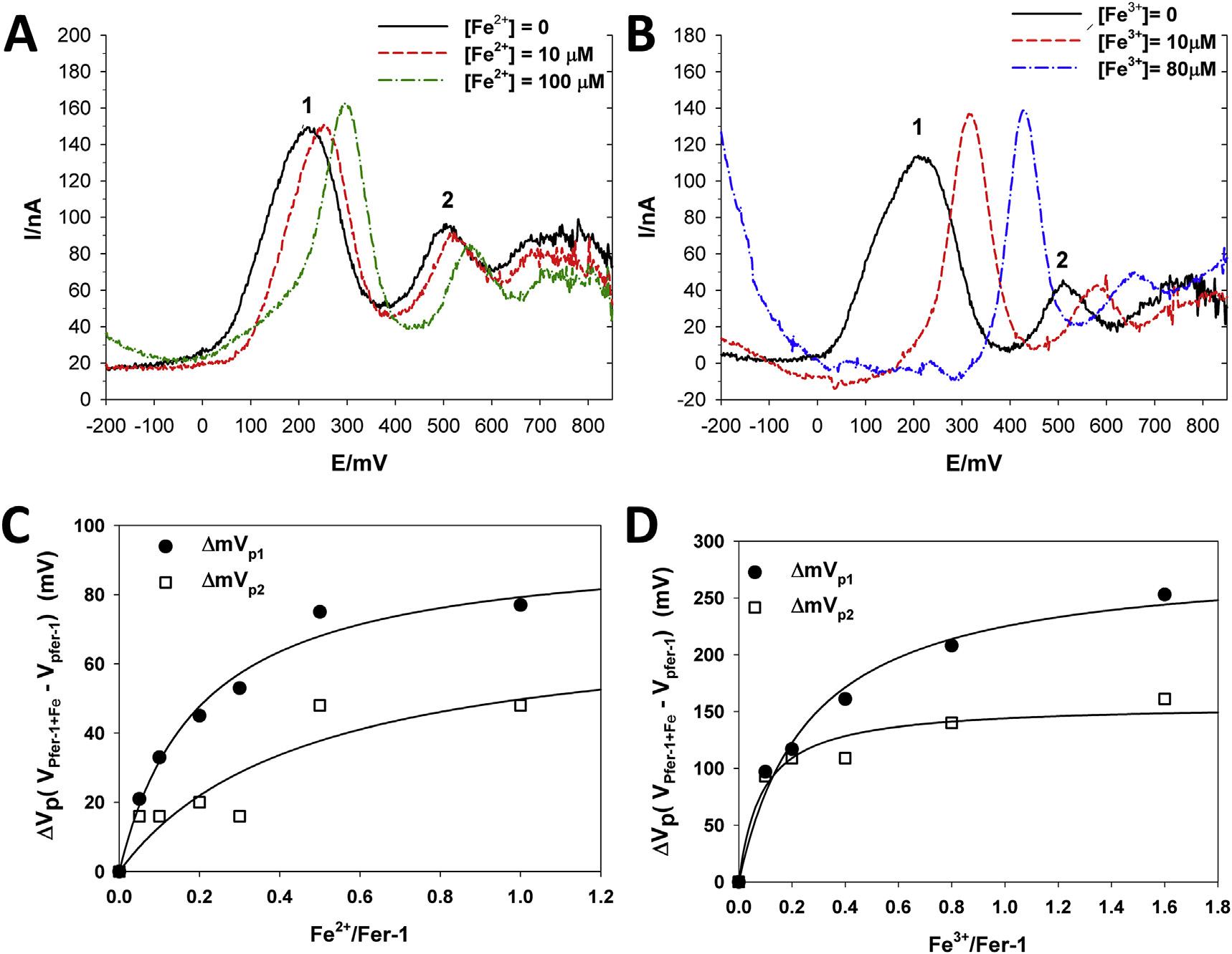
图六:铁和亚铁离子对fer-1阳极峰值电位值的影响。在没有和存在不同的亚铁(A)和铁离子(B)离子浓度的情况下,Fer-1的微分脉冲伏安图显示了由铁引起的fer-1峰电位值的阳极移动。示出了峰电位(ΔVp=VpFer-1+Fe-VpFer-1)在Fe2+/FER-1(C)和Fe3+/FER-1(D)上的移动图;连续线是通过非线性回归分析对实验数据进行双曲线方程最佳拟合的结果。
五. Fer-1的氢原子转移(HAT)机制
DFT分析表明,FER-1可以通过N个孤对与铁结合。在模型中,配位球被三个Cl阴离子饱和,因此总分子电荷为-1。值得注意的是,因为只有仲胺N与铁结合,所以配合物是四配位的(图7A)。它的电子基态是五重奏,特征是四个电子在金属中心平行自旋。该配合物可以通过氢原子转移(HAT)机制减少自由基。在计算分析中,分别使用CH3O·和CH3OO·作为脂烷氧基和氢过氧自由基(PL-O·和PL-OO·)的模型。在仲胺N位上的自由基形成比在伯胺N位上更稳定。通过分子内电子转移,铁(II)被氧化成铁(III),N原子带负电荷。在这个复合体中,总的多重性是一个六重体,并且五个未配对的电子定位在铁的中心上。随后,在与水分子反应时,FER-1被质子化,形成五配位配合物(图7B)。Gibbs自由反应能表示在苯和水中计算的驱动HAT从FER-1进行自由基还原的整个过程的热力,以分别模拟非极性和极性环境,分别为48.3和10.9kcal mol-1(指CH3OO·自由基)和28.3和-9.1 kcal mol-1(指CH3O·自由基)。这表示FER-1的清除能力及其对烷氧基而不是氢过氧自由基的偏好(图7C)。
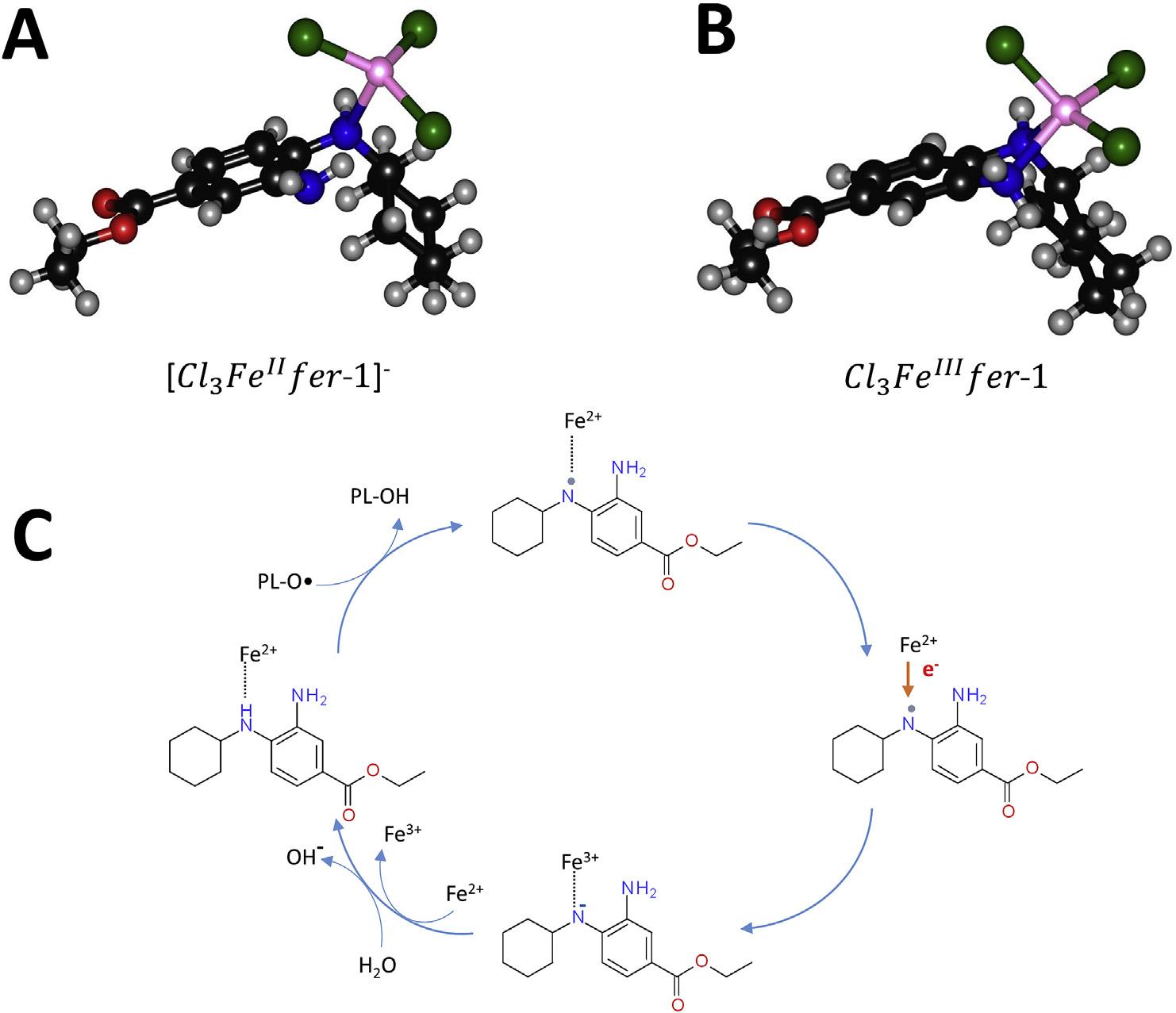
图七:在M06-L/6-31G(d,p),LanL2DZ理论水平上,对铁抑素-1铁配合物的分子结构进行了全面优化。Fer-1/FeII(A)和Fer-1/FeIII(B)复合物分别示于(A)和(B)中。在(C)中,描绘了FER-1清除脂质烷氧基自由基(PLO·)和亚铁还原减少fer-1自由基的示意图。
六. Ferrostatin-1减少细胞中不稳定的铁库
基于细胞化学钙黄绿素-AM(钙黄绿素-乙酰氧基甲酯)法测定细胞“不稳定铁池”(LIP)的尺寸。以DMSO为对照,增加fe -1的浓度以加入测定。为了证明该程序的有效性,以100μM deferasirox作为阳性对照。与完全消除细胞LIP的铁螯合剂不同,20μM Fer-1有效地降低不稳定的铁库浓度不超过50%(图8)。这一结果,连同通过DVP和DFT获得的证据,支持了Fer-1可以与至少部分细胞LIP相互作用的观点。这进一步证实了Fer-1与铁形成络合物的结论,并间接支持了Fe2+还原FER-1自由基的理论机制证据。
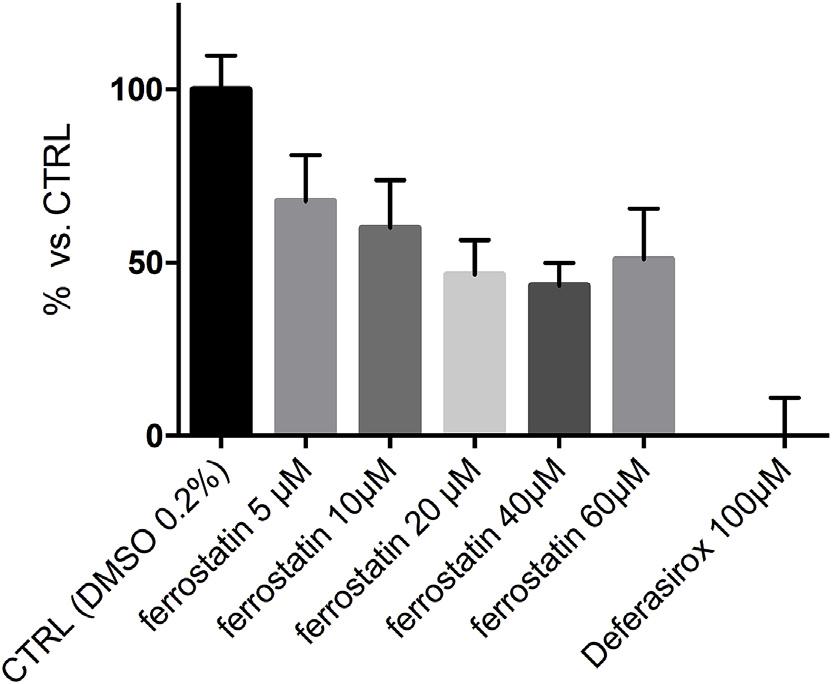
图八:Fer-1结合不稳定铁池(LIP)的铁。对于对照组,处理细胞的相对LIP表达为钙黄绿素平均荧光强度(MFI)。以Deferasirox 100μM孵育的细胞为基线。数值为2个实验的平均±标准偏差(SD),一式三份。






