神经肽VIP通过调节ILC3活性激活肠道粘膜免疫
神经肽血管活性肠肽(VIP)通过调节3型先天性淋巴样细胞(ILC3)活性赋予肠道粘膜免疫力,这一成果由澳大利亚维多利亚墨尔本大学Gabrielle T. Belz、Cyril Seillet等研究人员合作完成。2019年12月23日, 《Nature Immunology》在线发表了这一最新研究成果“The neuropeptide VIP confers anticipatory mucosal immunity by regulating ILC3 activity”。IF=27.586 。该研究发现了ILC3s的功能在一天中不是恒定的,而是在活跃期和静止期之间振荡。肠内ILC3s的协同反应依赖于食物诱导的神经肽血管活性肠肽 (VIP)的表达。肠ILC3s具有高表达的G蛋白偶联受体血管活性肠肽受体2 (VIPR2),VIP激活显著增加了IL-22的产生和上皮的屏障功能。相反,通过VIPR2的信号缺失导致ILC3s生成IL-22的能力受损,并增加炎症诱导的肠道损伤的易感性。因此,内在细胞节律与食物摄入的循环模式协同作用,驱动IL-22的产生,并通过ILC3s中的VIP–VIPR2途径同步保护肠上皮。

结果一、ILC的细胞因子产生全天振荡
上皮细胞表现出转录调控的昼夜波动,可以暂时调控上皮的完整性29。为了研究ILC在胃肠道中的转录组和功能是否受到周期性调节,将C57BL/6小鼠饲养在严格的24小时暗光周期下(开灯12 h,开灯时间记为t 0),随意喂食。在体外用细胞刺激细胞后,在第4天(光照开始后4小时)和第16天(光照后4小时)分离出从小肠,肺和肠系膜淋巴结分离的ILC和其他淋巴细胞产生细胞因子的能力。佛波醇12-肉豆蔻酸酯13-醋酸酯(PMA)和离子霉素持续4.5小时。这些数据表明,在淋巴细胞中,ILC2和ILC3对时间调节特别敏感。
为了更好地了解IL-5和IL-22产生变异的性质,分析了这些细胞因子的离体表达,在t4,t10,t16和t23时在小肠和肺的ILC2s和ILC3s中没有进一步刺激。结果表明,ILCs在基因调控中表现出明显的周期性,特别是在肠粘膜免疫保护的关键基因中。
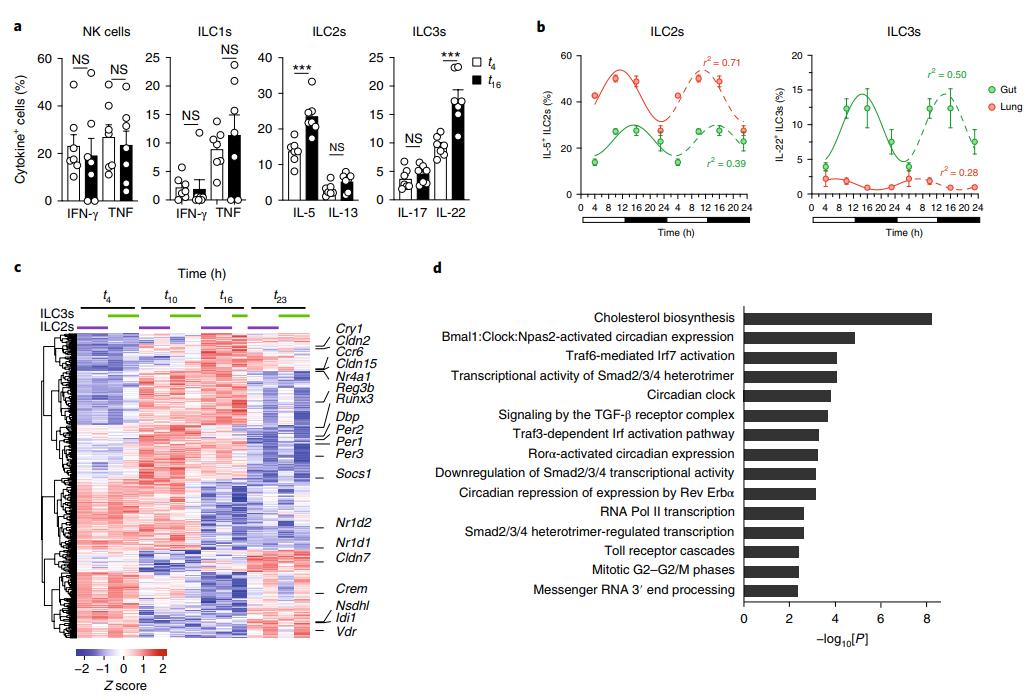
图1:野生型小鼠的ILC2和ILC3活性在稳态的活动和静止阶段振荡
结果二、内在的时钟基因部分调节ILC中的细胞因子
为了了解如何调节ILC功能的节律性,检查了生物钟基因Arntl的贡献,该基因在调节蛋白质(特别是细胞因子)的振荡产生中起着关键作用。 芳烃受体核转运子像蛋白1(ARNTL)有节奏地与DNA结合以激活核心时钟基因2的表达。 将来自野生型和Il7rCre×Arnt1 fl / fl小鼠的骨髓细胞的均等混合物(以下称为ArntlΔIL7R)混合在一起,这些混合物在所有淋巴样谱系中均有条件缺失Arnt1(数据未显示),注入经致死剂量照射的野生动物中 类型的收件人。结果表明,ARNTL对于IL-22的基础表达很重要,但是它仅部分控制ILC3中IL-22的节律性产生。
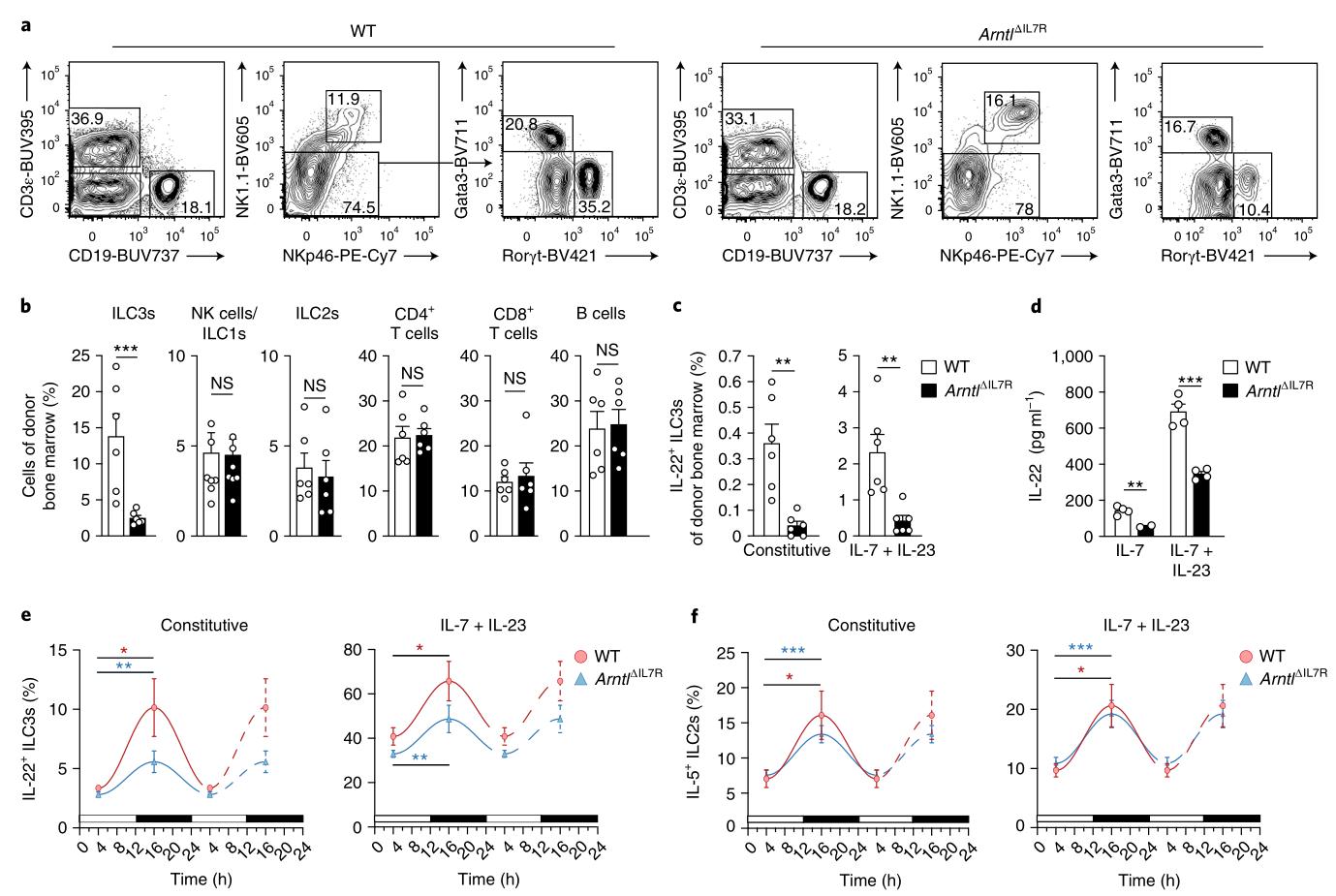
图2:分子钟仅部分调节细胞因子分泌的昼夜节律表达
结果三、热量摄入与ILC节律性同步
接下来,调查了肠外ILC3s中IL-22的节律性产生是否受外在因素调控。 首先,追踪了整个24小时明暗循环中的小鼠食物消耗。为了测试微生物群是否可能导致食物限制后ILC产生细胞因子的频率增加,对仅在黑暗阶段(t12 –t24)或光照阶段(t0 –t 12)喂养的野生型小鼠进行连续治疗, 在饮用水中使用抗生素2周。 对照小鼠不接受抗生素治疗,随意进食。 这些观察结果表明,与食物消耗有关的外在信号是小肠ILC3s局部调节IL-22产生的原因,而引流淋巴结或肺部的ILC3则不受影响。
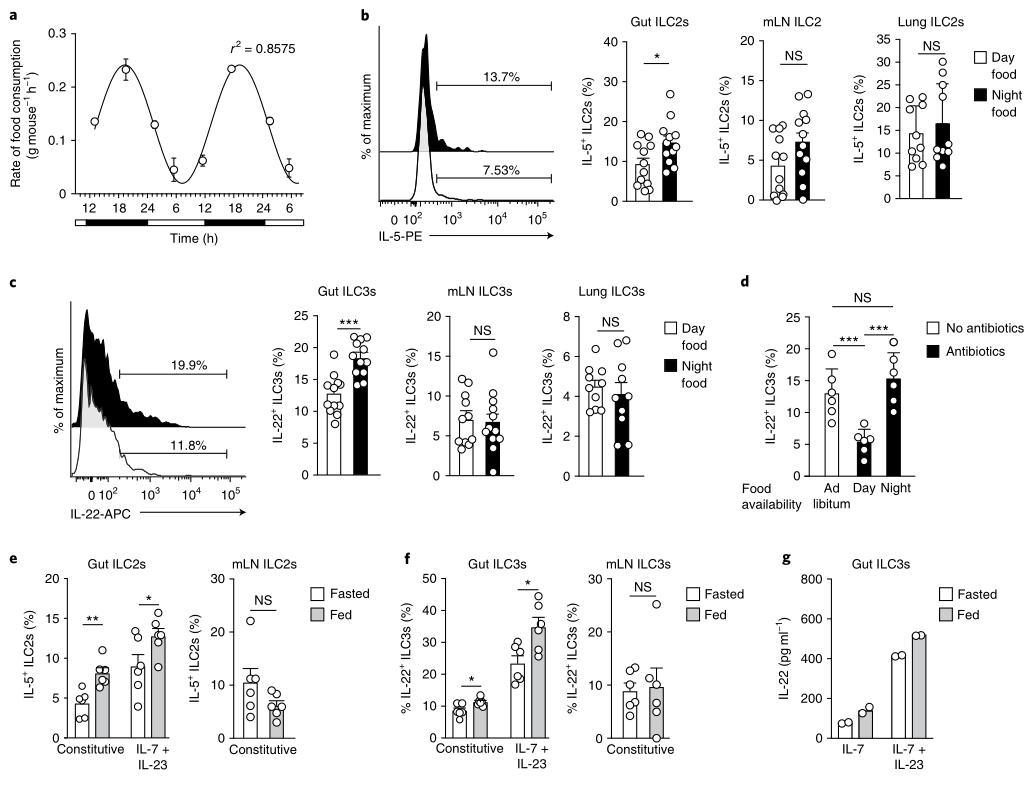
图3:食物摄入调节肠ILC2s和ILC3s的细胞因子分泌
结果四、肠ILC3表达神经肽受体VIPR2
为了阐明控制肠道ILC中观察到的组织特异性调控程序的机制,对来自小肠和野生型小鼠结肠的t-4时分选的Lin-CD127+ CD90+ ILC进行了单细胞RNA–Seq 在12小时的光照/ 12小时的黑暗周期中,随意进食。 使用t分布随机邻居嵌入(t-SNE)进行的数据分析34区分了8种。 因此,肠中的ILC3表达VIPR2,并位于VIP +神经元附近,在进食后频率增加而在禁食后减少。
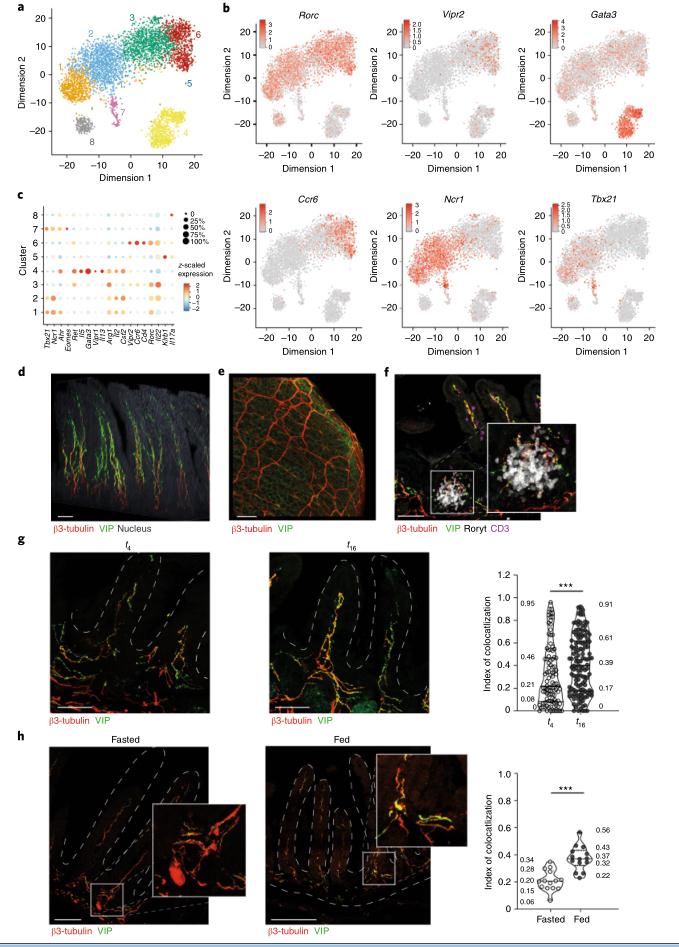
图4: 肠ILC3子集表达VIPR2,并位于表达VIP的神经元附近
结果五、饲养协调ILC3s中IL-22的产生
为了评估暴露于VIP是否在ILC3s中调节细胞因子的产生,刺激了从野生型小鼠固有层分离的CD45 +淋巴细胞,在存在或不存在VIP的情况下用IL-7和IL-23禁食16 h,持续4.5 h。模拟用cAMP直接刺激并激活蛋白激酶39的二丁酰环AMP(d-cAMP)被用作绕过VIPR2参与的阳性对照。这些发现表明,体外VIP信号传导可以通过在ILC3上直接激活VIPR2来增强IL-22的产生。接下来,腹膜内注射VIP或磷酸盐缓冲盐水(PBS)到野生型小鼠中,并在注射后2 h从小肠分析了Lin-Gata3+Rorγt-ILC2s和Lin-Gata3-Rorγt+ NKp46 +/- ILC3s。 Vipr2-/-小鼠的肠道ILC子集数量相似,包括CD4 +和CD4-ILC3,与野生型小鼠相比(扩展数据图7b)表明,VIPR2不是肠道中ILC3的发育或维持所必需的。因此,VIP–VIPR2轴推动了肠道ILC3s体内IL-22的分泌。
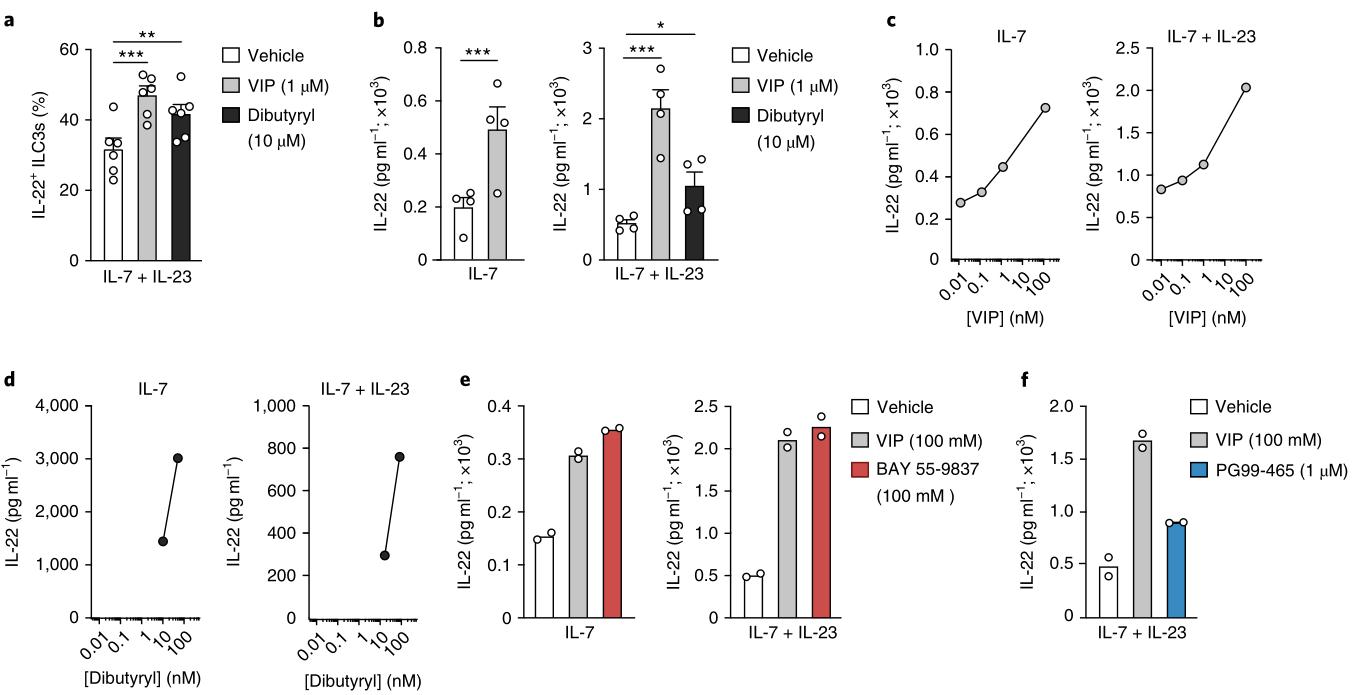
图5: VIP直接调节白细胞介素3产生的IL-22
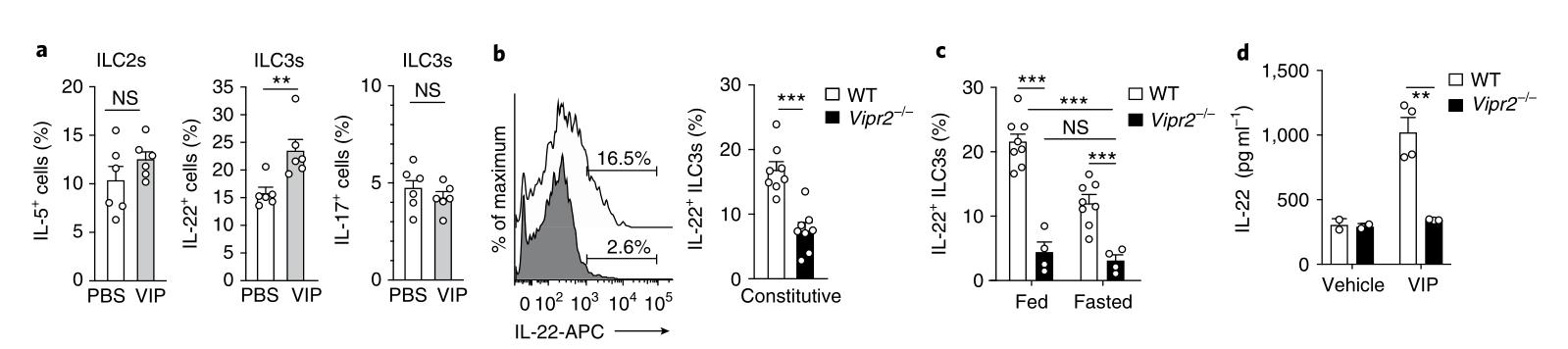
图6: VIPR2信号调节体内ILC3分泌的IL-22
结果六、ILC3s中的VIPR2维持上皮屏障
为了测试VIP是否在维持肠道上皮屏障中起作用,用低剂量的DSS(1.5%wt / vol)处理野生型和Vipr2-/-小鼠5 d。结果表明,尽管其他肠道淋巴细胞可能会导致Vipr2-/-小鼠肠道破坏的严重程度,但VIPR2+ ILC3在DSS诱导的炎症过程中对肠道上皮的保护具有重要作用。
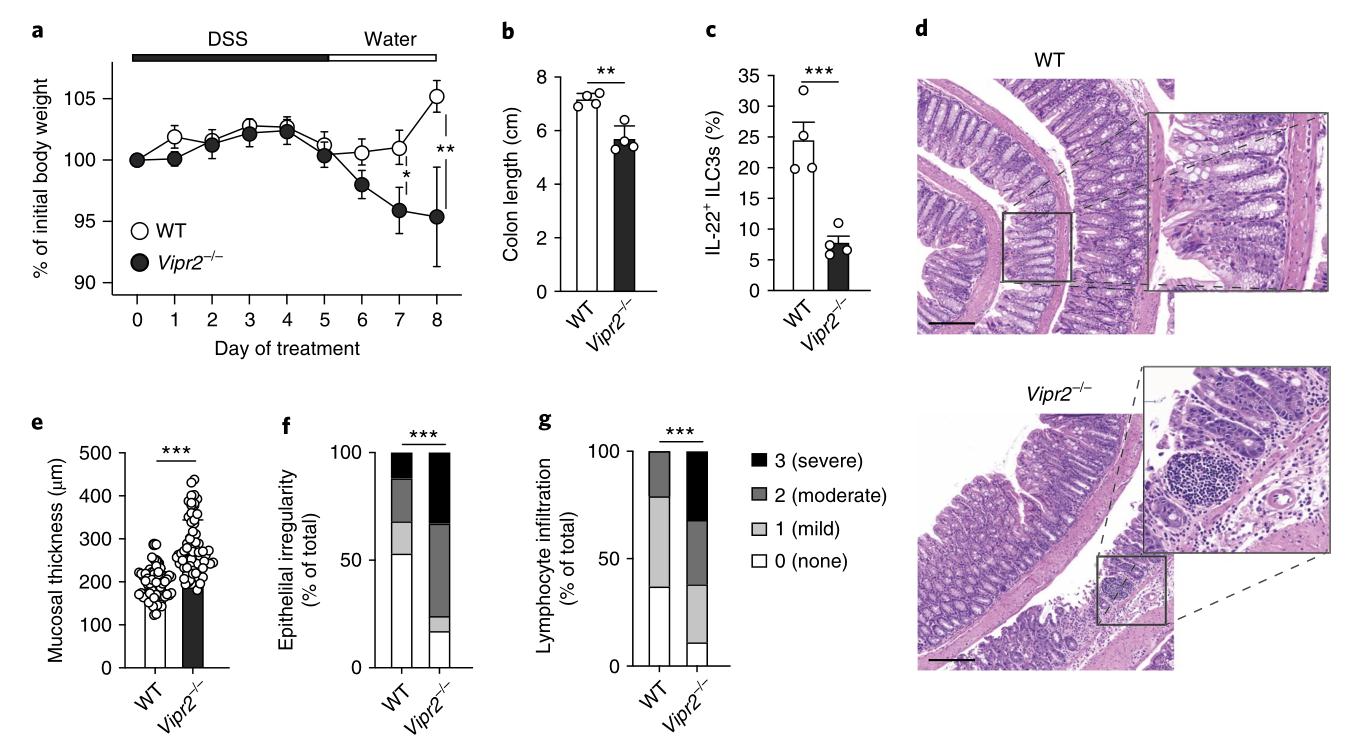
图7: VIPR2信号对于调节体内肠道完整性至关重要
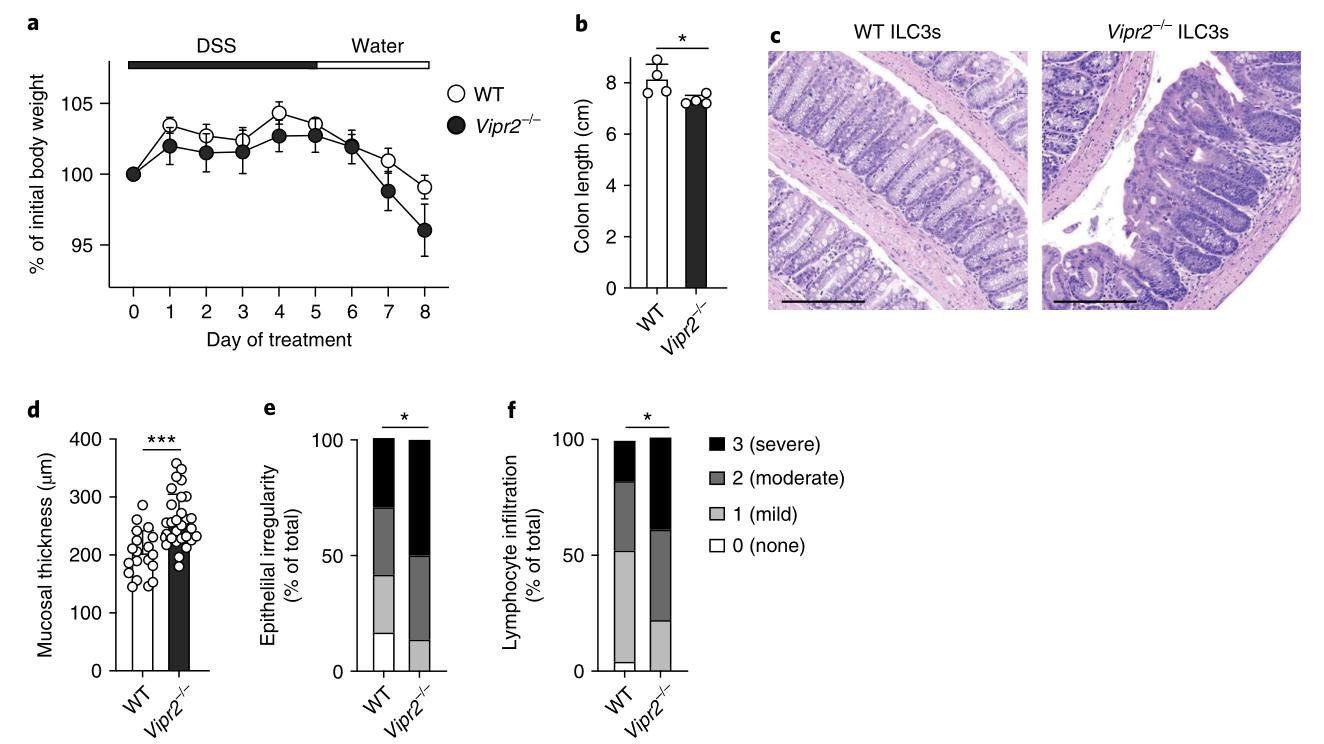
图8:VIPR2−/ −ILC3s提供保护免受DSS诱导的炎症
结论:
该研究确定了调节肠中IL-22表达的信号之一,并且可能在与IL-22相关的免疫病理学中也很重要。这些观察结果揭示了一些机制,这些机制将肠道中的保护性反应与肠道中的刺激性负荷相匹配,并可能协调体内稳态组织修复途径的诱导。






