MIR516A依赖自噬促进膀胱癌的发展
尽管MIR516A被报道在多种肿瘤中被下调并起到抑癌作用,但它的表达及其对膀胱癌(BC)的潜在作用尚不清楚。小编为大家介绍最近发表于“Autophagy”上的文章“Oncogenic role of MIR516A in human bladder cancer was mediated by its attenuating PHLPP2 expression and BECN1-dependent autophagy”。

我们发现MIR516A在人BC组织和细胞系中显著上调,而MIR516A表达的抑制减弱了BC细胞体外单层生长和体内异种移植瘤生长,并伴随着PHLPP2的表达增加。进一步的研究表明,MIR516A能够直接与PHLPP2 mRNA的3’-非翻译区结合。PHLPP2在MIR516A抑制细胞中的表达下调可能逆转BC细胞的生长,提示PHLPP2是MIR516A下游的一个介导因子,可能参与MIR516A的致癌作用。PHLPP2能间接介导BECN1/Beclin1的稳定,从而促进BECN1依赖性的自噬,抑制BC肿瘤细胞生长。此外,通过减弱MIR516A而增加的自噬导致了体内异种移植瘤形成的显著抑制。
结果:
1.MIR516A是BC细胞体外和体内生长必需的
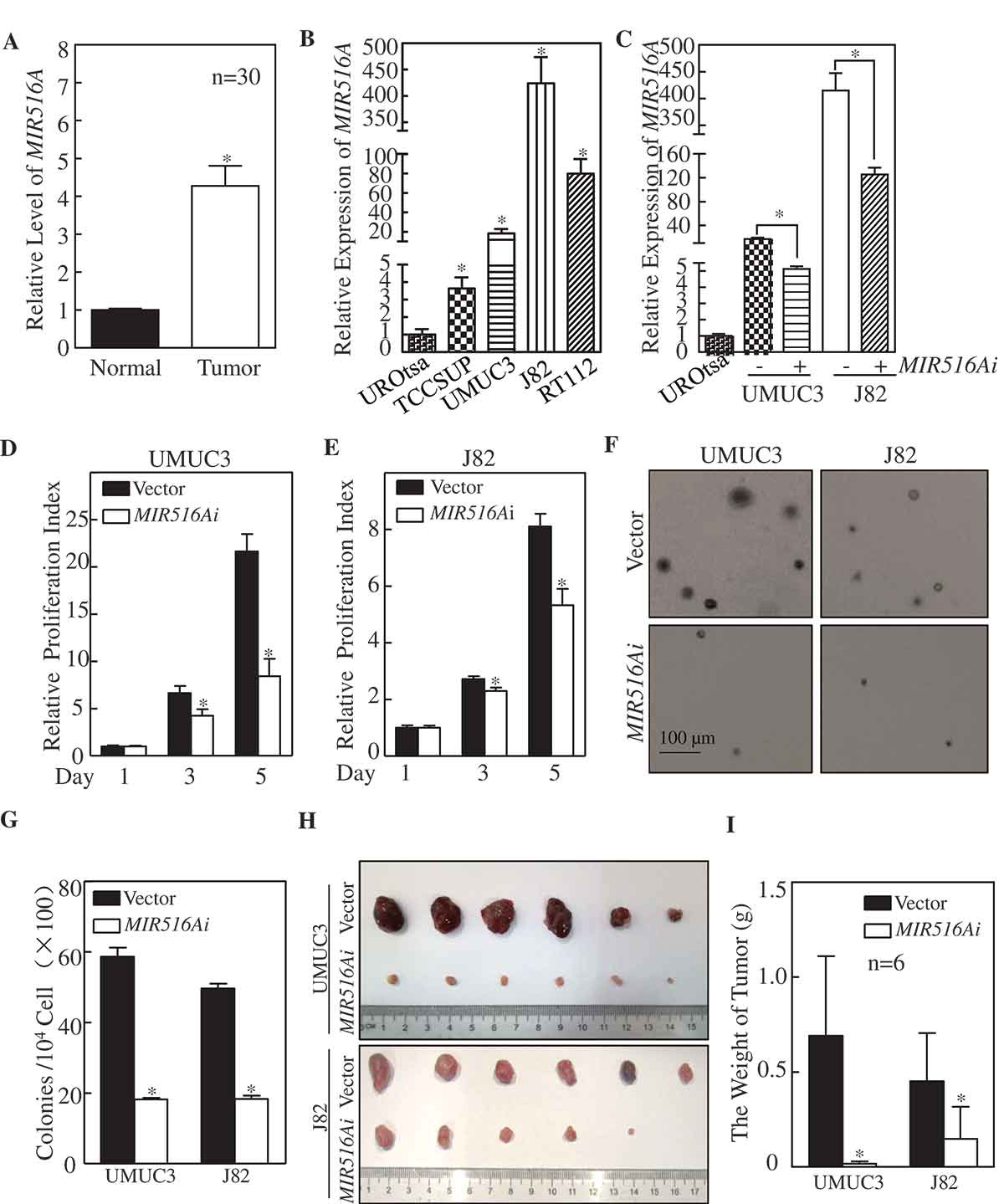
为了检测MIR516A在人BCs中的表达模式,我们采用定量PCR方法分析了MIR516A在新鲜临床BC组织中的表达。如图1A所示,MIR516A在BC组织中的表达显著高于配对的邻近非肿瘤组织。此外,我们还观察到MIR516A在人膀胱癌细胞系(TCCSUP、UMUC3、J82和RT112)中的过度表达,与在人永生正常尿上皮细胞系UROtsa中的表达相比(图1B)。为了确定MIR516A的上调是否在人BC的生长中起作用,我们将MIR516A海绵抑制剂(MIR516Ai)质粒稳定地转染到两个BC细胞系UMUC3和J82中。结果表明,海绵抑制剂结构显著降低MIR516A水平(图1C)。在相同的实验条件下,MIR516A的抑制作用显著地降低了UMUC3和J82细胞的单层生长(图1D,E),表明MIR516A促进了BC细胞的生长。软琼脂试验结果显示,抑制MIR516A也会损害UMUC3和J82细胞的锚定独立生长(图1F,G)。这些结果提示MIR516A不仅在人BCs中高表达,而且在BC细胞的生长中起致癌作用。除体外实验外,我们还评估了MIR516A对裸鼠移植瘤模型中J82和UMUC3细胞致瘤性的影响。结果表明,抑制MIR516A的表达也能抑制裸鼠移植瘤细胞株UMUC3的生长(图1H),UMUC3-MIR516A I组移植瘤的重量明显低于UMUC3载体对照组。MIR516A对J82细胞转染的异种移植BC细胞生长的调节作用也一样(图1H,I)。
2.MIR516A与PHLPP2 mRNA的3’ -UTR结合并下调其在人BC细胞中的蛋白表达
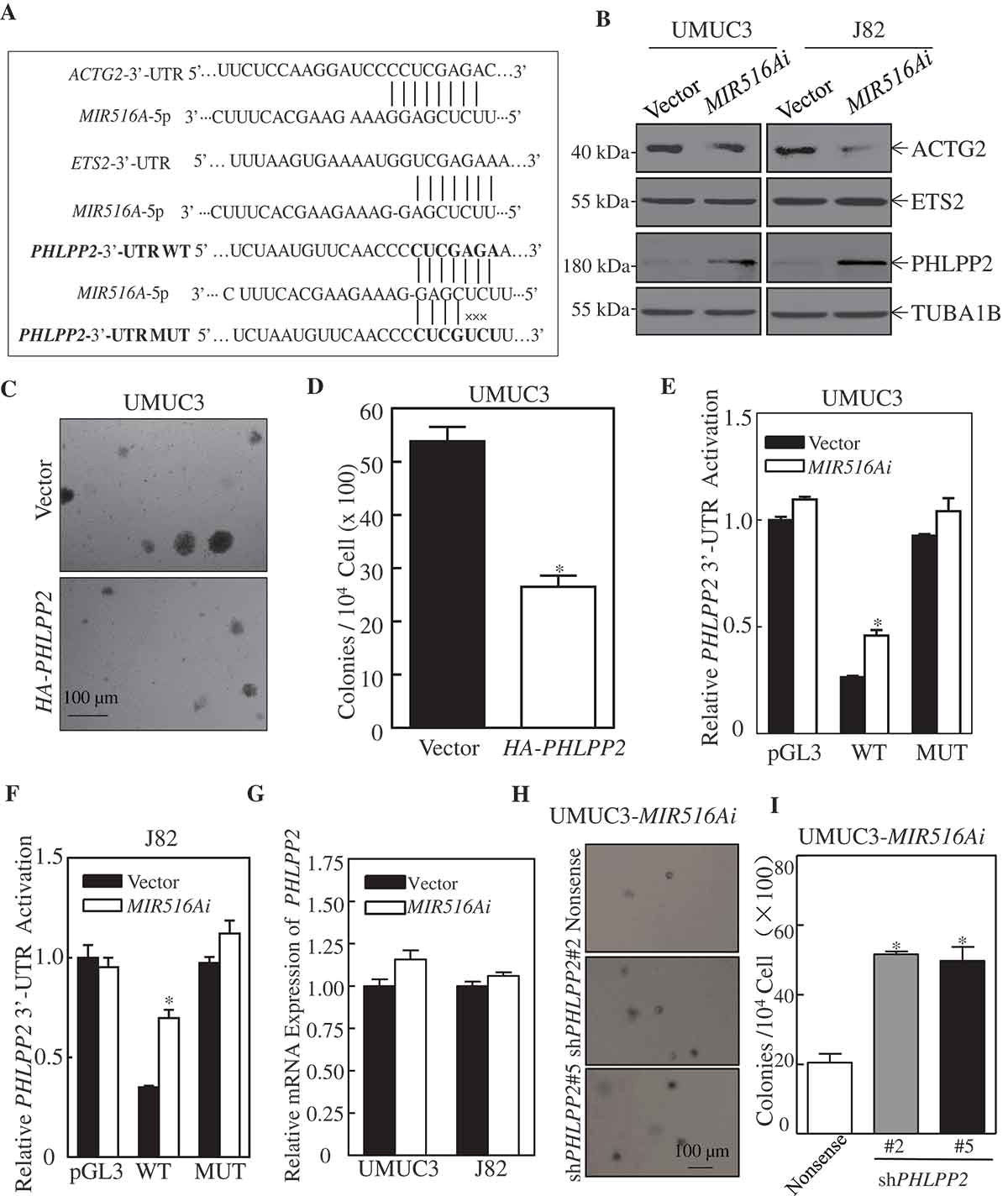
为了阐明MIR516A促进BC细胞生长的作用机制,我们利用TargetScan 7.2软件对MIR516A可能的靶向候选基因进行了分析。综合分析结果显示,在ACTG2、ETS2和PHLPP2 mRNA的3’-UTR中可能存在MIR516A的结合位点,如图2A所示。为了鉴定MIR516A调控功能的相关基因,我们检测了相应蛋白在UMUC3和J82细胞系中的表达。如图2B所示,MIR516Ai对PHLPP2上调,ACTG2下调的抑制作用,对UMUC3和J82细胞中ETS2的表达没有影响。鉴于PHLPP2是一种特性良好的肿瘤抑制因子,我们稳定地将HA-PHLPP2转染到UMUC3细胞中,并且PHLPP2的异位表达显著抑制了UMUC3细胞的锚定独立生长(图2C,D)。为了进一步探讨MIR516A调控PHLPP2表达的机制,我们构建了PHLPP2 mRNA 3’ -UTR荧光素酶报告子的野生型和突变型(MIR516A结合位点突变),如图2A所示。对荧光素酶活性的评估表明,与载体对照转染物相比,其抑制剂对MIR516A的抑制提高了PHLPP2 mRNA 3’ -UTR荧光素酶活性(图2E,F)。MIR516A结合位点的点突变完全消除了MIR516A抑制剂对UMUC3和J82细胞诱导PHLPP2 mRNA 3ʹ-UTR荧光素酶活性的影响(图2E,F)。为了进一步研究MIR516A调控PHLPP2的分子机制,我们通过实时PCR测定了其mRNA水平(图2G)。结果导致我们排除了MIR516A在RNA降解水平上影响PHLPP2表达的可能性,因为MIR516A不影响PHLPP2 mRNA的表达(图2G)。因此,我们预期MIR516A通过抑制其蛋白翻译而下调PHLPP2。为了确定PHLPP2是否是MIR516A在MIR516Ai对BC细胞锚定依赖性生长影响中的下游介质,通过转染针对不同PHLPP2序列的shRNAs,降低了PHLPP2在UMUC3-MIR516Ai细胞中的表达。PHLPP2基因敲除增加UMUC3-MIR516A I细胞的锚定独立生长(图2H,I),提示PHLPP2是MIR516A的直接下游靶点,MIR516A诱导的PHLPP2基因下调在MIR516A促进BC细胞生长中起作用。
3.MIR516A对人BC细胞自噬诱导和锚定非依赖性生长的抑制作用
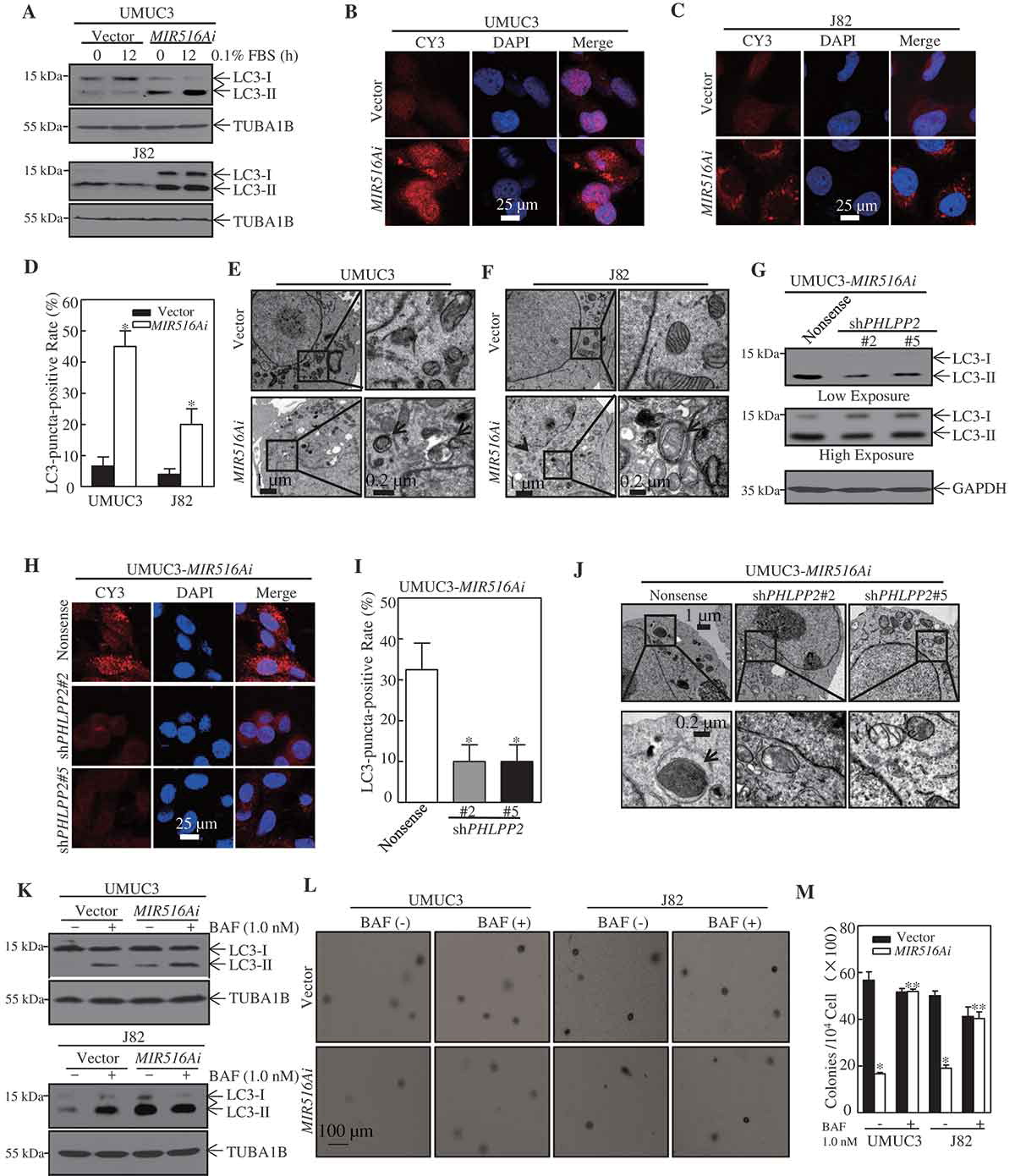
为了探讨MIR516A在人BC生长调控中的作用机制,我们将MIR516Ai细胞的自噬状态与对照载体细胞进行了比较。结果表明,MIR516A i对MIR516A的抑制作用可诱导UMUC3和J82 BC细胞的自噬(图3A)。这一观点得到了LC3点的形成(图3B-D)和MIR516Ai-BC转染体中观察到的自溶体(图3E,F)的支持。MIR516Ai细胞中PHLPP2基因敲除显著降低自噬水平(图3G-I)。为了确定自噬诱导在MIR516Ai诱导的BC细胞生长抑制中的作用,采用自噬通量溶酶体抑制剂bafilomycin A1(BAF)。BAF对自噬的破坏明显累积了LC3-II水平(图3K),并逆转了对UMUC3-MIR516Ai和J82-MIR516Ai细胞锚定独立生长的抑制(图3L,M)。这些结果表明MIR516A抑制人BC细胞自噬,进一步介导其促进BC细胞生长。
4.BECN1的抑制介导MIR516A对人BC细胞自噬的抑制
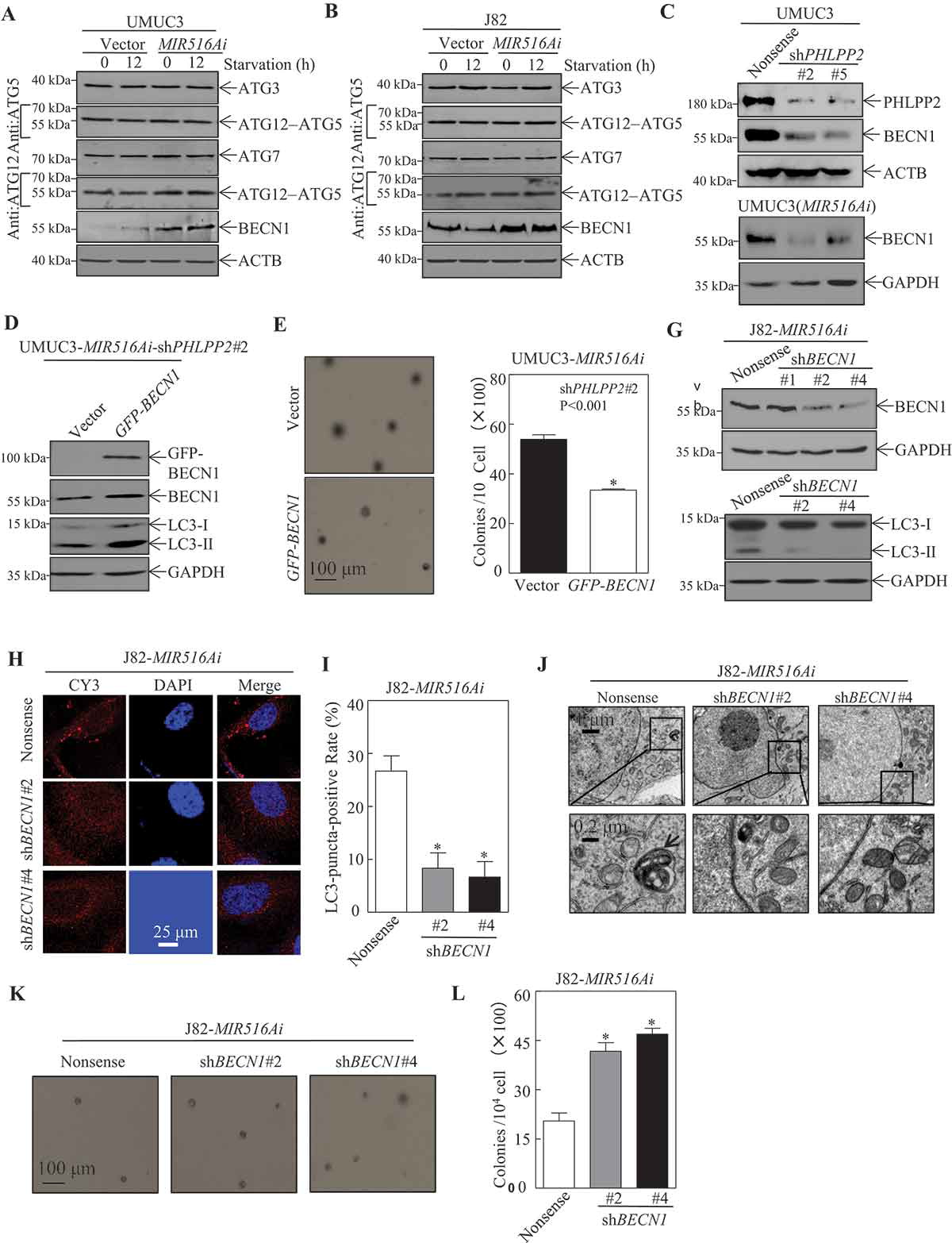
为了阐明MIR516A介导的自噬抑制机制,我们研究了MIR516Ai对ATG蛋白的潜在作用。MIR516Ai的过度表达特异性上调了BECN1,对BC细胞中的其他自噬蛋白没有类似的影响(图4A,B)。与无义转染物相比,在UMUC3细胞和UMUC3-MIR516Ai转染物中PHLPP2的敲除始终减弱BECN1的表达(图4C)。这些结果表明,MIR516A对BECN1有抑制作用,BECN1的抑制作用可能与MIR516A在人BC细胞中的过度表达有关。通过western blotting对稳定的转染体进行鉴定,并进一步探索。BECN1过度表达显著增加了LC3从LC3-I到LC3-II的转化率(图4D)。BECN1过表达也抑制了细胞的锚定独立生长(图4E,F)。接下来,使用靶向人BECN1的shRNAs来抑制内源性BECN1在J82-MIR516Ai细胞中的表达(图4G)。结果表明,BECN1表达的敲除降低了LC3-I向LC3-II的转化、斑点的形成和自溶体的形成(图4H-J),表明BECN1确实在人BC细胞MIR516Ai异位表达诱导的自噬中起作用。如图4K,L所示,BECN1基因敲除也挽救了J82-MIR516Ai细胞的锚定独立生长。这些结果表明,MIR516A抑制导致BECN1诱导,介导自噬,进而抑制人BC细胞的锚定独立生长。
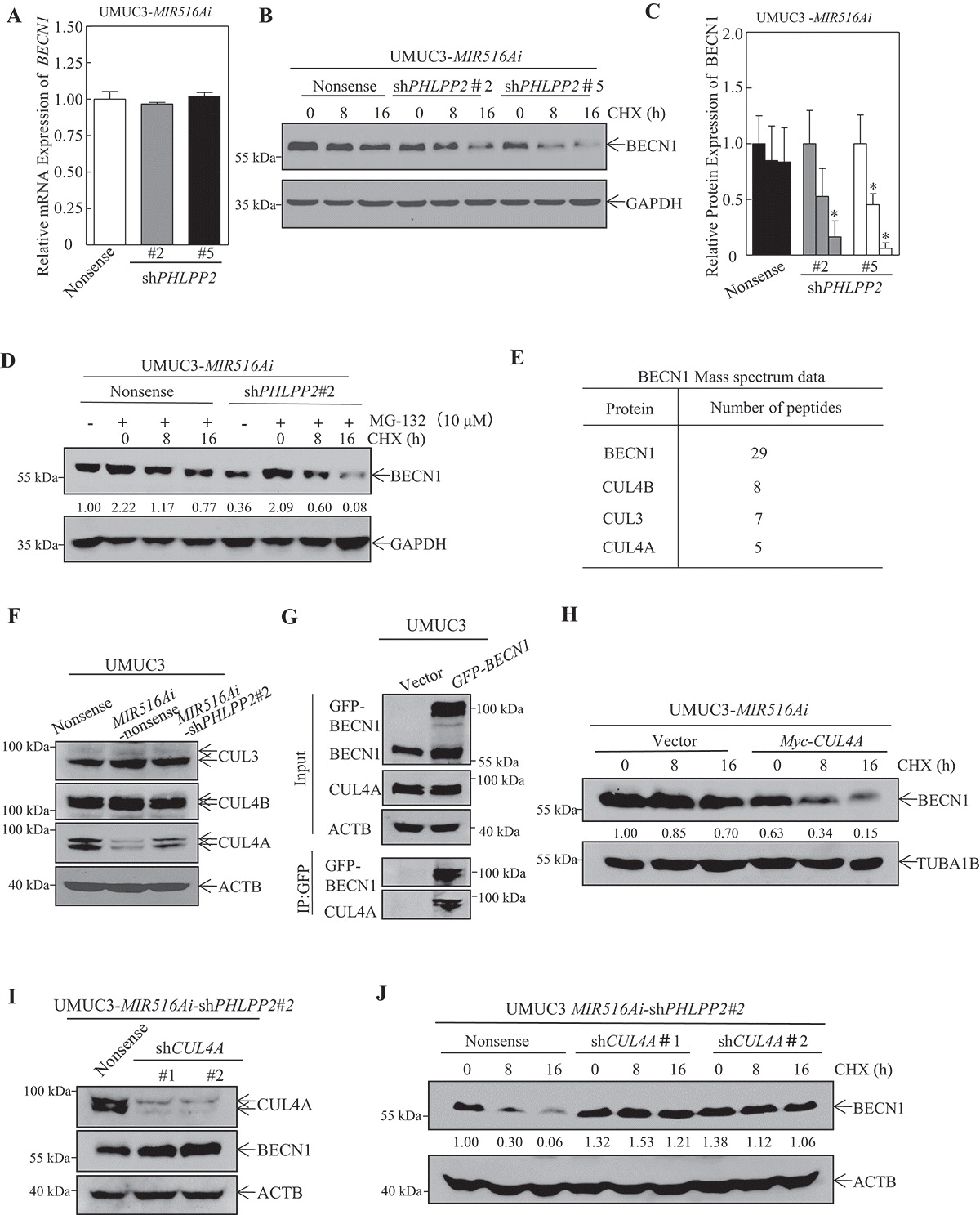
5.MIR516A-PHLPP2级联促进cul4a介导的BECN1蛋白降解
BECN1在酵母中也称为ATG6,是自噬起始和其他生物过程的关键蛋白。作为评估PHLPP2基因敲除细胞中BECN1下调机制的先决条件,首先用qRT-PCR检测BECN1的mRNA水平。如图5A所示,PHLPP2基因敲除对MIR516Ai表达细胞中的BECN1 mRNA水平没有影响,表明MIR516A-PHLPP2轴不调节BECN1转录或mRNA稳定性。因此,我们研究了MIR516Ai对BECN1蛋白降解的潜在影响。与对照UMUC3-MIR516Ai无义细胞相比,PHLPP2基因敲除增加了BECN1蛋白降解率(图5B-D)。为了进一步研究PHLPP2介导的抑制BECN1蛋白降解的分子机制,我们进行共免疫沉淀和质谱分析。质谱分析结果表明,PHLPP2可能不会直接与BECN1相互作用和影响BECN1。然而,经过对免疫沉淀蛋白候选物的仔细研究和初步验证,我们发现E3泛素蛋白连接酶的几个核心组分,包括CUL3、CUL4A和CUL4B,在我们的系统中显示出更高的肽谱匹配值(图5E)。为了进一步验证MIR516A及其下游PHLPP2对BECN1的影响是否真的依赖于CUL4B、CUL4A或CUL3,我们首先检测了这些蛋白质表达水平的变化。如图5F所示,MIR516A-PHLPP2级联可以调节CUL4A,但对CUL3和CUL4B的表达没有明显影响,提示CUL4A可能是PHLPP2抑制BECN1蛋白降解的关键因素(图5G)。此外,异位CUL4A表达显著促进BECN1蛋白降解,而CUL4A基因敲除显著降低BECN1蛋白降解(图5I-J)。这些结果表明MIR516A-PHLPP2级联主要通过CUL4A依赖机制促进BECN1蛋白降解。
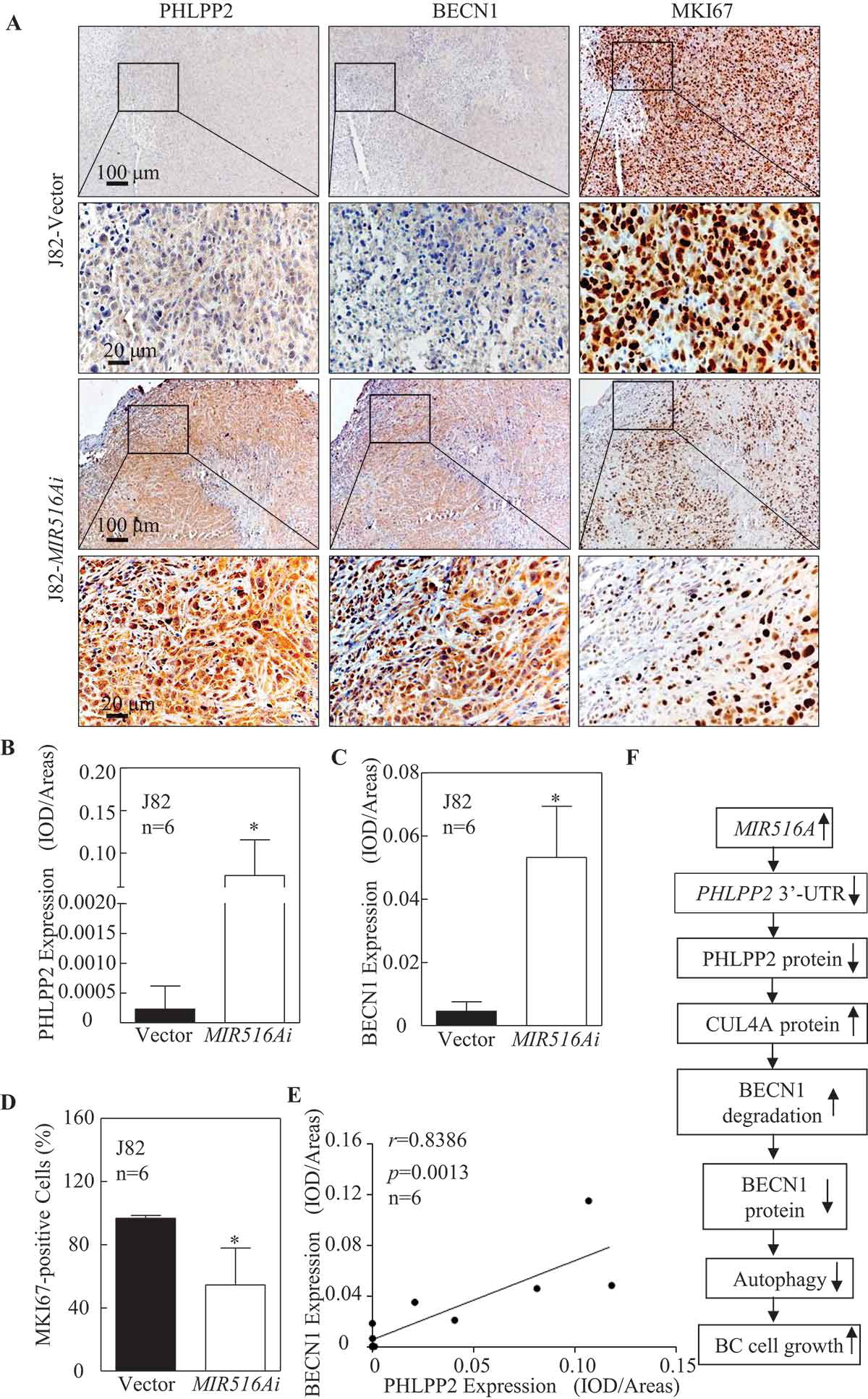
6.抑制MIR516A增加体内移植瘤中PHLPP2和BECN1的表达并下调MKI67的表达
为了确定MIR516A是否在体内对PHLPP2和BECN1起下调作用,我们用IHC评估了J82-MIR516Ai异种移植瘤中PHLPP2和BECN1的表达,并与J82载体异种移植瘤进行了比较。结果显示,与注射J82载体细胞产生的异种移植瘤相比,J82-MIR516Ai异种移植瘤中这些蛋白的表达显著上调(图6A-C)。PHLPP2的表达与裸鼠MIR516A抑制组织中BECN1的表达呈正相关(图6E)。我们还确定MKI67/Ki-67是肿瘤细胞增殖的生物标志物。如图6A、C所示,在MIR516A抑制剂异种移植裸鼠组织中,MKI67阳性BC细胞持续减少。总的来说,这些结果表明MIR516A通过结合PHLPP2 mRNA的3’-UTR上调PHLPP2,导致CUL4A介导的BECN1蛋白降解减少,进一步增加BECN1介导的自噬,从而抑制BC生长(图6F)。
结论:
综上所述,目前的研究结果确定了一个新的MIR516APHLPP2-CUL4A-BECN1自噬途径参与MIR516A促进BC的体内外生长。我们发现MIR516A通过直接结合其mRNA的3’-UTR而下调PHLPP2蛋白,而下调的PHLPP2通过促进BECN1蛋白降解进一步降低BECN1的表达,从而抑制自噬,促进人BC细胞的生长。






