基金又一新方向———细胞焦亡的抑制
细胞焦亡(pyroptosis)是一种新发现的细胞程序性死亡方式,表现为细胞不断胀大直至细胞膜破裂,导致细胞内容物的释放进而激活强烈的炎症反应。细胞焦亡是机体重要天然免疫反应,在拮抗感染和内源危险信号中发挥重要作用。相比于细胞凋亡(apoptosis),细胞焦亡发生的更快,并会伴随大量促炎症因子的释放。2020年 03 月20日, Muendlein HI, Jetton D, Connolly WM, 等人,在Science上发表了一篇关于cFLIP抑制细胞焦亡的机制文章“cFLIP protects macrophages from LPS-induced pyroptosis via inhibition of complex II formation”。

细胞死亡和炎症是宿主对感染的相互依赖的反应。 在焦细胞凋亡期间,白细胞介素1b(IL-1b)的释放通过caspase-1和caspase-11介导的Gasdermin D孔形成。 在体内,对脂多糖(LPS)的反应导致IL-1b分泌。 然而,在体外,鼠巨噬细胞需要炎性体驱动的IL-1b成熟的第二个“危险信号”。 最近的报道显示,在LPS活化的巨噬细胞中caspase-8介导的细胞凋亡,但在这些条件下有关IL-1b释放的证据相互矛盾。 在这里,为了进一步表征LPS诱导的体外分泌机制,作者揭示了细胞FLICE样抑制蛋白(cFLIP)在调节炎症反应中的重要作用。
1.TAK1抑制之前的LPS启动
LPS驱动的死亡需要CASP8和GSDMD,但不需要NLRP3,CASP1或CASP11。 这表明cFLIP L缺乏症在LPS激活后严格促进焦磷酸化。 cFLIP L KD消除了抑制TAK1诱导发烧的要求。 cFLIP L的沉默概括了TAK1抑制作用(通过YopJ或5z7处理),暗示cFLIP L是响应LPS的主要细胞凋亡调节因子之一。
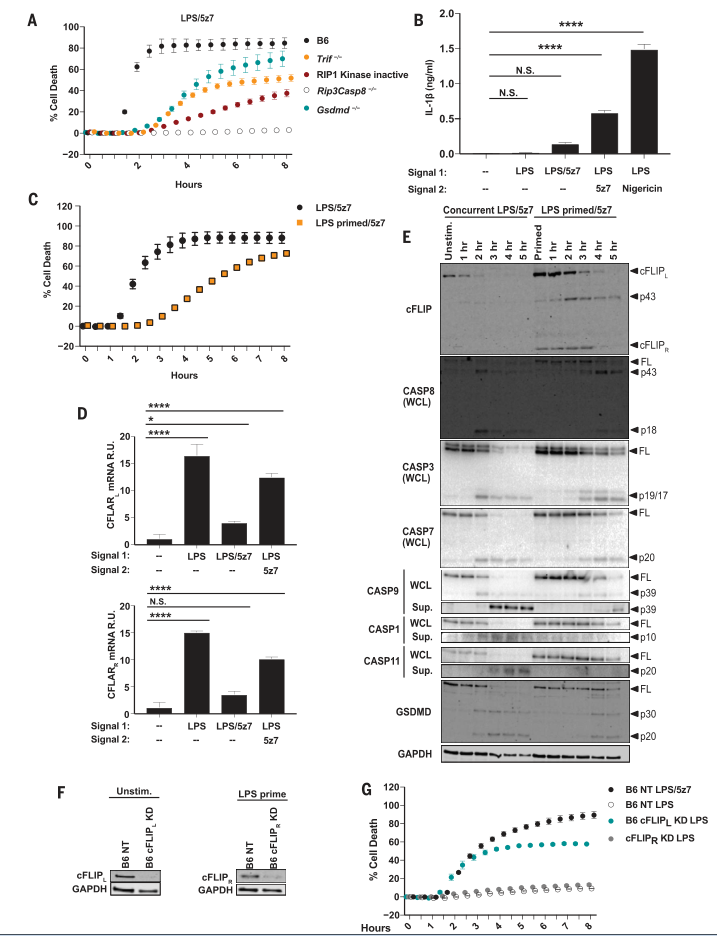
图1. TAK1抑制之前的LPS启动引发IL-1b释放,抑制细胞死亡并调节cFLIP水平。
(A)BMDM中B6,无RIP1激酶失活(RIP1Ki),Trif-/-,Rip3-/-Casp8-/-和Gsdmd-/-的小鼠在LPS / 5z7处理下的细胞死亡。 (B)在指定治疗后6小时,IL-1b从B6 BMDM中释放。 LPS预灌注(10或100 ng / ml)分别在添加5z7或尼日灵之前4小时进行。 (C)与LPS / 5z7或LPS-pre-primed / 5z7同时刺激的B6 BMDM中的细胞死亡。 (D)在B6 BMDM中,LPS,LPS / 5z7或LPS预涂底漆/ 5z7处理1小时后,相对于Cflar mRNA水平标准化为Gapdh(磷酸甘油醛磷酸脱氢酶)。 R.U.,相对单位。 (E)cFLIP,GSMDD的全长(FL)和裂解产物,以及从LPS / 5z7或LPS–预处理的B6 BMDM的全细胞裂解液(WCL)或从上清液(Sup。)沉淀的胱天蛋白酶。 (F)B6 BMDM中的cFLIP蛋白水平被cFLIP L或cFLIP R击倒或用非靶向(NT)对照转导。(G)B6 BMDM中被cFLIP L或cFLIP R击倒并被刺激的细胞死亡[在(F)中显示的敲低程度]。来自细胞死亡测定和免疫印迹的数据代表了三个或更多独立实验,并且细胞死亡数据表示为一式三份孔的平均值±SD。 IL-1b释放数据表示为来自三个或更多独立实验的一式三份孔的平均值±SD。使用方差分析(ANOVA)用于组间比较。
2.cFLIP L是响应LPS的细胞凋亡的主要调节剂之一
细胞死亡需要受体相互作用的丝氨酸/苏氨酸蛋白激酶1(RIP1)和GSMDD的激酶活性,但伴随着低的IL-1b水平,这可能是由于抑制了MAPK和NF-kB介导的前IL- 1b生产。与同时用LPS和5z7处理的细胞相比,在5z7处理之前用LPS预灌注的骨髓衍生巨噬细胞(BMDM)产生的IL-1b水平明显更高。
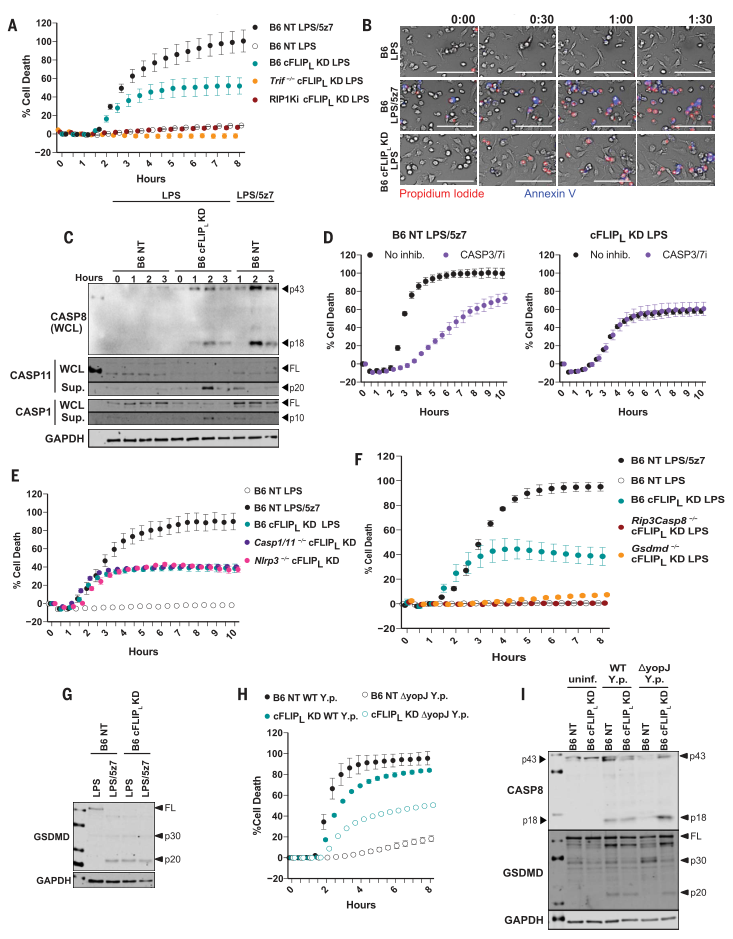
图2. LPS在不存在cFLIP L的情况下诱导caspase-8介导的细胞凋亡。
(A)B6,Trif-/-和RIP1Ki BMDM中的细胞死亡被cFLIP L击倒并受到刺激。 (B)用LPS或LPS / 5z7刺激长达1小时30分钟的B6和B6 cFLIP L -KD BMDM中PI掺入和膜联蛋白V染色的动力学20倍放大成像。比例尺:100 mm。 (C)从半纤维素裂解物(WCL)或从B6NT对照或B6cFLIP L -/-BMDMs的上清液中沉淀的所示半胱氨酸蛋白酶的全长和裂解产物。 (D)在LPS / 5z7刺激的B6巨噬细胞或LPS处理的cFLIP L -KD BMDM中用CASP3 / 7抑制剂抑制细胞死亡。 (E)用LPS或LPS / 5z7刺激的B6,Nlrp3-/-和Casp1-/-Casp11-/-巨噬细胞中的细胞死亡。 (F)B6,Rip3-/-Casp8-/-和Gsdmd-/-BMDM中的细胞死亡被击倒并被刺激(如图S3I所示的KD),刺激了cFLIPL。 (G)从B6NT控制器B6cFLIP L -KDBMDM刺激的全长和切割GSDMD所示。 在WT或YopJ缺陷型(DyopJ)Y。假性结核病刺激下的B6NT和B6cFLIP L -KD BMDM中,CASP8和GSDMD的细胞死亡和(I)裂解(图S3L所示的KD的程度)。未感染,未感染。所有的免疫印迹和细胞死亡数据代表三个或更多独立实验。细胞死亡数据表示为一式三份孔的平均值±SD。
3.cFLIP L缺失促进LPS响应
cFLIP L不足足以驱动对LPS的复合物II的形成。 LPS / 5z7也推动了复合物II的形成,并且在早期时间点在复合物中检测到了cFLIPL。 LFL诱导的cFLIP L -KD细胞中复合物II的形成依赖于TRIF和RIP1激酶活性。 在cFLIP L -KD细胞中,复杂II的形成和LPS诱导的细胞死亡都需要进行修饰。 因此,cFLIP L和RIP1的激酶活性调节TRIF信号下游的复合物II的形成,并决定细胞死亡的程度和方式。
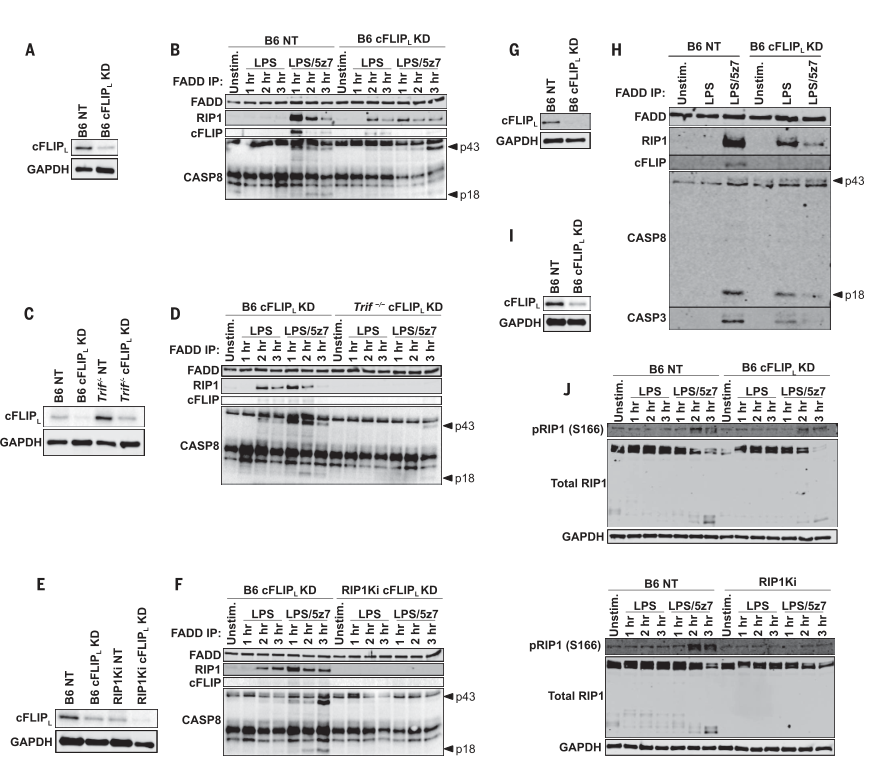
图3. cFLIP L缺乏促进LPS响应,在TRIF下游形成复合物II。
(A)B6 BMDM中的cFLIP L蛋白水平被cFLIP L击倒或用NT对照转导。 (B)按指示刺激的B6 NT和B6 cFLIP L -KD BMDM中的FADD免疫沉淀(IP),并探测复合物II成分。(A)中显示的敲低程度(C)B6和Trif-/-BMDM中的cFLIP L蛋白水平被cFLIP L击倒或NT对照转导。(D)B6和Trif-/-BMDM中的FADD IP被敲除cFLIP L,如所示被刺激,并探测复杂的II成分[(C)所示的敲低程度]。 (E)B6和RIP1Ki BMDM中的cFLIP L蛋白水平被cFLIP L击倒或用NT对照转导。 (F)B6和Trif-/-BMDM中的FADD IP击倒cFLIP L,如所示进行刺激,并检测复杂的II成分[(E)中所示的敲低程度]。 (G)B6 BMDM中的cFLIP L蛋白水平降低了cFLIP L或用NT控件进行转导。 (H)如所示刺激2小时的B6 NT和B6 cFLIP L -KD中的FADD IP,并检测复合物II成分[(G)中显示的敲低程度)。 (I)B6 BMDM中的cFLIP L蛋白水平被cFLIP L击倒或用NT对照转导。 (J)LPS和LPS / 5z7刺激的cFLIP L沉默或NT对照B6和RIP1Ki BMDM中的总和pRIP1(S166)水平[(I)中显示的敲低程度]。所有的免疫印迹代表三个或更多独立实验。
4.cFLIP L缺失,LPS激活的巨噬细胞迅速分泌IL-1b
当cFLIP L水平低时,CASP8同型二聚体容易形成。完全活跃的CASP8裂解并激活远处的靶标,LPS激活的巨噬细胞迅速经历热解并分泌IL-1b。在不存在cFLIP L的情况下,CASP3,CASP7和CASP9对于CASP8驱动的细胞凋亡是必不可少的。相反,CASP8可能直接激活GSDMD来驱动细胞凋亡,而NLRP3炎症小体来驱动IL-1b成熟和释放。
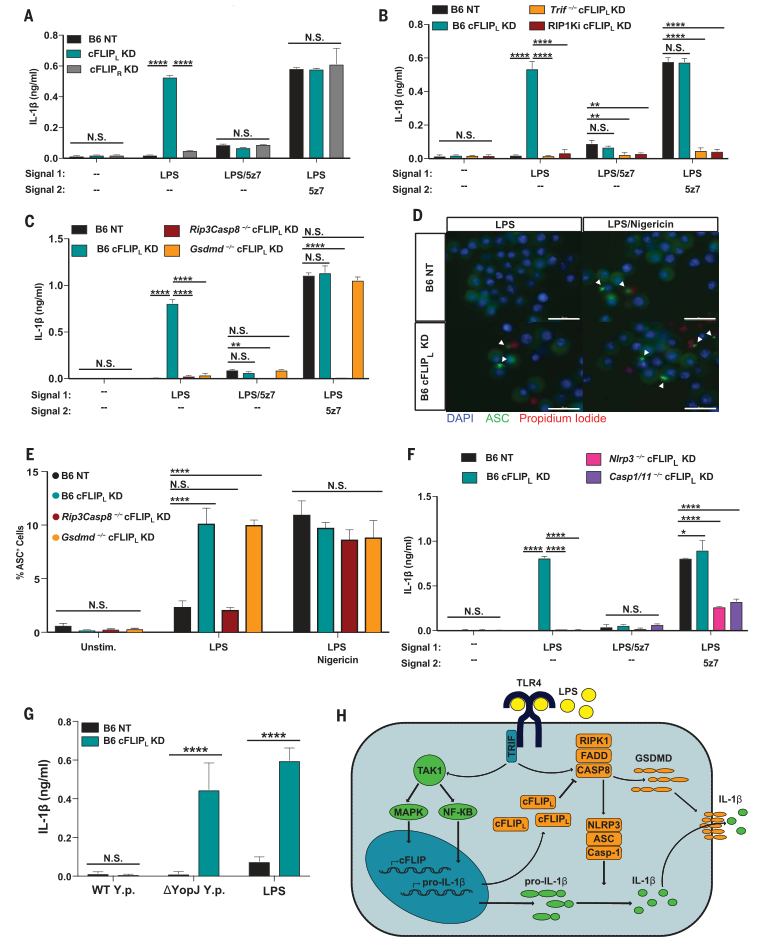
图4. cFLIP L缺乏会驱动IL-1b成熟并响应来自LPS的单个信号而释放。
(A到C)IL-1b从(A)B6 NT对照,B6 cFLIP L -/-和B6 cFLIP R -/-BMDM释放; (B)为cFLIP L敲低的RIP1Ki和Trif-/-BMDM; (C)经过指定治疗6小时后,RIP3 / CASP8和GSDMD缺陷型BMDM敲低cFLIP L。(D)用LPS刺激4小时,或用LPS尼日利亚霉素刺激2小时的B6 NT对照和B6 cFLIP L-/- BMDM中的ASC斑点的代表性60X图像(图S4D中显示的敲低程度)。比例尺:30毫米。在针对cFLIP L的B6,Rip3-/-Casp8-/-和Gsdmd-/-BMDM中ASC +细胞的百分比。 (F) IL-1b在b6,Nlrp3-/-和Casp1-/-Casp11-/-巨噬细胞中释放,对于cFLIP L沉默并如所指示的被刺激。(G)B6 BMDM对cFLIP L沉默并用WT或缺乏YopJ的(DyopJ)假结核耶尔森氏菌6小时。 (H)由cFLIP L调节的LPS驱动的细胞凋亡和IL-1b产生的模型。 IL-1b释放和ASC百分比数据表示为来自三个或更多独立实验的一式三份孔的平均值±SD。方差分析(ANOVA)用于比较各组。
结 论:
长异构体cFLIP L的缺乏会促进复合体II的形成,从而引起焦磷酸化,并且它们仅响应LPS就能分泌IL-1b。






