Prominin2调控铁死亡抗性
铁死亡是一种以铁依赖性的脂质活性氧积累为特征的细胞死亡调控过程,它会导致缺血和变性疾病中病理性细胞丢失,并有可能诱发癌细胞死亡。细胞抵抗铁死亡的能力各不相同,但其抵抗机制尚不清楚。今天小编给大家介绍发表于“Developmental Cell”上的文章“Prominin2 Drives Ferroptosis esistance by Stimulating Iron Export”。

结 果:
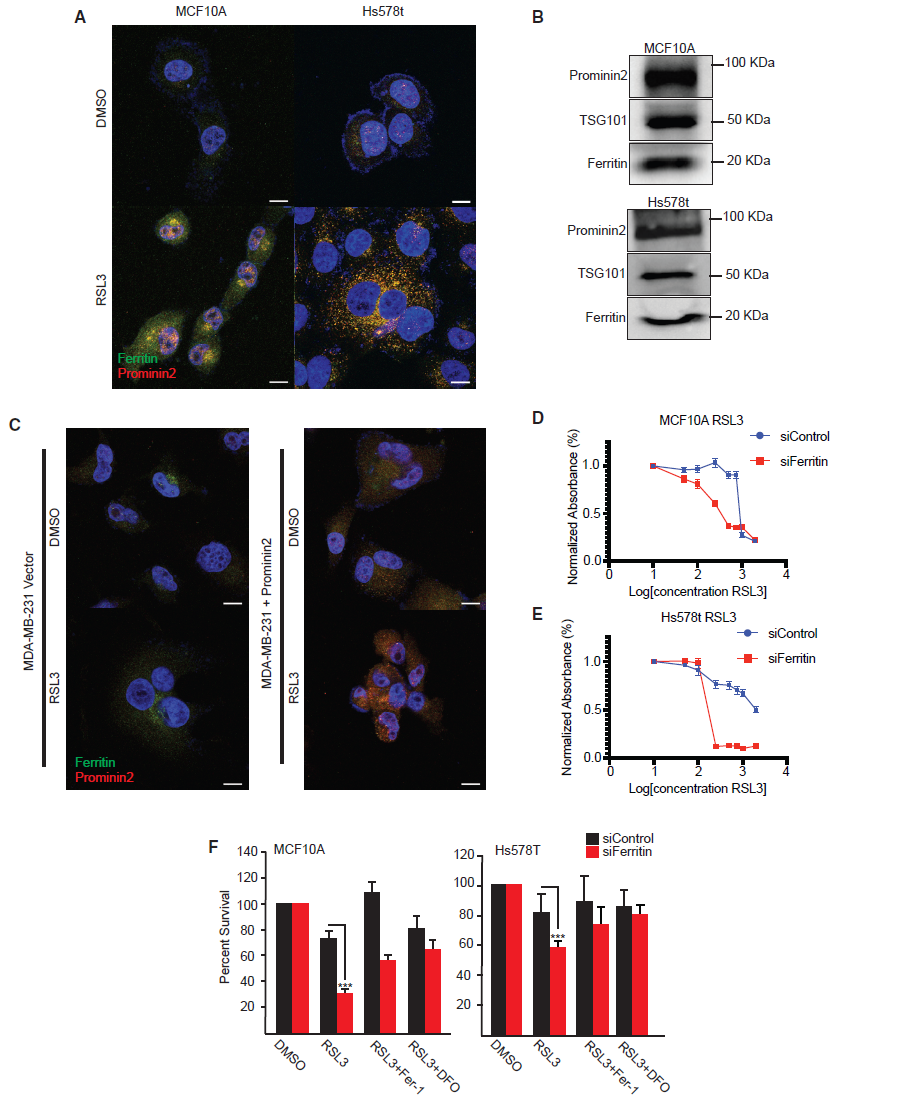
1.Prominin2一种铁应激反应蛋白
根据研究报道,我们认为,在分离条件下存活的细胞可以通过上调保护基因表达程序来阻止细胞死亡。为了鉴定这些基因,我们通过RNA测序比较了粘附的和ECM脱离的MCF10A永生化乳腺上皮细胞中的mRNA表达。研究表明,在蛋白和mRNA水平上,ECM脱离后,MCF10A细胞中Prominin2迅速上调(图1A和1B)。分离和粘附的Hs578t乳腺癌细胞中也观察到编码Prominin2的PROM2的增加。在ECM脱离条件下,MCF10A和Hs578t细胞中Prominin2表达的沉默导致了生存能力的显著降低(图1B,1C)。在这些条件下,细胞活力可以通过与一种特定的铁死亡抑制剂ferrostatin- 1联合处理而得到拯救(图1C)。这些数据表明,ECM脱离时未能上调PROM2可能导致铁死亡。
接下来我们研究了GPX4的药理学抑制是否改变了粘附细胞中Prominin2的表达并影响了铁死亡。结果表明用共价GPX4抑制剂RSL3处理MCF10A和Hs578t细胞2小时会导致两个细胞系中Prominin2 mRNA和蛋白表达增加(图1D,1E)。与MCF10A和Hs578t细胞不同,RSL3在另一个乳腺癌细胞系MDA-MB-231细胞中没有诱导Prominin2。我们观察到Prominin2的表达与GPX4抑制引起的铁死亡抗性相关。MCF10A和Hs578t细胞在2.5 mM浓度下对RSL3诱导的细胞死亡有抗性,而MDA-MB-231细胞在0.5 mM浓度下被RSL3诱导死亡(图1F)。
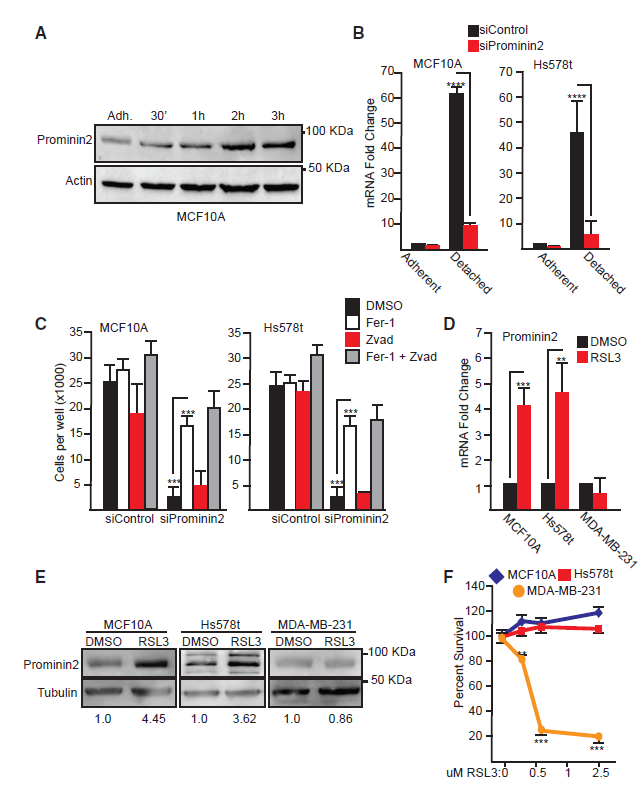
2.Prominin2增加对铁死亡的抗性
我们评估了prominin2是否对铁死亡抗性是必要的。为此,我们沉默了MCF10A和Hs578t细胞中prominin2的表达,并与对照细胞比较,检测了这些细胞对铁死亡的敏感性。我们检测了RSL3、ML210、FIN56和erastin。我们发现对照组MCF10A细胞比Hs578t细胞更耐这些化合物(图2A,2B)。然而,在两种细胞系中,在prominin2敲除细胞中观察到对所有四种化合物的敏感性明显增加。在prominin2缺失的细胞中,细胞活力的丧失被ferrostatin-1完全挽救了(图2C)。根据基因沉默得到的结果,我们接下来测试了过表达的prominin2是否足以抑制铁死亡。结果表明,在MDA-MB-231细胞中,外源性的prominin2表达足以抑制细胞死亡(图2D)。因此,prominin2的表达促进了对铁死亡的抵抗。
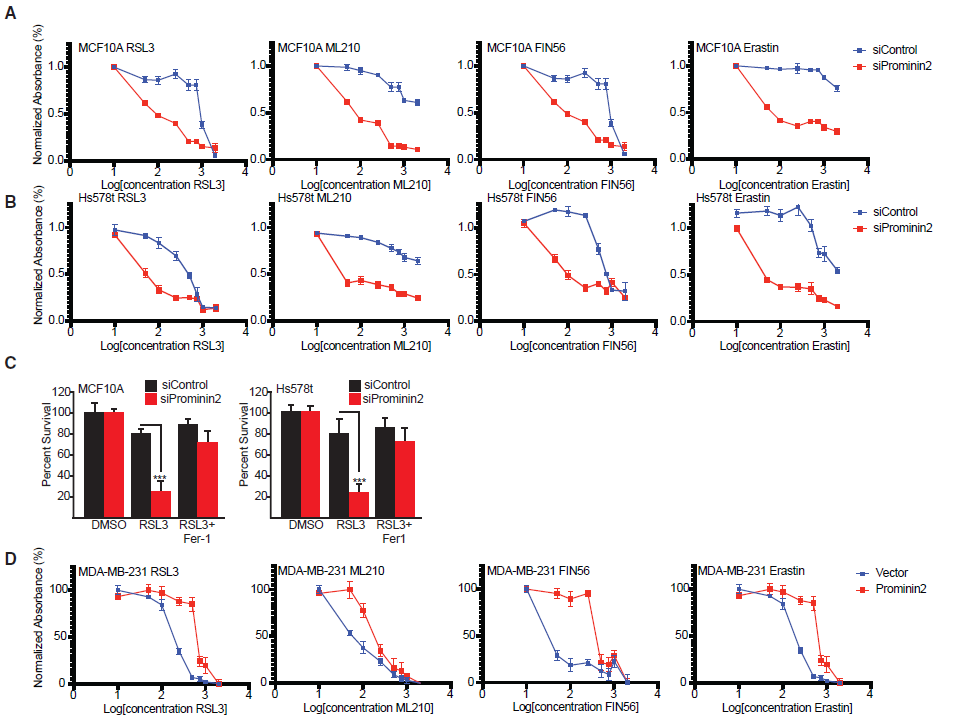
3.Prominin2促进MVBs的形成
为了深入了解prominin2如何促进铁死亡抗性,我们评估了GPX4抑制后其亚细胞定位。免疫荧光显微镜显示, GPX4抑制后,prominin2定位于离散的胞质点状突起(图3A)。相比之下,在prominin2和TSG101之间观察到一个显著的共定位,TSG101是多泡体(MVBs)的标记。GPX4抑制后30分钟,prominin2和TSG101的共定位就很明显,这种共定位在核周区域最为明显(图3B)。这一结果促使我们评估在GPX4抑制下,prominin2是否促进MVB的形成。与对照细胞相比,RSL3处理的MCF10A和Hs578t细胞含有更多的TSG101阳性结构,这表明GPX4抑制可以诱导MVB的形成(图3A,3B)。然后,我们利用透射电子显微镜评估这些结构的形成是否依赖于prominin2。事实上,RSL3处理的MCF10A细胞比对照细胞含有更多的MVBs,这种效应在prominin2沉默细胞中没有观察到(图3C)。免疫荧光显微镜还显示,与对照组细胞相比,在prominin2缺失的MCF10A和Hs578t细胞中,TSG101阳性斑点减少(图3D,3E)。相反,在MDA-MB-231细胞中,prominin2的表达增加了TSG101阳性结构的数量,降低了对铁死亡的敏感性(图3F)。
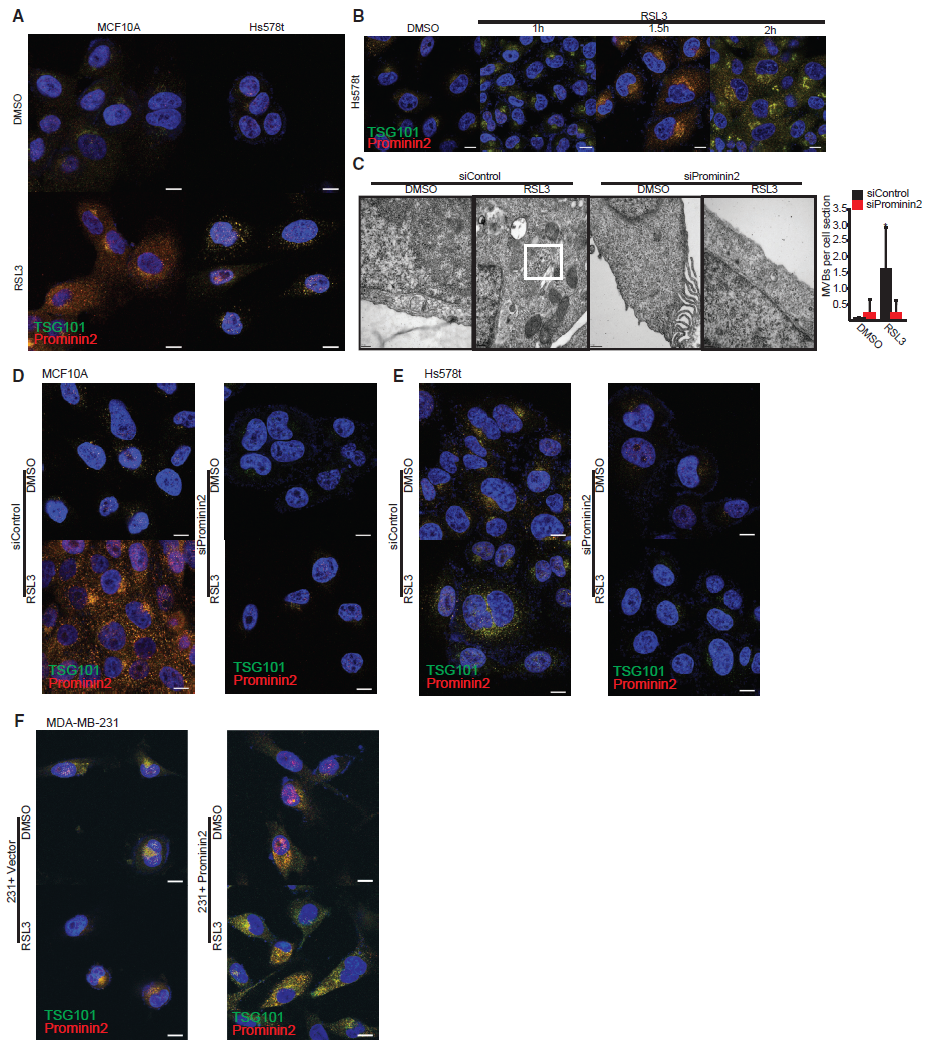
4.多泡体的形成是避免铁死亡的必要条件
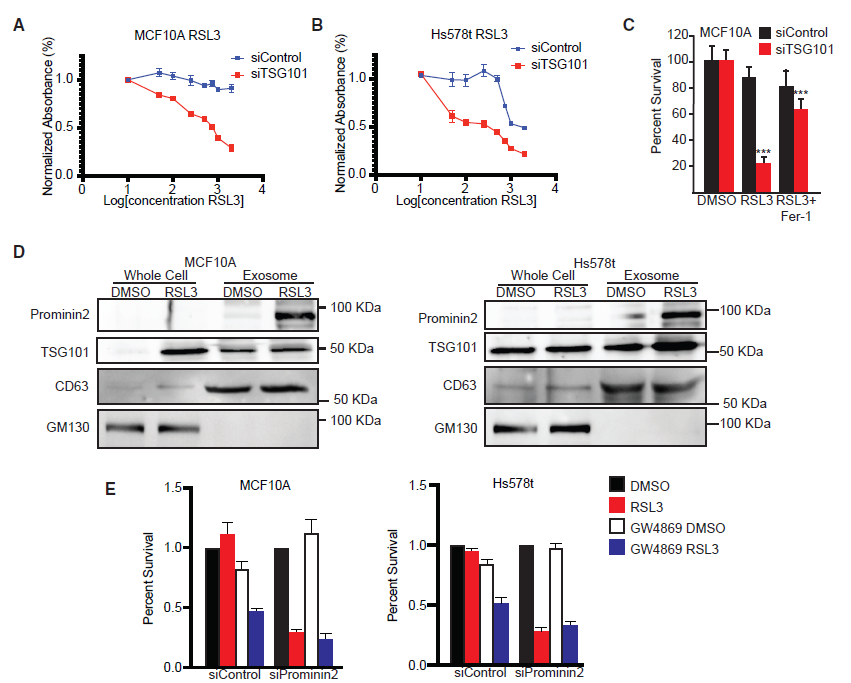
与MVBs在铁死亡抗性上的因果作用相一致,TSG101表达的减少增加了MCF10A和Hs578t细胞对RSL3诱导的细胞死亡的敏感性(图4A,4B),而这种死亡被ferrostatin-1挽救(图4C)。这些数据表明,GPX4的抑制刺激了prominin2的表达和prominin2依赖的MVB的形成,从而促进了铁死亡抗性。
为了评估GPX4抑制外泌体形成的影响,从对照细胞(DMSO)和经RSL3处理的MCF10A和Hs578t细胞中提取外泌体。研究表明抑制GPX4增加了外泌体的形成(图4D)。通过免疫印迹分析这些外泌体,发现它们含有prominin2、CD63和TSG101,这为它们是由prominin2依赖的MVB形成提供了证据(图4D)。接着为了检测外泌体的释放是否对GPX4的抗性起关键作用,我们使用了鞘磷脂酶抑制剂GW4869。研究发现抑制外泌体的释放增加了对照组MCF10A和Hs578t细胞对RSL3的敏感性,但未显著影响prominin2缺失细胞的生存能力(图4E)。
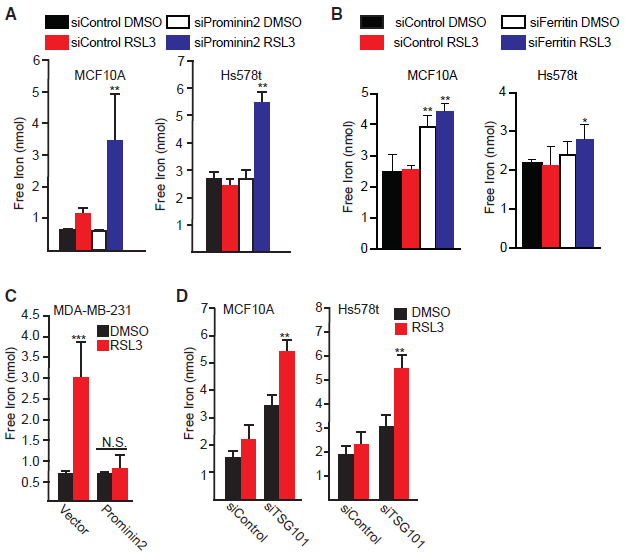
5.Prominin2和铁蛋白参与游离铁的调控
我们推断MVB/外泌体介导的铁排出可抑制上铁死亡。为了支持这一假设,我们观察到铁蛋白与prominin2在RSL3处理的MCF10A和Hs578t细胞中共定位(图5A)。我们还鉴定了从这些细胞中提取的外泌体中的铁蛋白(图5B)。电感耦合等离子体质谱法检测到这些外泌体含有铁。这进一步支持了我们的假设。MDA-MB-231细胞在GPX4抑制后不增加铁蛋白的表达。然而,与对照细胞相比,prominin2的表达诱导了RSL3处理细胞中更多的铁蛋白定位(图5C)。此外,铁蛋白重链(FTH1)和轻链(FTL)的敲除增加了GPX4抑制MCF10A和Hs578t细胞的死亡(图5D,5E)。重要的是,这一死亡是由ferrostatin-1或铁螯合剂双氧胺挽救的(图5F)。
6.GPX4的抑制改变了游离铁的浓度
我们的数据表明,GPX4抑制刺激了含有铁蛋白的MVBs的形成,这些结构将铁运输出细胞。为了验证这一假设,我们量化了对照组和RSL3处理的MCF10A和Hs578t细胞的游离铁浓度,发现两组之间没有显著差异(图6A)。然而,当FTH1和FTL沉默后,我们观察到RSL3处理后游离铁的浓度增加(图6A,6B)。通过对对照中游离铁和GPX4抑制下表达prominin2的MDA-MB-231细胞进行定量分析,获得了prominin2调控的铁水平的额外证据。在这些细胞中,prominin2的表达阻止了RSL3引起的铁元素的增加(图6C)。此外,通过降低TSG101的表达来抑制MVB通路,可以显著增加GPX4抑制后细胞内游离铁的浓度(图6D)。这些结果表明,阻断MVB/外泌体介导的铁蛋白排出可导致细胞内铁蛋白在GPX4抑制下的积累。
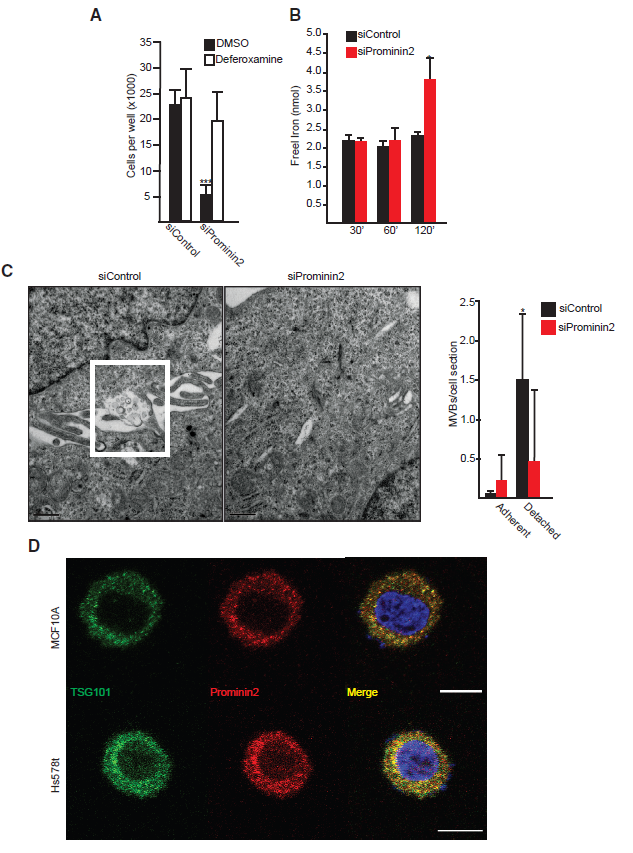
7.ECM脱离的细胞通过Prominin2介导的MVB/外泌体的形成来抵抗铁死亡
基于ECM脱离是一种诱导prominin2表达的铁胁迫,我们研究了prominin2是否促进了ECM-脱离细胞中MVB的形成和铁的转运。研究表明,ECM脱离的、prominin2缺失的MCF10A和Hs578t细胞中的细胞死亡被铁螯合剂去氧胺挽救(图7A)。此外,与对照组细胞相比,ECM脱离增加了prominin2缺失细胞中游离铁的浓度,这种效果在2小时后最明显(图7B)。与经RSL3处理的贴壁细胞相似,经TEM分析,ECM脱离增加了MVBs的频率,这种增加依赖于prominin2 (图7C)。此外,在ECM脱离的MCF10A和Hs578t细胞中,prominin2和TSG101的共定位也很明显(图7D)。这些结果表明,生理上的铁应激可以通过prominin2 /MVB的铁输出途径来规避。
结 论:
本研究利用RNA-seq鉴定了有助于抗铁死亡的基因,发现促铁死亡的刺激物诱导了prominin2的表达,并且prominin2与脂质动态调节有关。Prominin2促进了乳腺上皮和乳腺癌细胞的抗铁死亡。机制上,prominin2促进含铁蛋白的多泡体)和外泌体的形成,这些外泌体将铁转运出细胞,从而抑制了铁死亡。这些发现表明,抗铁死亡可以由prominin2-MVB-外泌体-铁蛋白途径驱动,并且对铁稳态、细胞内转运和癌症具有广泛的意义。






