外泌体与内质网应激
外泌体在细胞间通讯中起着至关重要的作用。在肿瘤发生期间,肿瘤来源的外泌体可促进肿瘤血管生成和转移,调节肿瘤微环境。然而,外泌体如何促进肿瘤转移的呢?这篇文章为你揭晓。
文章思路:

结 果:
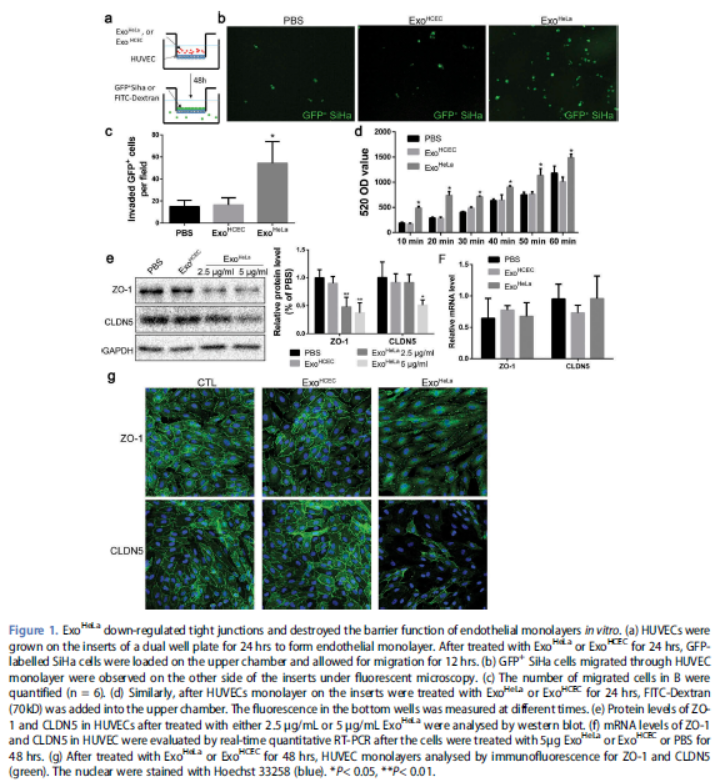
1. ExoHeLa通过破坏内皮细胞紧密连接破坏内皮单层的屏障功能
探究ExoHeLa对内皮细胞(EC)单层通透性的影响,发现更多GFP标记的癌细胞迁移过ExoHeLa处理的HUVEC单层细胞。EC的渗透性与其紧密连接(TJ)相关,ExoHeLa处理后EC的ZO-1蛋白水平下调至50%,CLDN5也降低。ExoHeLa处理的人脐静脉内皮细胞(HUVEC)单层中ZO-1和CLDN5显著降低。
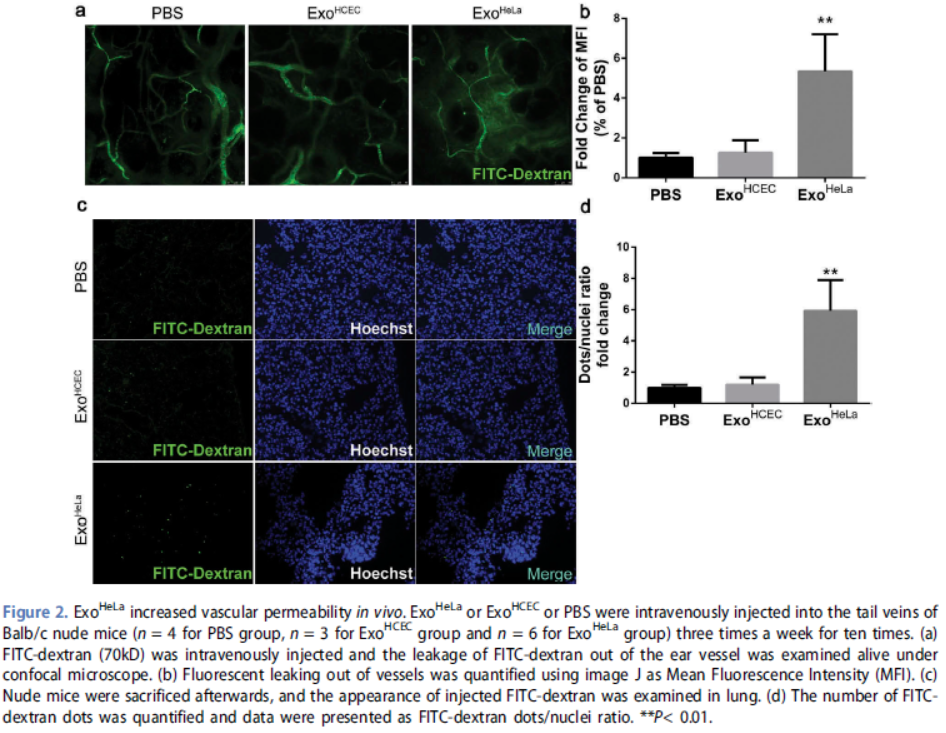
2. ExoHeLa增加体内血管通透性
进一步探索ExoHeLa对内皮细胞屏障的体内作用,小鼠尾静脉注射ExoHeLa或ExoHCEC之后耳部注射FITC-Dextran,发现ExoHeLa鼠耳部血管的FITC-Dextran严重泄漏,肝肺切片中也观察到类似结果。这些结果表明,ExoHeLa处理下调EC中TJ蛋白,从而增加不同器官的血管通透性。
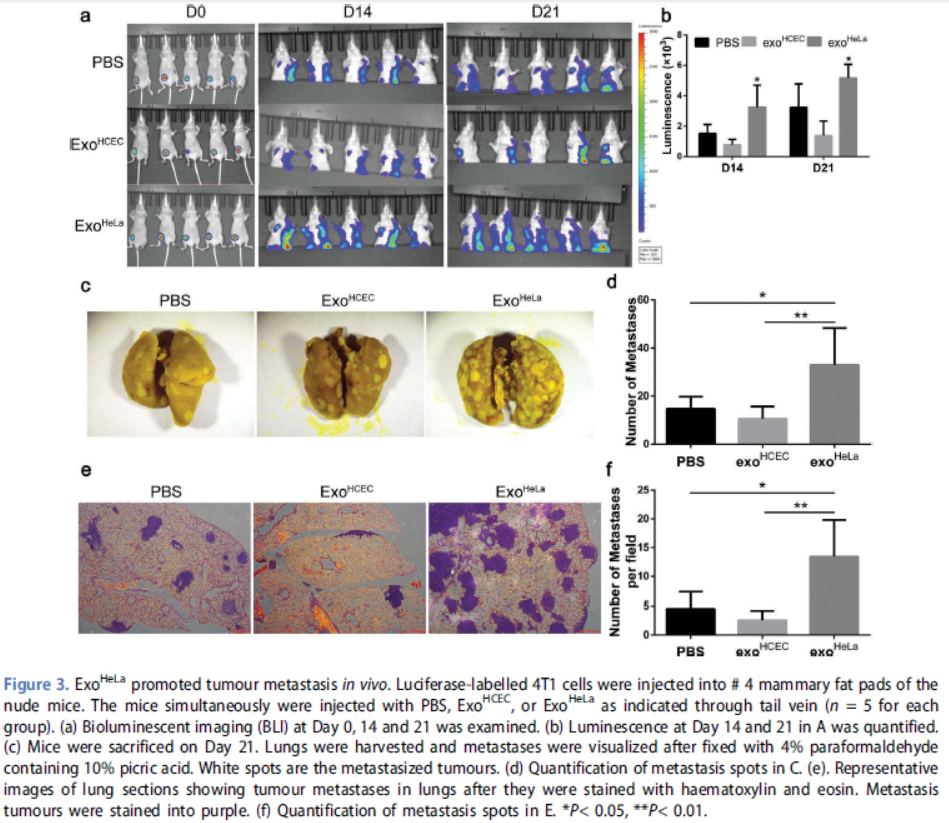
3. ExoHeLa促进体内肿瘤转移
ExoHeLa处理小鼠中检测到远处转移明显,在ExoHeLa治疗小鼠中检测到肺转移比ExoHCEC处理小鼠增长了两倍多。
4. 外泌体mircoRNA并未引起TJ下调
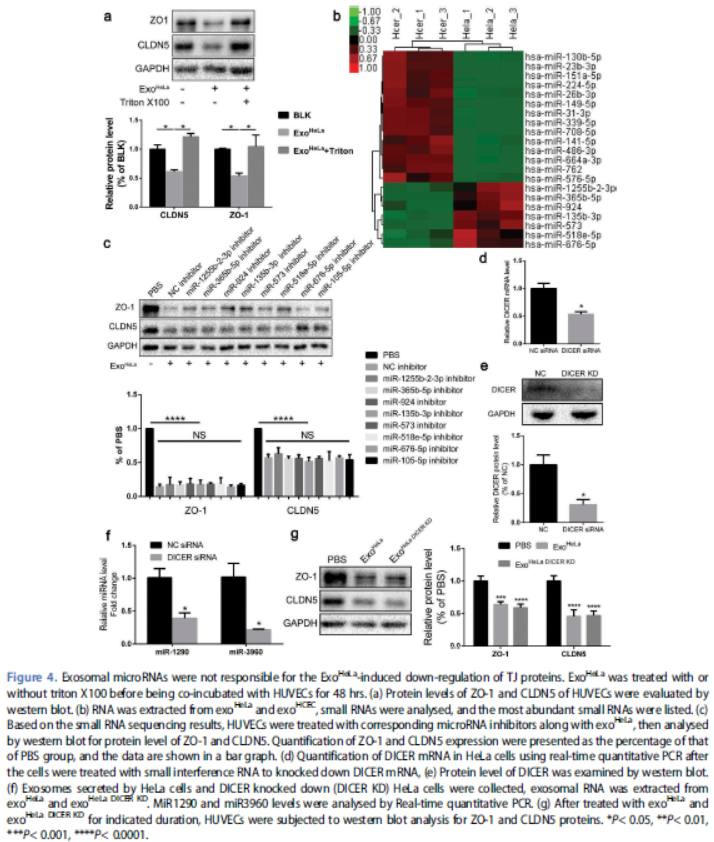
ExoHeLa对EC增殖和TJ蛋白以及其他蛋白(VEGFR2,E2F1)的抑制作用可被Triton(破坏外泌体完整性)逆转,表明外泌体内部成分造成抑制作用。外泌体中miRNA进行测序,发现ZO-1或CLDN5调控潜力的miRNA,然而HUVEC 与miRNA抑制剂的预处理不能逆转ExoHeLa对HUVEC中ZO-1或CLDN5的下调。在HeLa细胞中下调DICER蛋白,外泌体中高表达miRNA(miR-1290和miR-3960)分别减少了60%和75%。然而DICER敲低并未减弱HeLa外泌体对HUVECs 中TJ蛋白下调作用,表明miRNA可能不参与HeLa外泌体对TJ蛋白的抑制作用。
5. 抑制泛素化和自噬都不能逆转ZO-1和CLDN5的蛋白水平
细胞蛋白的降解可能是通过溶酶体或蛋白酶体途径。蛋白酶体抑制剂MG132与ExoHeLa加入HUVEC培养基,发现MG132未反转ExoHeLa对CLDN5和ZO-1的作用。这表明泛素化途径可能不参与TJ蛋白的下调。ExoHeLa处理后HUVEC中的自噬小体在12小时后增加并达到平稳,HUVEC中的自噬受体P62也增加。这些表明ExoHeLa可以诱导EC自噬。3-MA或氯喹预处理HUVEC不能逆转ExoHeLa下调ZO-1或CLDN5表达,表明TJ蛋白质减少不是通过ExoHeLa诱导自噬。

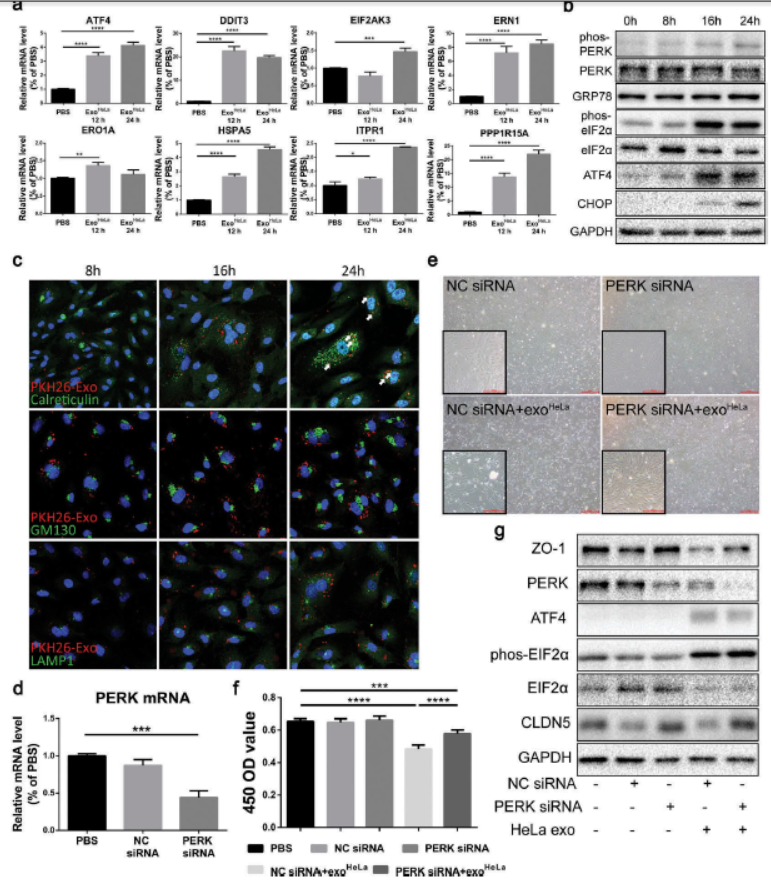
6. ExoHeLa诱导HUVEC内质网应激
通过比较分析ExoHeLa治疗前后HUVEC中的基因表达,GO分析以及通路分析,确定如细胞存活率、迁移和粘附、增殖、RNA表达和炎症等细胞功能发生重大变化,其中内质网应激相对显著。分析内质网应激相关基因的mRNA,发现在ExoHCEC处理的HUVEC中表达升高。此外,蛋白质的磷酸化激酶RNA样内质网激酶和真核生物翻译起始因子2 alpha(eIF2α),以及ATF4的蛋白质水平,葡萄糖调节蛋白与CCAAT /增强子结合蛋白同源蛋白质以时间依赖性升高。这些表明ExoHeLa处理诱导内质网应激。ExoHeLa与ER共定位,钙网蛋白和LAMP1(而非GM130)随外泌体处理增加。内质网应激可增加PERK的激酶活性以促进eIF2α磷酸化导致蛋白质合成和细胞生长下调。抑制HUVEC中的PERK改善HUVEC扩散,恢复ZO-1和CLDN5蛋白的表达,表明ER应激是HUVEC中TJ蛋白的表达。