外泌体的分离和统计你知道多少?
外泌体是直径为30-150 nm的小细胞外囊泡。多年以来,外泌体被认为是细胞成熟过程中产生的“垃圾”。然而,随着最近从不同类型的外泌体中分离出各种蛋白质,脂质和遗传物质(例如,miRNA,mRNA,DNA分子以及lncRNA),它们在细胞通讯和表观遗传调控中的关键作用已经显现。在生理和病理条件下,几乎所有类型的细胞都可以释放外泌体,这些外泌体通过转运关键蛋白和遗传物质(例如miRNA,mRNA和DNA)在细胞通讯和表观遗传调控中发挥重要作用。目前,在Clinicaltrials.gov上注册了127种与外泌体相关的临床试验(2017年为26项试验),涉及多种疾病的治疗和诊断。因此,已经深入研究了基于外泌体的疾病诊断和治疗方法。Dongbin Yang团队所在的多个中国医院与澳大利亚和美国的医疗机构及研究中心于2020.02.19联合发表于Theranostics( 影响因子:8.063)的一篇文章,通过全面分析外泌体分离策略的进展,详细介绍了,当前外泌体分离技术的全景视图,为从各种类型的生物基质中高效分离外泌体的新型方法的发展提供了前景。此外,从基于外泌体的诊断和治疗的角度来看,作者强调定量外泌体和微囊泡分离的问题。

1.差速超离心法分离外泌体的示意图
差速超离心法是利用离心力从300×g到100,000×g的多个离心循环来实现的。每离心一步后,除去细胞、细胞碎片、凋亡小体等微丸,收集上清进行离心。在最后离心后(即除去上清,收集外泌体含球团和污染蛋白。离心在4℃下进行。

2.梯度超离心法分离外泌体的示意图
(A)等密度梯度超离心法是通过在从底部到顶部逐渐降低的层中添加介质来制备的。长时间离心后,细胞外成分包括外泌体、凋亡小体和蛋白聚集物在密度相近的培养基中达到静止位置。然而,由于等密度梯度超离心仅依赖于样品中不同溶质之间的密度差,该方法不能分离与外泌体具有类似浮力密度的物质(如微泡)。(B)移动带梯度超离心法通常包括两个梯度介质段。最上层是密度低于样品所有溶质的介质。底部是高密度的垫子。由于溶质的密度都大于梯度介质的密度,离心后,不仅根据密度,而且根据质量/大小,将所有溶质依次分离,从而可以分离密度相当但大小不一的小泡。

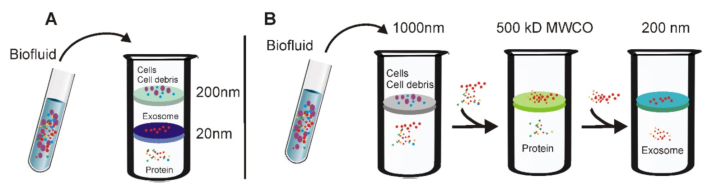
3.超滤法分离外泌体的示意图
(A)串联配置的微过滤器。细胞外液通过串联配置的微滤器,其尺寸排阻极限在20-200 nm附近。当穿过两个膜时,包括细胞碎片,凋亡小体和大部分微囊的大囊泡被捕获在200nm膜中,而直径20至200nm的囊泡则保留在下部20nm滤膜上。(B)顺序超滤。首先将细胞外液通过1000纳米过滤器以除去较大的颗粒(例如细胞或细胞碎片);然后将滤液通过截留值为500kD的第二个过滤器,以除去小颗粒,例如游离蛋白。最后,通过200nm滤光片收集<200nm的外泌体。
4.切向流过滤确保高效的超滤示意图
在切向流过滤期间,进料流平行于膜面流动。所施加的压力使一部分气流根据过滤器的尺寸通过膜。由于膜始终在平行流动力的作用下,可以有效地减少潜在的堵塞。在切向流过滤过程中,将剩余部分重新循环回给料池以进行重复过滤,以确保彻底过滤。

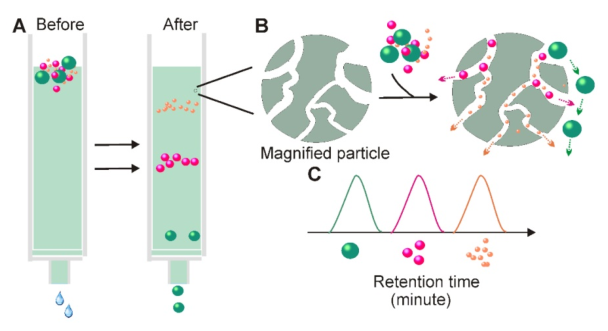
5.体积排阻色谱的外泌体分离原理
当溶液通过由多孔树脂颗粒组成的固定相时,分子可以根据尺寸(A)进行分离;虽然流体动力学半径小于固定相孔的颗粒进入孔中以获取更长的传输距离,但无法进入孔中的较大颗粒直接在树脂(B)周围移动。这导致具有不同尺寸的颗粒表现出不同的保留时间,因此有利于基于尺寸的分离。
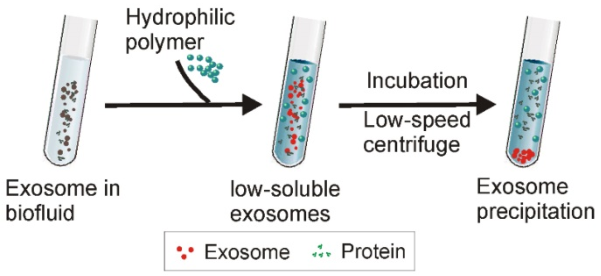
6.聚合物沉淀策略示意图
在将高亲水性聚合物添加到含外泌体的溶液中后,外泌体周围的水分子被聚合物束缚,降低了外泌体的溶解度并诱导其随后的沉淀。低速离心可以很容易地收集外泌体。
7.水两相系统的外泌体分离示意图
当将疏水性更高的聚乙二醇(PEG)和亲水性更高的葡聚糖溶液混合时,可能会发生两相系统。将PEG和右旋糖酐添加到含外泌体的溶液中,然后进行孵育和低速离心后,蛋白质和其他大分子复合物优先聚集在PEG中,而外泌体优先聚集在右旋糖酐相中。

8.基于免疫亲和力的外来体分离示意图
首先,将识别外泌体特异性标志物的抗体固定在固体基质上。用抗体偶联的固体基质孵育含外泌体的液体后,可将外泌体富集到此类固体基质上。可以通过额外的洗脱步骤收集游离的外来体。

9.适体介导的免疫亲和力
适体通过构象互补识别并结合其靶标。在调整了缓冲系统的关键因素(如盐类型和离子强度)之后,适体的形状发生变化并释放结合的靶分子。

10.集成的微流技术可实现结合的外泌体分离和分析
在将含有外泌体的液体添加到鞘层介质中之后,可以基于细胞外囊泡的物理和生化特性,通过不同的方法分离包括外泌体的液体中的颗粒。重要的是,在信号检测平台的帮助下,这些小型化的微流控设备不仅实现了从少量体液中快速隔离外来体,而且还可以进行实时外来体表征以进行原位诊断。

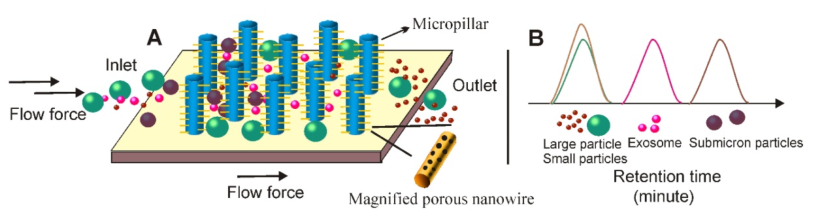
11.纳米线的外泌体脱扣系统的原理
(A)与基于SEC的分离类似,可以通过在均匀分离的微柱壁上压印含多孔硅的纳米线,创建微柱上的纳米线结构。在将含外泌体的液体添加到微柱上的纳米线分层结构后,液体中的颗粒会经历不同的命运;(1)直接从亚微米微柱阵列中排除较大的颗粒(例如细胞);(2)具有亚微米尺寸(例如,细胞碎片)的颗粒能够进入微柱间隔,但无法进入30-200 nm纳米线间隔;(3)小分子(例如蛋白质)在纳米线间隔内移动而不受阻碍;(4) 30–200 nm的粒子(例如外泌体)被纳米线森林所阻挡。(B)具有不同尺寸的颗粒呈现不同的保留时间,因此有利于尺寸依赖性分离。
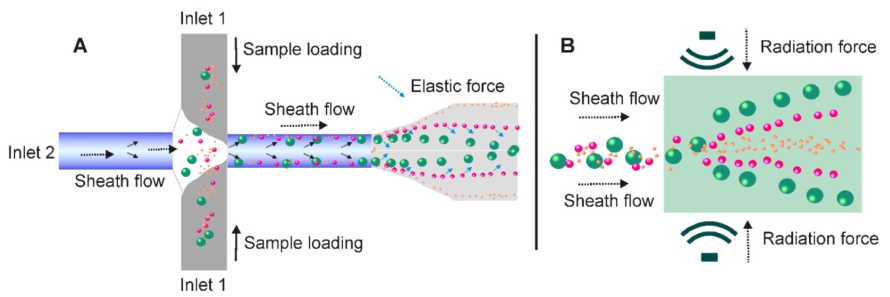
12.非接触式微流控技术简化了外泌体分离程序
(A)在基于粘弹性介质流的微流系统中,含囊泡的流体(从inlet 1添加)遇到鞘流(从inlet 2添加),并首先沿微通道壁对齐。在施加由流体的粘弹性产生的弹性提升力后,外泌体和其他细胞外成分会根据其大小被驱向微通道的中心线,较大的颗粒最终会到达中心线。 (B)在超声波的压力下,具有不同机械性能(例如,可压缩性,尺寸和密度)的颗粒经受不同的辐射力,并导致连续地无接触且依赖尺寸的外泌体分离。
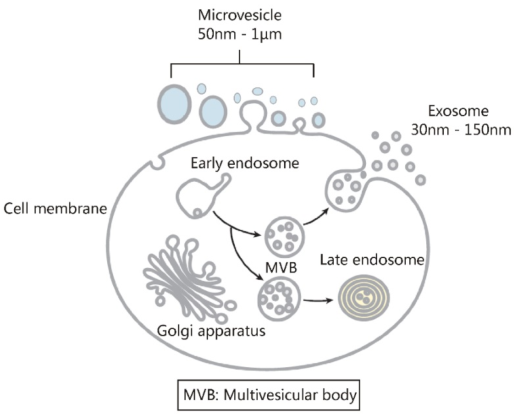
13.细胞外囊泡主要由两种具有相似理化特性的囊泡组成
细胞外囊泡包括外泌体和微囊泡。它们之间的主要区别在于它们的亚细胞起源。微囊泡是从细胞膜上脱落50-1000 nm的颗粒。外泌体是源自内体的30–150 nm细胞外囊泡,它们在细胞膜和多囊体融合后通过胞吐作用分泌到体液中。由于缺乏有效的策略来分离微泡和外泌体,仍然很难精确评估其理化性质和功能。
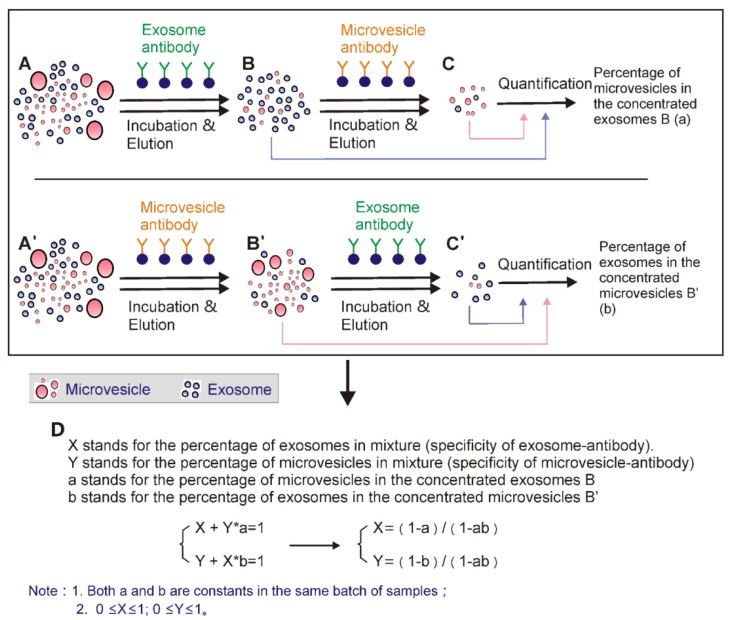
14.通过囊泡和微囊泡标记物特异性抗体计算胞外囊泡的囊泡和微囊泡组分的比例
细胞外囊泡A(A’)通过聚合物沉淀浓缩。然后使用相应的基于抗体的免疫亲和捕获法提取外泌体(B)或微囊泡(B');洗脱后,使用基于抗体的免疫亲和方法从洗脱液中再次提取外泌体(C’)和微泡(C)。然后,对提取的外泌体(B,C')和微囊泡(B',C)进行定量。使用D中所示的公式计算原始细胞外囊泡中外泌体和微囊泡的比例。
参考文献:
Yang Dongbin,Zhang Weihong,Zhang Huanyun et al. Progress, opportunity, and perspective on exosome isolation - efforts for efficient exosome-based theranostics.[J] .Theranostics, 2020, 10: 3684-3707.






