禁食与结直肠癌发展
有证据表明,禁食对包括结直肠癌在内的多种癌症都有广泛的抗肿瘤作用。然而,禁食参与结直肠癌进展的机制尚不清楚。因此,小编为大家带来发表于“NATURE COMMUNICATIONS”上的文章“Fasting inhibits aerobic glycolysis and proliferation in colorectal cancer via the Fdft1-mediated AKT/mTOR/HIF1α pathway suppression”,给大家详细介绍禁食参与结直肠癌的机制。

在本文中,我们发现,在抑制结直肠癌细胞有氧糖酵解和增殖的过程中,禁食会上调FDFT1的表达。FDFT1的下调与结直肠癌的恶性进展和预后不良有关。此外,FDFT1在结直肠癌中起着重要的抑癌作用。在机制上,FDFT1通过负调控AKT/mTOR/HIF1α信号来发挥抑瘤作用。
结 果:
1.禁食损害糖酵解和抑制结直肠癌增殖
为了探讨禁食对结直肠癌细胞增殖的影响,我们采用CCK8和EdU检测细胞增殖。发现禁食显著抑制CRC细胞增殖(图1a,b,d)。接着,为了评估禁食对大肠癌增殖的影响,我们进行了蛋白质组学技术和生物信息学分析(图1c)。“糖酵解/糖异生”途径受到高度下调(图1c)。为了验证禁食对葡萄糖代谢的影响,我们检测了葡萄糖摄取量和乳酸生成量。结果表明禁食降低了细胞中葡萄糖的摄取和乳酸的产生(图1e,f)。细胞外酸化率(ECAR)和耗氧率(OCR)在禁食模拟培养基中培养的细胞中降低(图1h,1i)。此外,在禁食模拟培养基中培养的CT26和SW620细胞中,葡萄糖代谢中限速酶的转录和表达下调(图1g,k)。这些数据表明,禁食在抑制结直肠癌细胞糖酵解方面起着至关重要的作用。
为了进一步验证禁食对体外葡萄糖代谢的影响,我们将CT26细胞皮下注射到BALB/c小鼠体内。结果表明,禁食明显减弱了小鼠的肿瘤生长(图1j,l,m,o)。此外,我们使用18F-FDG microPET/CT成像系统来评估空腹在葡萄糖代谢中的作用。禁食显著抑制体内异种移植模型中18F-FDG的摄取(图1n,p)。综上所述,禁食损害糖酵解和抑制结直肠癌增殖。

2.FDFT1在CRC中因禁食上调并与预后相关
首先,我们证实禁食可以上调FDFT1的表达。在GSE60653数据集中,与对照组相比,禁食组中FDFT1的表达显著增加(图2a)。此外,在iTRAQ蛋白质组学分析中,与对照组相比,禁食组FDFT1的相对表达显著升高(图2b)。qRT-PCR结果表明,禁食组FDFT1的mRNA表达明显增加(图2c),WB显示禁食模拟培养基提高了细胞内FDFT1的蛋白水平(图2d,e)。因此,我们的结果表明,禁食可以上调结直肠癌中FDFT1的表达。接着,我们采用IHC和qRT-PCR方法,比较了FDFT1在人结直肠癌组织和癌旁组织中的表达。FDFT1在大多数肿瘤组织中表达下调(图2f,g)。另外,结直肠癌组织中的FDFT1水平明显低于非癌组织(图2h)。因此,FDFT1在结直肠癌组织中下调。
为了确定FDFT1在结直肠癌中的作用,我们评估了结直肠癌患者FDFT1表达与临床病理特征之间的关系。FDFT1的低表达与肿瘤大小、组织学类型、淋巴结转移、肿瘤分化、浸润、远处转移及临床分 期密切相关。Kaplan-Meier分析显示,高表达的FDFT1预测结直肠癌患者的预后更好(图2i)。
最后,为了验证FDFT1在CRC中的作用,我们使用GEO和GEPIA数据库来分析TCGA数据集。在GDS2609和GDS4382数据集中,结直肠癌组织中FDFT1基因的表达明显低于正常组织(图2j、k)。此外,GEPIA数据库在结直肠癌患者中,低FDFT1与高TNM分期相关(图2l)。TCGA数据集的生存分析表明,FDFT1的高表达与较好的预后相关(图2m)。总之,这些结果表明FDFT1在结直肠癌组织中表达下调,并与结直肠癌的恶性进展和预后不良相关。
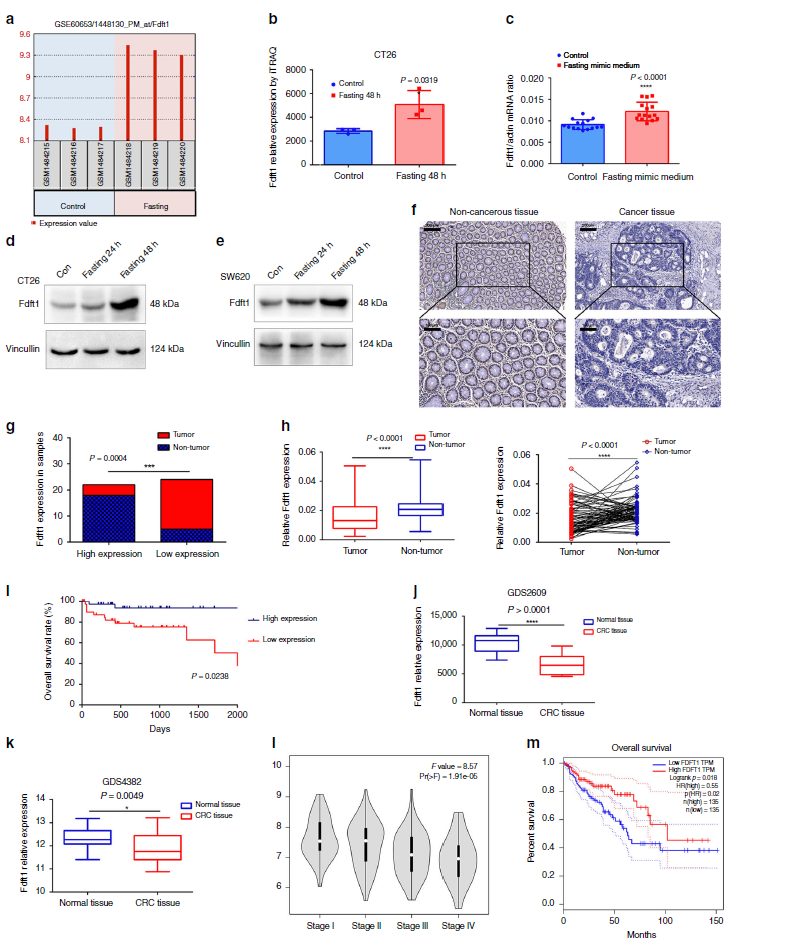
3.FDFT1对结直肠癌细胞增殖的负调控作用
为了评估FDFT1在结直肠癌中的生物学功能,在CT26和SW620细胞中进行了慢病毒介导的FDFT1过表达和敲除。如qPCR和WB结果所示,在CT26和SW620细胞中,FDFT1过表达(图3a,b)和敲除(图3c,d)的效率是有效的。CCK8、EdU和集落形成试验表明,FDFT1过表达抑制CRC细胞增殖,而FDFT1基因敲除促进CRC细胞增殖(图3e-n)为了进一步研究FDFT1对细胞侵袭的影响,我们进行了transwell实验。FDFT1过表达抑制了细胞侵袭(图3o,p),而FDFT1基因敲除增加了细胞侵袭(图3q,r)。总之,FDFT1的过表达抑制了结直肠癌细胞的增殖和侵袭。

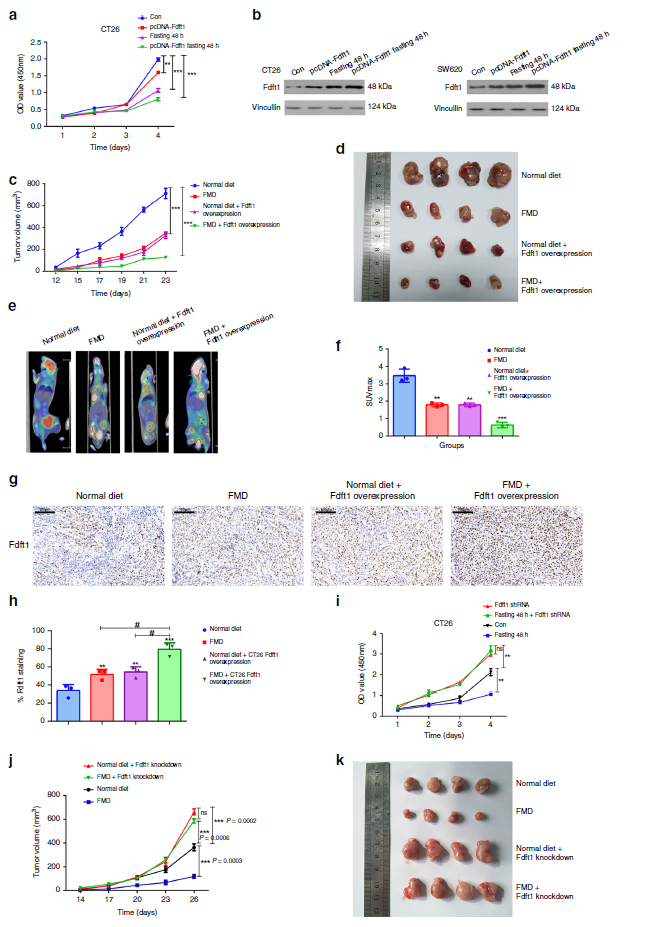
4.FDFT1是CRC患者禁食的重要下游靶点
我们评估禁食对结直肠癌的抑制作用是否随着FDFT1的过表达而增强。我们的数据表明,与单独治疗相比,FDFT1过表达联合禁食对CRC细胞增殖的抑制作用最大(图4a)。此外,WB结果表明,禁食和FDFT1的过表达增加了结直肠癌细胞中FDFT1的蛋白水平。在抑制结直肠癌细胞增殖中,禁食对过表达FDFT1的细胞中FDFT1的表达水平产生了相加效应(图4b)。接着,为了证实FDFT1过表达与禁食联合应用对体外观察到的细胞增殖的影响,我们将CT26细胞和FDFT1高表达的CT26细胞皮下注射BALB/c小鼠。我们的结果表明,FMD和FDFT1的过表达都抑制了小鼠的肿瘤生长。与单用FMD或单用FDFT1高表达相比,FMD联合FDFT1高表达对小鼠肿瘤生长的抑制作用最为显著(图4c,d)。与这些结果一致,在异种移植模型中,FMD联合FDFT1过表达对18F-FDG摄取具有最显著的抑制作用(图4e,f)。此外,IHC结果表明,FMD或FDFT1的过表达均能提高体内FDFT1的蛋白水平。(图4g,h)。最后,为了证实我们的体外观察,我们在BALB/c小鼠皮下注射CT26细胞和FDFT1基因敲除CT26细胞。当FMD联合FDFT1敲除CT26细胞植入体内时,禁食对CRC肿瘤生长的抑制作用被逆转(图4j,k)。总之,这些结果表明FDFT1是禁食的一个重要下游靶点, 它介导了CRC细胞增殖的抑制。
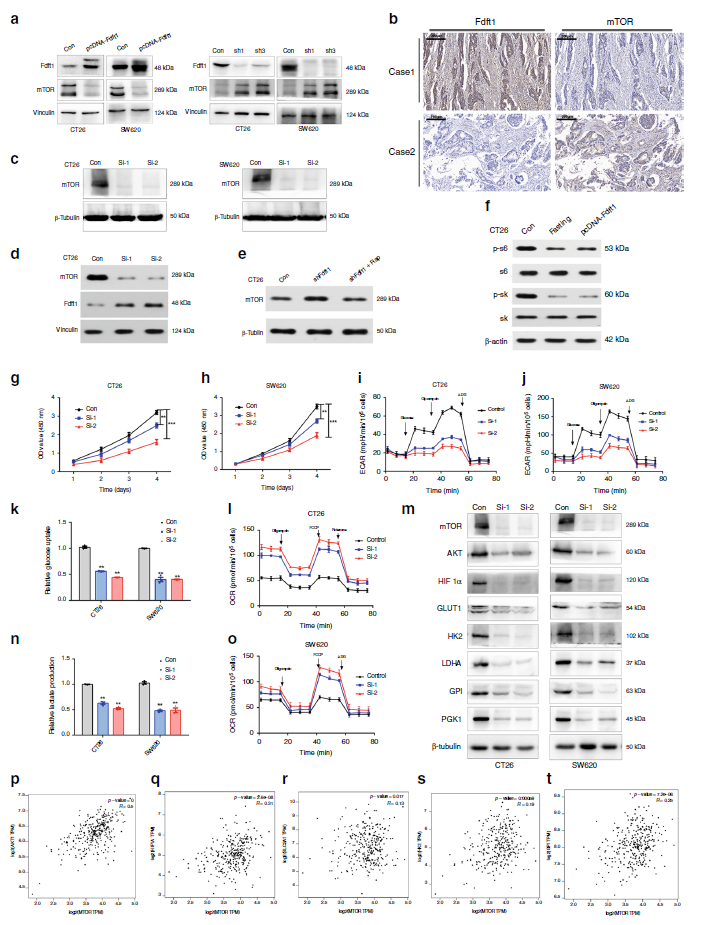
5.在CRC中mTOR水平与FDFT1水平呈负相关
为了确定FDFT1抑制结直肠癌细胞增殖的信号通路,我们再次进行了蛋白组学和生物信息学分析。我们推测FDFT1抑制了mTOR相关通路,从而抑制了结直肠癌细胞的糖酵解。我们发现FDFT1的表达与mTOR的表达呈负相关(图5a,5b)。接着,我们评估了mTOR沉默对FDFT1表达水平的影响,以及用mTOR抑制剂治疗是否会逆转FDFT1基因敲除的影响。我们发现mTOR沉默增加了CT26细胞中FDFT1的表达水平。mTOR抑制剂可防止FDFT1基因敲除细胞中mTOR蛋白水平的升高(图5c-f)。此外,我们通过CCK8检测mTOR对结直肠癌细胞增殖的影响,发现mTOR的沉默降低了细胞增殖(图5g,h)。这表明mTOR是结直肠癌细胞增殖的一个阳性调节因子。其次,我们评估mTOR对结直肠癌细胞糖酵解的影响。沉默mTOR可降低CRC细胞的葡萄糖摄取、乳酸生成以及糖酵解相关蛋白的表达(图5i-o)。最后,我们分析了TCGA数据集中mTOR表达与相关糖酵解基因编码的蛋白表达的相关性。mTOR的表达与它们的表达有很强的相关性(图5p-t)。因此,这些观察结果支持了mTOR对CRC细胞增殖中有氧糖酵解的积极调节的假设。
6.FDFT1通过抑制CRC中AKT-mTOR-HIF1通路来抑制糖酵解
我们的结果表明FDFT1在CT26和SW620细胞中是葡萄糖代谢的负调控因子(图6a-j)。此外,我们发现过表达FDFT1降低了CRC细胞中AKT、mTOR和HIF1细胞的蛋白和mRNA的表达(图6k,n)。相反,FDFT1基因敲除增加了AKT、mTOR和HIF1细胞的蛋白和mRNA表达(图6l,n)。这些结果表明,FDFT1通过抑制CRC中的AKT-mTOR- HIF1α途径来抑制糖代谢。

7.禁食与mTOR抑制剂协同抑制CRC增殖及FDFT1/AKT-mTOR-HIF1α通路在CRC患者中的临床意义
我们探讨了雷帕霉素是否能与FMD协同抑制结直肠癌的增殖。结果表明,FMD和1 mg/kg剂量的雷帕霉素均能强烈抑制CRC的增殖,显著提高生存率(图7a-c)。此外,我们发现雷帕霉素治疗可以增加FDFT1蛋白和mRNA的表达水平(图7d,e)。我们还发现禁食和雷帕霉素在延缓结直肠癌进展、提高生存率和上调FDFT1方面有协同作用(图7a-e)。接着,我们分析了TCGA数据集,发现 FDFT1高表达和AKT1、mTOR、HIF1α、GLUT1和HK2低表达的患者比FDFT1低表达、AKT-mTOR-HIF1α途径和糖酵解基因高表达的患者存活时间更长(图7f-j)。
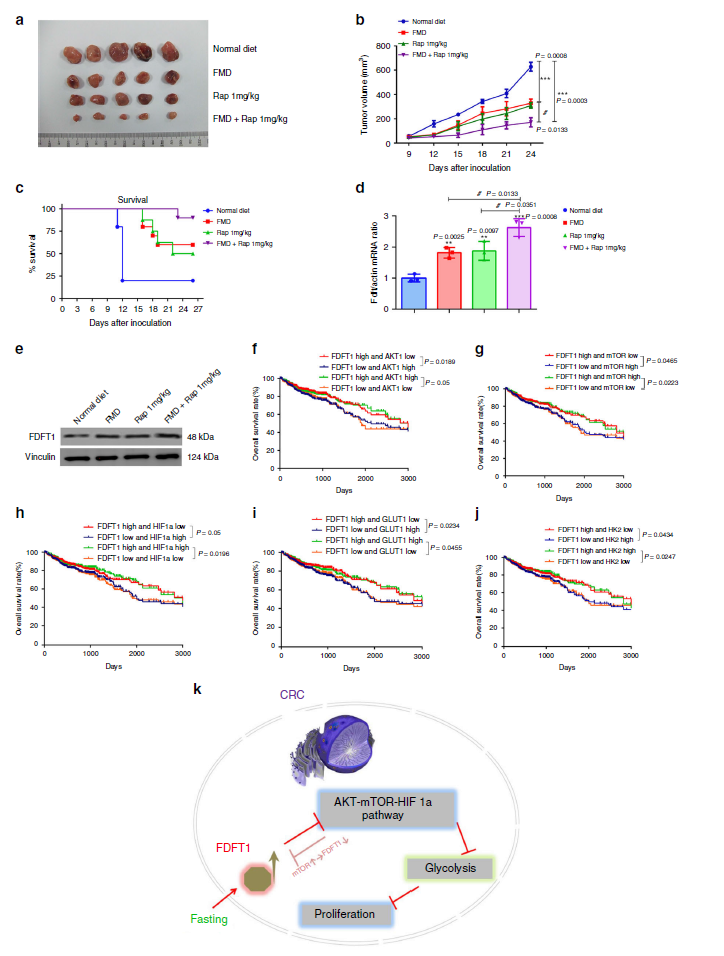
结 论:
禁食通过FDFT1/AKT-mTOR-HIF1α轴对结直肠癌细胞葡萄糖代谢和增殖具有负调节作用。基于mTOR抑制的治疗可能是一种有前途的治疗CRC的方法。






