自噬依赖性铁死亡驱动肿瘤相关巨噬细胞极化
导 语:
肿瘤微环境(TME):由恶性肿瘤细胞、免疫细胞和其他成分组成的动态网络,影响着癌症的发展和治疗。设计针对肿瘤微环境TME内癌细胞与周围免疫细胞之间的相互作用信号和分子的新型抗癌药是肿瘤治疗的热点。肿瘤相关巨噬细胞(TAM)是招募入肿瘤微环境TME的骨髓源性免疫细胞。自噬是体内的一种稳态机制,在肿瘤生物学中起作用。自噬依赖性铁死亡与巨噬细胞的极化有何联系,今天,我们先睹为快。

技术路线:

结 果:
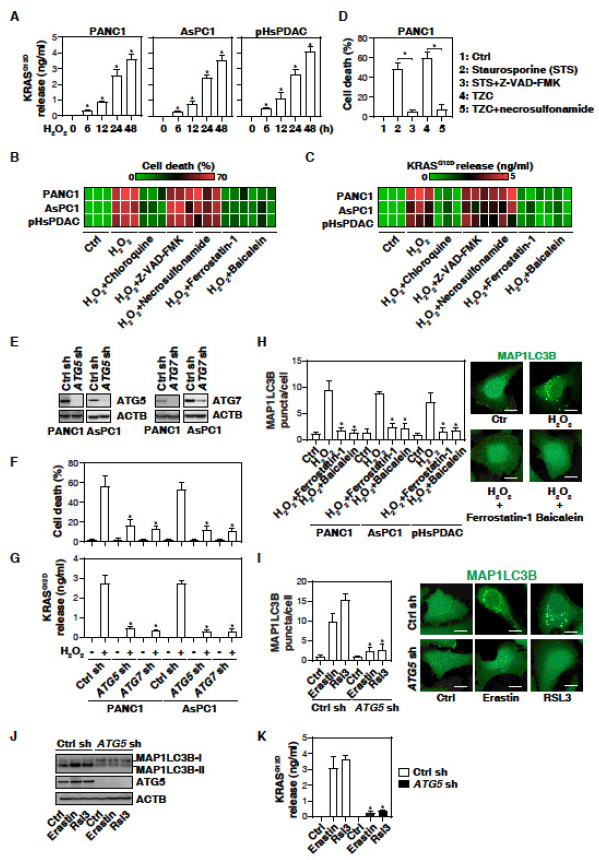
1. 癌细胞自噬依赖性铁毒性死亡期间,释放KRASG12D到细胞外
PDAC的启动和发展与氧化应激有关。H2O2诱导两种人类PDAC细胞系PANC1、AsPC1细胞以及原代人PDAC细胞释放KRASG12D,H2O2引起的细胞死亡和释放KRASG12D(图1C)可被自噬抑制剂阻断,但凋亡抑制剂或坏死性凋亡抑制剂没有此效应。凋亡抑制剂Z-VAD-FMK有效阻止星形孢菌素引起的死亡,坏死抑制剂阻止了PANC1细胞中的TNF+ Z-VAD-FMK +放线菌酮的致死效应。此外,敲除自噬相关基因抑制H2O2诱导的细胞死亡和KRASG12D释放,表明自噬依赖性细胞死亡促进氧化应激期间KRASG12D蛋白的释放。研究表明自噬依赖性细胞死亡是一种独特的脂质过氧化介导的死亡。铁死亡抑制剂阻止H2O2诱导的自噬体标记MAP1LC3B形成、细胞死亡和KRASG12D释放。铁死亡诱导剂效果相反。这些表明,铁死亡可导致PDAC细胞释放KRASG12D蛋白。
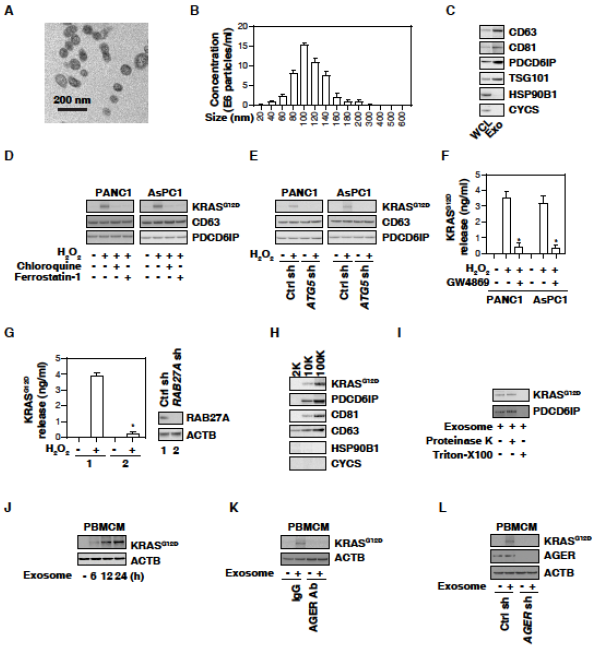
2. 巨噬细胞摄取外泌体KRASG12D需要AGER
外泌体是内体来源的细胞外囊泡,氧化应激和细胞死亡过程中介导细胞间通讯。在PANC1和AsPC1细胞分离外泌体,外泌体大小为50-150 nm,表达外泌体阳性标记,但不表达阴性标记。外泌体中KRASG12D蛋白增加,氯喹、敲低ATG5和ferrostatin-1阻断外泌体中H2O2诱导的KRASG12D蛋白积累。外泌体生物抑制剂GW4869和RAB27A抑制PANC1细胞释放KRASG12D。绝大多数1万或10万离心后的沉淀是外泌体,观察到KRASG12D存在于10K或100K离心后的蛋白质颗粒。这些发现表明自噬依赖铁死亡导致含KRASG12D的外泌体释放。
人外周血单核细胞衍生的巨噬细胞(PBMCM)通常不含KRASG12D,但以时间依赖性方式摄取H2O2诱导的肿瘤外泌体,提示肿瘤KRASG12D可以进入巨噬细胞。用H2O2诱导的癌症外泌体培养PBMCM,抗AGER抗体或敲低AGER,抑制PBMCM吸收KRASG12D。这些发现表明AGER介导巨噬细胞摄取KRASG12D。
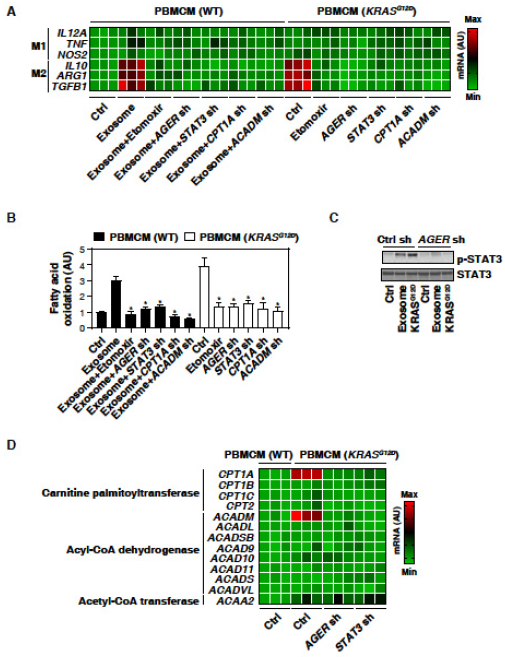
3. KRASG12D通过STAT3依赖性脂肪酸氧化促进巨噬细胞M2极化
PBMCM中过表达KRASG12D,M1分化生物标志物上调,H2O2诱导的癌症外泌体也增加PBMCM的M2标记表达,表明摄取KRASG12D可能会导致致癌的M2极化。脂肪酸氧化可促进M2巨噬细胞极化。过表达KRASG12D或 H2O2诱导的的癌症外泌体可增加PBMCM中的脂肪酸氧化,该过程被敲低AGER所抑制,加入脂肪酸氧化药理抑制剂课抑制M2极化。以上表明,脂肪酸氧化有助于KRASG12D介导的M2巨噬细胞极化。p-STAT3在过表达KRASG12D或癌症外泌体处理的PBMCM中被上调,STAT3磷酸化被敲低AGER抑制。敲低STAT3减少PBMCM细胞脂肪酸氧化和M2巨噬细胞极化。由此可见,KRASG12D诱导的脂肪酸氧化和M2极化需要AGER介导的STAT3激活。脂肪酸氧化代谢途径的基因CPT1A和ACADM在过表达KRASG12D的PBMCM中上调,该作用被AGER或STAT3的敲低所抑制。以上结果表明,AGER-STAT3途径对于KRASG12D诱导的脂肪酸氧化和随后的巨噬细胞M2极化至关重要。
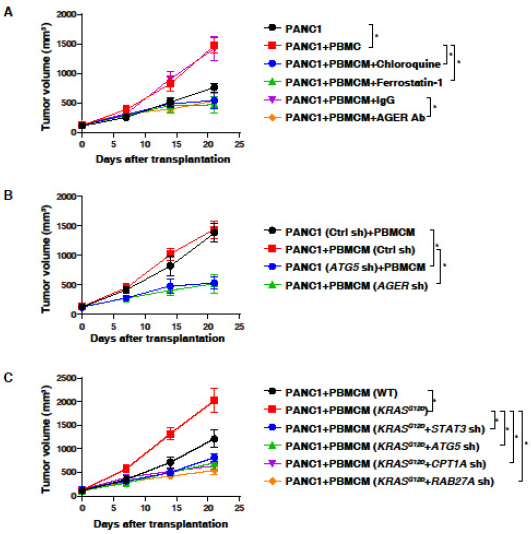
4. 阻断KRASG12D的释放和摄取可抑制巨噬细胞介导的胰腺肿瘤体内生长
利用免疫缺陷的NOD SCID小鼠建立异种移植瘤模型,与单独PANC1细胞相比,PBMCMs促进胰腺肿瘤的生长,局部注射氯喹,ferrostatin-1或抗AGER抗体抑制PANC1加PBMCM引起的肿瘤生长,PANC1细胞中敲低ATG5或PBMCM中敲低AGER,降低PANC1细胞和PBMCM所产生的肿瘤生长。敲低STAT3,ATG5,CPT1A或RAB27A可令过表达KRASG12D的PBMCMs细胞失去肿瘤促进作用。这些发明,将KRASG12D或KRASG12D蛋白转移到PBMCM中可驱动PDAC进展,这一效应涉及ATG5,STAT3,CPT1A和RAB27A途径。
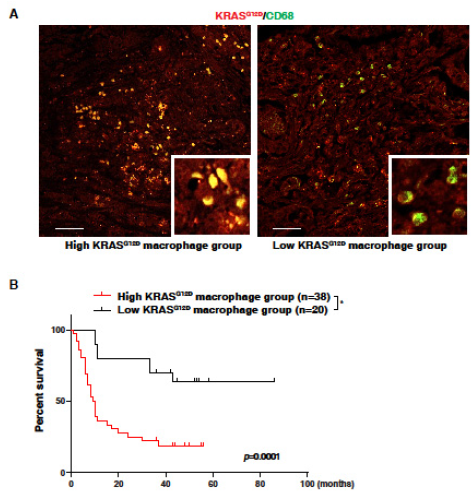
5. 巨噬细胞中高KRASG12D表达与PDAC存活率低有关
使用59位胰腺癌患者的组织芯片,在CD68 +巨噬细胞中检测到KRASG12D的表达。CD68 +巨噬细胞高表达KRASG12D的患者(高KRASG12D巨噬细胞组),总体生存率比低KRASG12D巨噬细胞组的患者低。这些表明巨噬细胞对KRASG12D的摄取增加可能与人类胰腺癌进展有关。
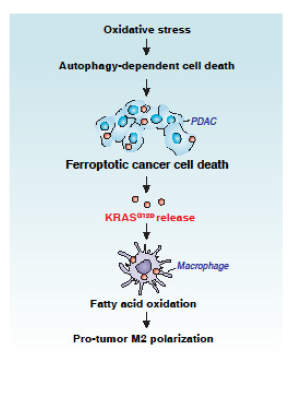
总结:
1. KRASG12D,一种与损伤相关的分子模式(DAMP),在氧化应激期间从细胞释放;
2.自噬依赖性的铁死亡是ROS诱导的PDAC细胞释放KRASG12D所必须;
3. KRASG12D可通过外泌体从铁死亡癌细胞传递至巨噬细胞;
4. KRASG12D通过STAT3依赖性的脂肪酸氧化激活,促进巨噬细胞极化;
5. KRASG12D转移(从癌细胞转移到巨噬细胞)的药理和遗传抑制作用,可抑制巨噬细胞刺激的人PDACs生长。






