TRIM24促进胶质母细胞瘤细胞的生长和侵袭性
胶质母细胞瘤干细胞(GSCs)是胶质母细胞瘤(GBM)细胞的一个亚群,对肿瘤的侵袭和抗肿瘤治疗具有重要意义。然而,对TRIM24在GSCs中的作用和机制知之甚少。今天小编为大家带来发表于“Neuro-Oncology”的文章“TRIM24 Promotes Stemness and Invasiveness of Glioblastoma Cells via Activating SOX2 Expression”,为大家详细介绍TRIM24在胶质母细胞瘤细胞中的作用。

在本研究中,我们发现TRIM24与CD133和Nestin在GBM组织和肿瘤球细胞中共表达。限制性稀释试验和异种移植实验表明,TRIM24表达的下调降低了GSC的自我更新能力和侵袭性生长。TRIM24表达水平与瘤周T2WI异常体积呈正相关。拯救实验表明TRIM24参与了GBM的渗透传播。染色质免疫沉淀、报告基因分析、PCR、Western blot和免疫组化结果显示TRIM24在体内外均能激活SOX2的表达,调节GBM的干细胞和侵袭。最后,通过检测我们研究的样本和探索外部数据库,验证了TRIM24和SOX2之间的密切关系。
结 果:
1.TRIM24富集于GSCs中
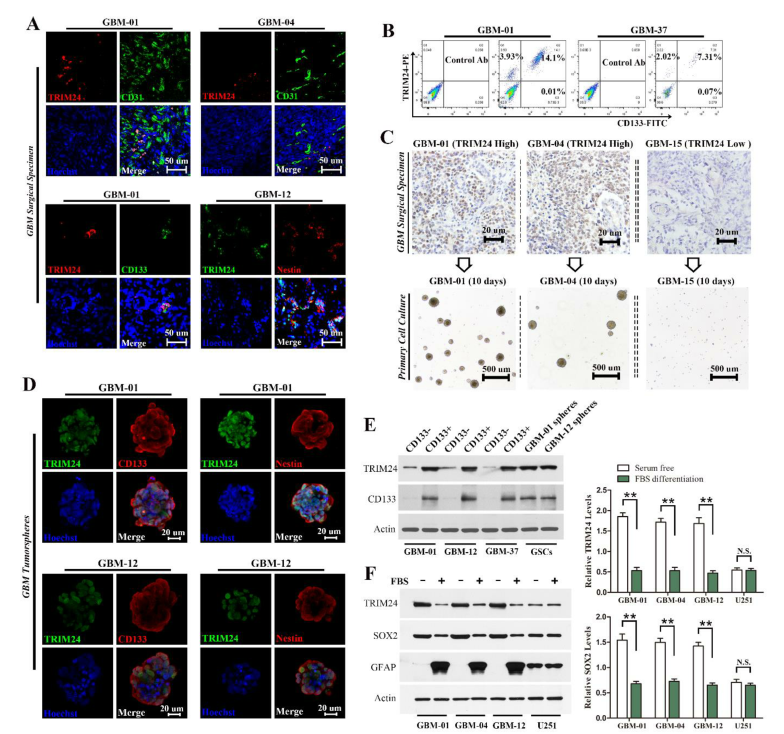
由于GSCs优先位于血管周围,为了评估TRIM24与GSCs之间的关系,我们用TRIM24抗体和内皮标志物CD31标记GBM手术标本。免疫荧光分析显示血管周围部分GBM细胞有较强的TRIM24染色。此外,TRIM24通常与干细胞标记物共表达,包括CD133和Nestin(图1A)。流式细胞术分析证实TRIM24和CD133在一部分GBM细胞中重叠表达(图1B)。接着为了评估TRIM24表达与肿瘤球形成能力间的关系,我们在干细胞允许培养基中培养了GBM细胞。TRIM24低表达的肿瘤细胞不能增殖,而TRIM24高表达的肿瘤细胞至少能增殖5代(图1C)。另外,TRIM24,CD133和Nestin在肿瘤球细胞中共表达(图1D)。Western-blot分析显示FACS分类的CD133+细胞与CD133-细胞相比具有高的TRIM24表达(图1E)。此外,与GBM细胞系和正常星形胶质细胞相比,GSCs和NSCs中内源性TRIM24水平明显升高(图1F)。
2.TRIM24对胶质母细胞瘤细胞的生长至关重要
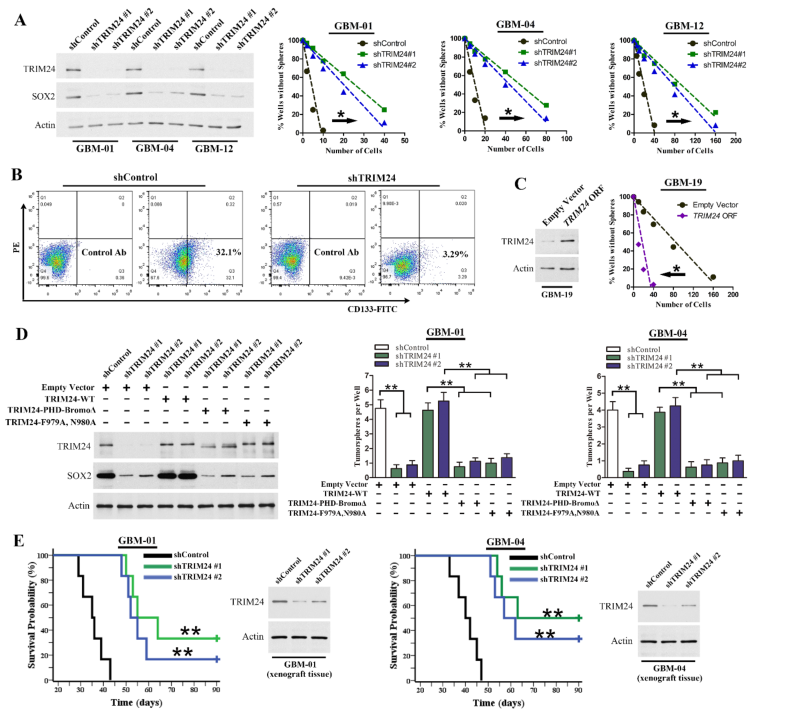
鉴于TRIM24在具有GSC特性的GBM细胞中富集,我们推测TRIM24可能促进GSC的维持。限制性稀释试验表明,TRIM24表达的降低显著地抑制了GSCs的肿瘤球形成能力(图2A)。来自新鲜手术标本的原代分离GBM细胞中TRIM24的敲除降低了CD133+亚群(图2B)。另一方面,与对照组相比,TRIM24的过表达增加了GBM-19肿瘤球细胞的成球能力和原代分离GBM-19细胞的CD133+亚群(图2C)。此外,TRIM24基因敲除导致的肿瘤球形成能力的损伤可以通过重新导入抗shRNA的TRIM24-WT来恢复(图2D)。为了进一步探讨TRIM24在体内的功能,我们将不同处理的GSCs移植到裸鼠脑中。与非靶向对照组相比,TRIM24基因敲除抑制了肿瘤的形成,大大延长了动物存活时间(图2E)。
3.TRIM24通过驱动SOX2表达影响GBM干性
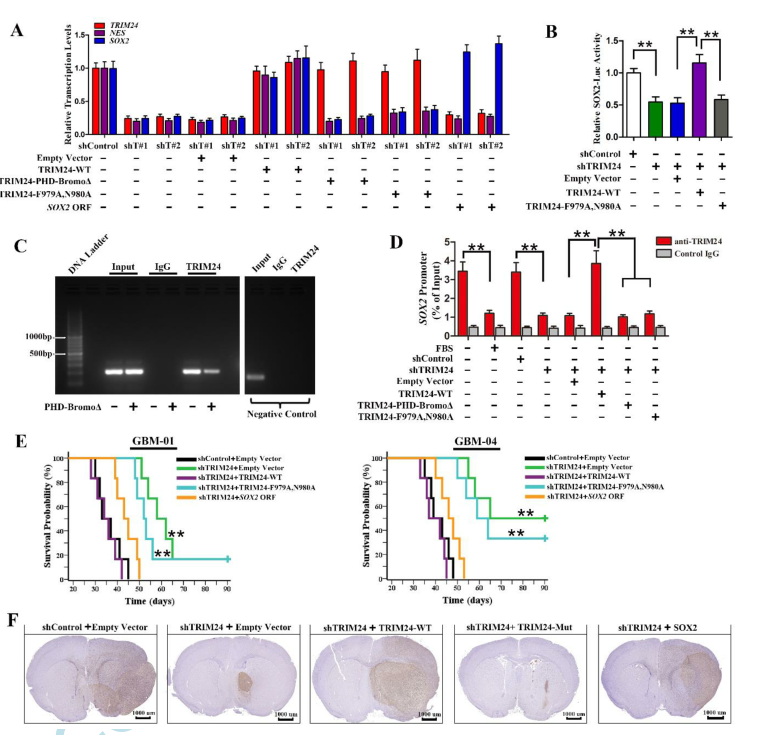
我们进行了RNA测序和实时RT-PCR分析,并着重研究了GBM增殖所必需的可能调节因子。我们发现,TRIM24敲除后SOX2的转录水平显著下调(图3A)。双荧光分析显示TRIM24基因敲除显著降低了SOX2启动子报告子的相对荧光素酶活性(图3B)。此外,芯片分析显示TRIM24-WT与SOX2启动子结合,而TRIM24突变体没有(图3C和D)。此外,该结合被TRIM24缺失或FBS诱导分化下调(图3D)。功能分析显示在缺失TRIM24后,体外肿瘤球形成能力和体内肿瘤形成能力的降低可以通过再次引入SOX2来挽救(图3E)。这些结果提示TRIM24激活SOX2表达,调节GSCs的自我更新和肿瘤形成。免疫组织化学分析表明,对照组GSCs浸润到小鼠脑实质和白质束。有趣的是,TRIM24下调的肿瘤细胞形成了边界清楚的椭圆形移植物(图3F)。
4.TRIM24表达水平与T2加权MRI异常相关
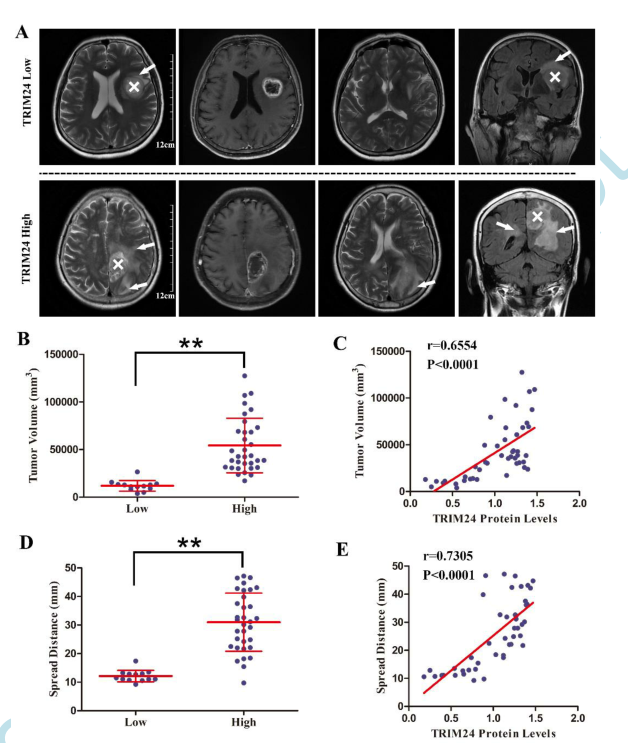
鉴于广泛的侵袭性生长是GBM患者预后不良的重要因素,并且TRIM24影响异种移植的组织学特征,我们试图将TRIM24的表达水平置于临床背景中。结果显示高TRIM24表达的GBM患者与低表达的患者相比,肿瘤周围T2WI异常体积更大(图4A和B)。TRIM24的表达与肿瘤体积之间也存在显著相关性(图4C)。此外,通过测量最大扩展,也观察到了类似的结果(图4D和E)。
5.TRIM24通过SOX2促进GBM的体内外侵袭性
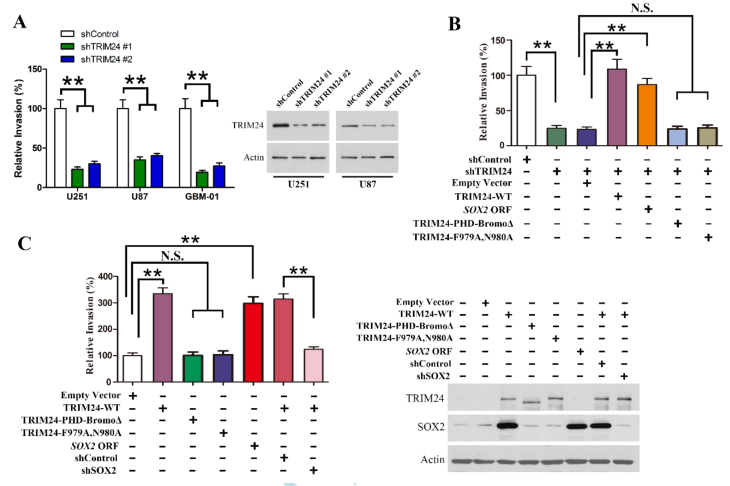
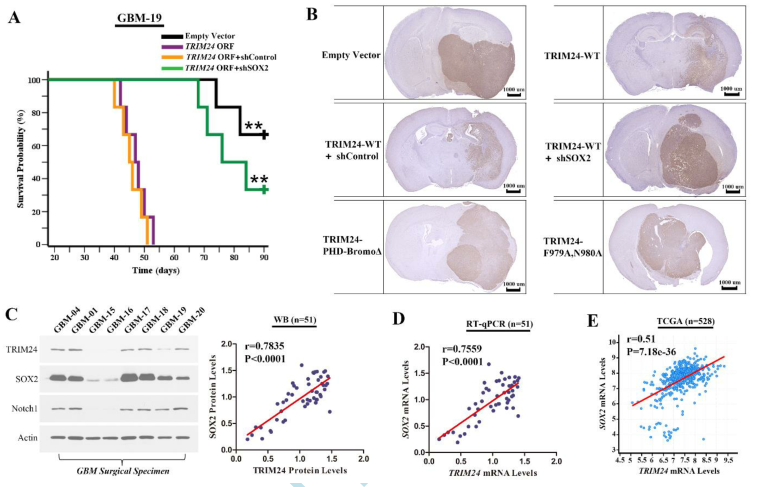
TRIM24在高侵袭性GBMs中的过表达促使我们深入研究TRIM24对细胞迁移和侵袭的影响。愈合试验表明,TRIM24基因敲除抑制了大量GBM细胞的迁移,TRIM24基因上调增强了GBM细胞的迁移。Transwell分析表明,TRIM24的敲除导致原代分离的GBM培养物和成熟的GBM细胞系的侵袭减少(图5A和B)。另一方面,上调TRIM24的表达增加了GBM细胞的侵袭能力(图5C)。接下来,我们将不同感染细胞原位移植到裸鼠体内。在携带TRIM24上调细胞的小鼠中,神经症状出现的潜伏期显著缩短(图6A)。异种移植切片的免疫组化分析表明,TRIM24的过表达增加了GBM细胞的渗透性传播(图6B)。Transwell分析显示,通过重新引入SOX2或TRIM24-WT(图5B),可以挽救TRIM24基因敲除后GBM细胞侵袭力的下降。同样,在TRIM24基因敲除后,GSC肿瘤球细胞的侵袭性降低,可以通过重新导入SOX2或TRIM24-WT,但不通过TRIM24突变体。另一方面,在体外和体内,SOX2沉默抑制了TRIM24上调细胞的侵袭性表型(图5C;图6B)。
6.TRIM24-SOX2相关性存在于临床环境中
为了进一步探讨TRIM24和SOX2在临床中的关系,我们评估了它们在手术标本中的表达水平。Western blot分析显示TRIM24和SOX2蛋白水平之间存在显著相关性(图6C)。通过使用RT-qPCR分析和探索外部数据库(图6D和E),发现它们在转录水平上的紧密联系也很明显。此外,免疫荧光分析显示TRIM24和SOX2染色在肿瘤切片中强烈重叠,进一步证实了它们在GBMs中的密切相关性。
结 论:
TRIM24在GSCs中特别富集,并调控GSC的特性。此外,临床和实验数据建立了TRIM24在肿瘤干细胞中激活SOX2表达的新的功能机制。这些发现表明,TRIM24是GBM治疗的一个有吸引力的治疗靶点。






