miR-26a调节前列腺癌细胞胞外囊泡的分泌
细胞外囊泡(EV)参与癌症进展过程中的细胞间通讯,因此,阐明肿瘤细胞中EV分泌的机制将有助于EV靶向肿瘤治疗的发展。今天小编给大家介绍发表于“SCIENCE ADVANCES”上的文章“miR-26a regulates extracellular vesicle secretion from prostate cancer cells via targeting SHC4, PFDN4, and CHORDC1”,带大家详细了解EVs参与前列腺癌进展的机制。

在这里,我们进行了基于miRNA的高通量筛选,使用外筛试验来识别EV分泌的调节因子。通过这种方法,我们鉴定了miR-26a参与前列腺癌(PCa)细胞的EV分泌。此外,我们发现SHC4、PFDN4和CHORDC1基因在PCa细胞中调节EV的分泌。在体内研究中,这些基因被抑制。
结 果:
1.PCa中调控EV分泌的miRNA的筛选
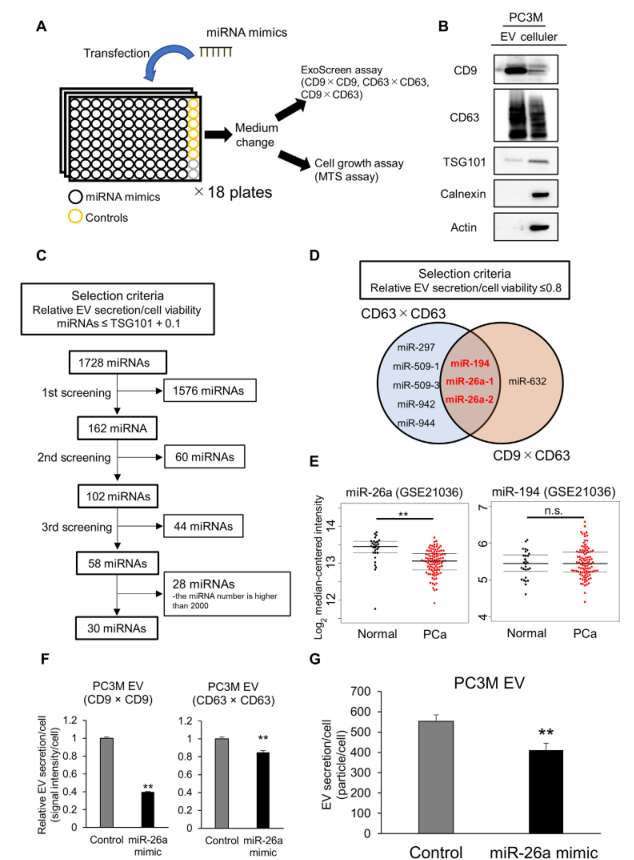
首先,我们将PC3M细胞接种于96孔板中,用miRNA模拟物进行转染。转染24小时后,将培养基改为无血清培养基,再孵育48小时。之后,收集CM,评估EV水平(图1A)。我们对传统的EV标记物进行免疫印迹,并通过免疫印迹确认来源于PC3M的EV为CD9和CD63阳性(图1B);因此,我们使用CD9抗体检测第一次筛查中CD9/CD9双阳性EV分泌的变化。
接下来,我们进行了miRNA的筛选。根据图1C所示的标准选择miRNAs。我们进行了三次筛选并选择了58个miRNAs。在排除数量大于2000的miRNAs后,我们选择了30个miRNAs(图1C)。接下来,为了进一步验证最初的筛选,我们评估这30个miRNAs中CD63/CD63阳性EVs和CD9/CD63双阳性EVs的分泌情况。根据EV分泌/细胞活力相对值低于0.8的标准,我们选择miR-26a和miR-194作为调节EV分泌的候选miRNA(图1D)。与正常前列腺组织相比, miR-26a在前列腺癌组织中显著下调,而miR-194的表达与正常前列腺组织相比没有差异(图1E)。这些结果提示miR-26a参与PCa的EV分泌。此外,转染miR-26a模拟物的PCa细胞分泌的EVs颗粒数显著减少(图1F,G)。因此,选择miR-26a进行下一步分析,并探讨miR-26a是否调节PCa中EV的分泌。
2.SHC4、PFDN4和CHORDC1参与miR-26a介导的EV分泌
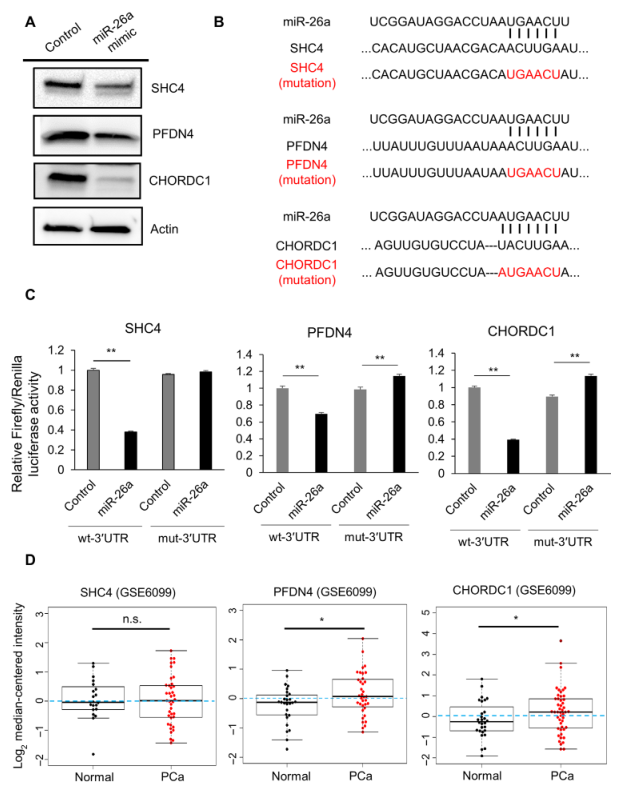
为了进一步阐明miR-26a在EV分泌中的分子机制,我们鉴定了miR-26a的靶基因。在miR-26a模拟物或对照物转染后,对PC3M和PC3进行mRNA微阵列分析。发现PCa细胞中miR26a的过表达下调了88个基因(图2A)。然后,为了筛选调节EV分泌的基因,利用ExoScreen进行高通量筛选。将PC3M细胞接种于96孔板上,转染88个候选基因的siRNA。转染24小时后,将培养基改为无血清培养基,培养48小时。从转染的PC3M细胞中,收集CM,通过ExoScreen和MTS分析评估EV水平(图2B)。CD9-和CD63-阳性的EVs通过ExoScreen进行评估。所选基因的标准如图2C所示。最后,SHC4,PFDN4,CHORDC1和PRKCD被确定为调节EV分泌的候选基因(图2C)。接着,我们探究这些基因对siRNA处理后PCa细胞分泌EVs的影响。发现转染SHC4、PFDN4和CHORDC1三个基因的siRNAs后,PCa细胞分泌的EV水平降低,表明这些基因是EV分泌的调节因子(图2D和E)。qRT-PCR证实了转染siRNA的PCa细胞中这三个基因的下调(图2F)。这些结果提示SHC4、PFDN4和CHORDC1参与了PCa中EV分泌的上调。

3.miR-26a通过靶向SHC4、PFDN4和CHORDC1抑制PCa癌细胞EV分泌
通过qRT-PCR和免疫印迹分析,发现miR-26a抑制PCa细胞中SHC4、PFDN4和CHORDC1的表达水平(图3A)。然后,为了确定miR-26a是否直接调控这些基因,进行了荧光素酶报告分析(图3B)。发现miR-26a的异位表达显著抑制野生型SHC4、PFDN4和CHORDC1 3’UTRs的荧光素酶活性(图3C)。此外,我们还研究了这些基因在PCa组织中的表达水平。发现PCa组织中PFDN4和CHORDC1的表达水平明显高于正常组织(图3D)。
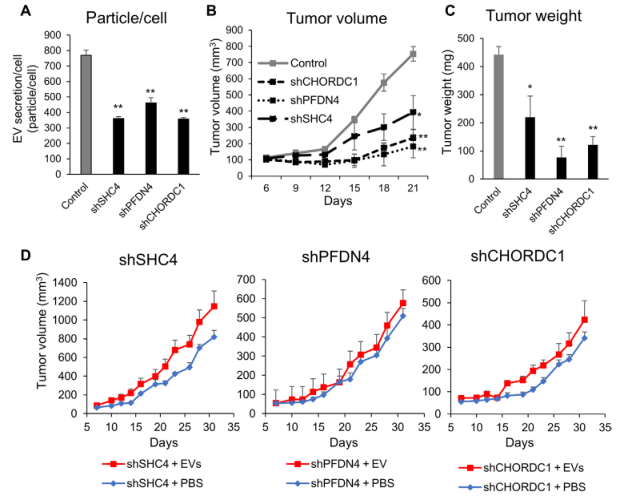
4.PFDN4、SHC4和CHORDC1在体内调节EV分泌和促进肿瘤发生
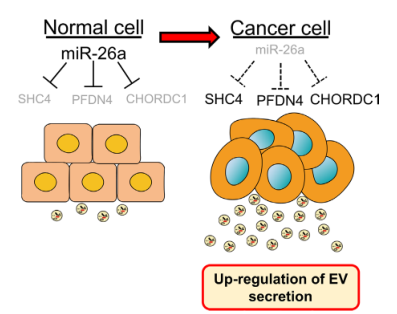
miR-26a抑制PCa的肿瘤形成,其抗肿瘤活性可能与miR-26a抑制PCa细胞分泌EV有关。为了证实miR-26a靶向基因在PCa衍生EVs中的作用,我们进行了体内实验。研究发现,这些基因的缺失抑制了EV的分泌(图4A)。我们评估了SHC4、PFDN4和CHORDC1下调在该模型中的作用,发现缺失这些基因的异种移植的小鼠肿瘤较小,重量小于对照小鼠(图4B,C)。此外,注射PC3M来源的EVs的裸鼠肿瘤组织显示部分挽救的肿瘤大小和重量(图4D)。上述数据表明,miR26a与其靶基因SHC4、PFDN4和CHORDC1之间存在一个信号网络,并证明了miR-26a在PCa中调节EV分泌的新机制(图5)。
结 论:
本研究广泛筛选了PCa中调节EV分泌的miRNA,发现miR-26a通过靶向SHC4、PFDN4和CHORDC1调节EV分泌。这一发现揭示了miRNA通过抑制EV生物发生抑制肿瘤的新思路,为PCa的治疗提供了新的途径。






