强大的青蒿素 新兴的铁死亡 强强联合发高分
抗疟药物Artemisinin及其衍生物已被开发为潜在的抗癌药物,但其抗癌的潜在机制仍存在争议。本文旨在探究Artemisinin抗癌的新机制——铁死亡。本文于2020年1月发表在《Cell death and differentiation》IF:10.717期刊上。
思路流程:
结 果:
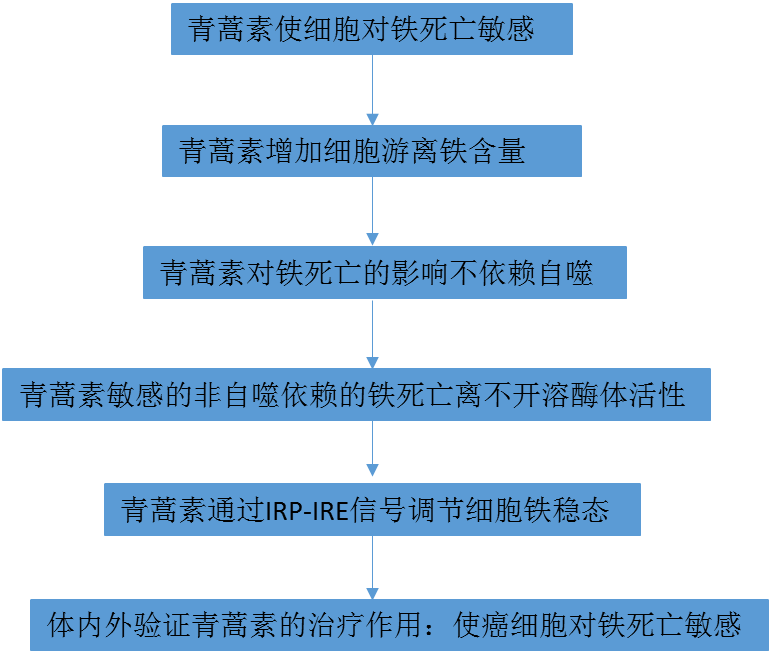
1、ART及其衍生物使细胞对铁死亡敏感
ART化合物中内过氧化物与生物铁的反应性使作者开始研究这些化合物是否能调节铁死亡,一种铁依赖的细胞死亡方式。在小鼠胚胎成纤维细胞(MEFs)和人类骨肉瘤HT1080细胞中,作者发现多种ART化合物(图1A)。并且所有ART化合物均以时间和剂量依赖的方式使细胞对半胱氨酸饥饿(STV)诱导的铁死亡敏感(图1B,C)。作为所有ART化合物的活性代谢物,DAT对STV诱导的铁蛋白作用最敏感。因此,作者着重探究DAT对铁死亡的作用。对于erastin和RSL3,细胞死亡的强度与脂质过氧化物的产生相关(图1E),证实了观察到的细胞死亡是铁死亡。随后,我们研究了DAT致敏铁蛋白作用的分子基础。
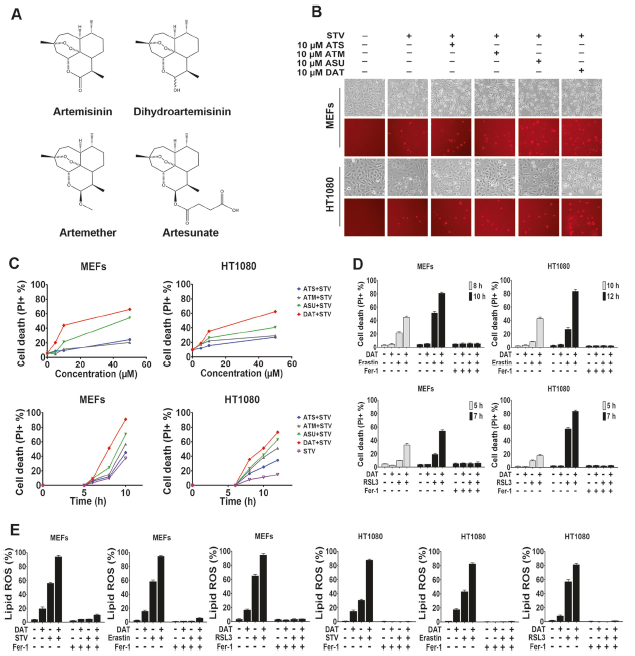
图1Artemisinin及其衍生物使细胞对铁死亡敏感
2、DAT增加细胞游离铁含量,但对细胞谷胱甘肽无影响
铁死亡是铁依赖的细胞死亡方式,因此探究了DAT是否影响细胞内GSH和铁的水平。如所示,Erastin诱导导致细胞GSH水平显著下降(图2a),然而,DAT本身或存在erastin时对细胞GSH水平没有影响(图2a)。另一方面,无论是单独使用还是与erastin结合,DAT都导致了细胞中游离铁含量的增加,铁含量被量化为细胞LIP(图2b)。如预期的,铁螯合剂去铁胺(DFO)完全抑制了由erastin单独或与DAT联合引起的铁螯作用(图2c)。这表明,DAT对铁死亡致敏作用的影响是由于细胞内不稳定铁含量的增加,而不是细胞内谷胱甘肽水平的增加。
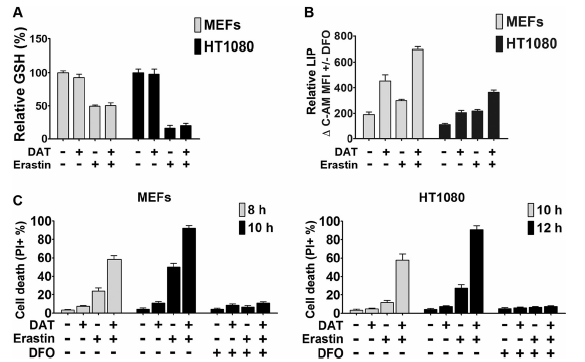
图2 DAT增加细胞游离铁含量,但对细胞谷胱甘肽无影响
3、DAT对铁死亡的影响不依赖自噬
此前有报道,自噬通过降解细胞内铁储存蛋白的铁蛋白,增加细胞内不稳定铁的含量,从而促进铁死亡。有趣的是,ART已经被证明可以刺激自噬,鉴于这些研究以及上述结果中DAT可以促进细胞对铁死亡的敏感,因此,作者进一步探究DAT是否通过自噬依赖的方式促进铁死亡。
结果发现,溶酶体抑制剂巴弗洛霉素A1(bafA1)进一步增加了LC3-II的产量和GFP-LC3斑点的形成,但阻止了p62的降解(图3a, b)。然而,无论是单独使用还是与erastin联合使用(图3a, b),当浓度为10μM时,DAT均未引起自噬通量的增加,而该浓度下DAT可以显著增加细胞对铁死亡的敏感(图1)。随后在自噬必需基因Atg5基因敲除(Atg5- ko)实验中得出了类似的结果。因此,上述表明DAT对铁死亡的影响是一种非自噬依赖的方式。
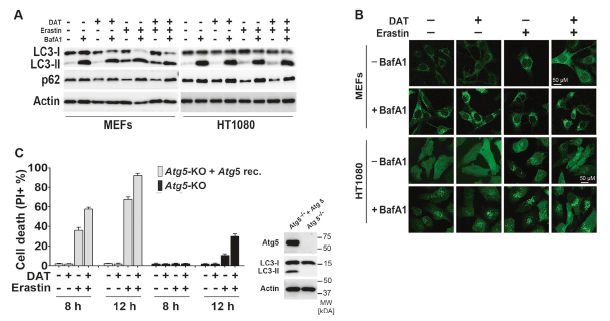
图3 DAT不影响自噬通量,并通过一种不依赖自噬的机制使细胞对铁死亡敏感
4、溶酶体活性对于DAT敏感的非自噬依赖的铁死亡是必需的
与DAT在铁死亡中的自噬独立作用一致的是,在自噬缺陷MEFs (Atg5-KO)中,DAT增加了Atg5-KO 的LIP,而erastin仅增加了自噬补充MEFs的LIP (图4a)。有趣的是,在自噬状态和自噬缺陷状态下,溶酶体抑制剂BafA1抑制了由erastin和DAT引起的LIP的增加(图4a)。此外,无论是自噬状态的MEFs还是自噬缺陷的MEFs, BafA1都抑制了erastin单独或与DAT联合诱导的铁蛋白作用(图4b)。
随后,作者研究了erastin和DAT单独或联合作用对细胞铁蛋白水平及其自噬货物受体Ncoa4的影响。在自噬补充的MEFs中,erastin刺激了Ncoa4水平的溶酶体降解,而BafA1阻止了Ncoa4水平的降解,而细胞中的铁蛋白水平没有被erastin显著改变(图4c)。另一方面,DAT诱导溶酶体降解的铁蛋白同时发生在自噬补充和自噬缺陷的MEF中,而DAT对铁蛋白的影响与溶酶体的Ncoa4降解无关(图4 c),表明DAT可以诱导铁蛋白溶酶体降解,使细胞游离铁浓度增加,从而使细胞对铁死亡敏感,以自噬和Ncoa4非依赖的方式。
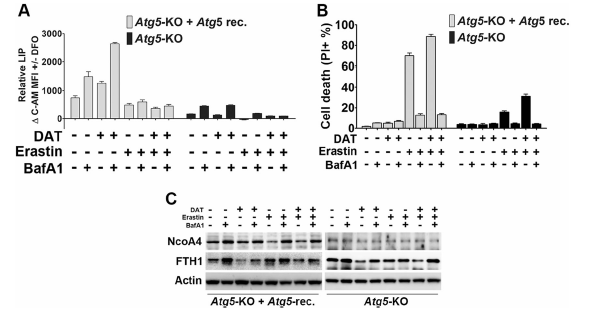
图4溶酶体活性对于DAT敏感的非自噬依赖的铁死亡是必需的
5、DAT通过IRP-IRE信号调节细胞铁稳态
据文献报道,IRP和IRE是调控细胞内铁含量的重要蛋白,因此,为了定量测量DAT和erastin对IRP-IRE信号通路的潜在影响,使用了两个报告质粒,如图5a所示,探究IRE/IRP相互作用和erastin或DAT对铁蛋白翻译调控。其中一个质粒以荧光素酶为读出器(5 IRE-Luc- IRES-GFP),另一个质粒以mCherry为读出器(5 IRE-mCherry-IRES-GFP)。
如图5b所示,在具有稳定荧光素酶报告基因的MEFs中,DAT处理降低了荧光素酶/GFP比率,而erastin处理提高了Luc/GFP比率;DAT处理后mCherry的荧光比率也有一致地变化趋势。观察到的erastin对IRP-IRE信号传导的影响的分子基础(图5b, c)大体如下:通过刺激自噬溶酶体降解铁蛋白,erastin导致LIP的增加,进而降低IRP-IRE的亲和力,导致铁蛋白合成的增加。随后体外监测MDA生成过程,这是一种由亚铁离子和抗坏血酸催化的脂质过氧化反应(图5d)。如图5e所示,DAT虽然足以与反应体系中的所有亚铁离子复合,但并不抑制脂质过氧化。因此,与DAT相关的铁维持催化超氧化反应的能力,就像自由亚铁离子一样。
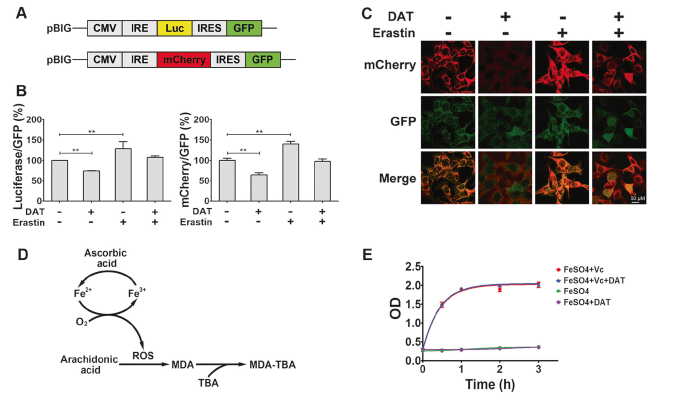
图5 DAT通过IRP-IRE信号调节细胞铁稳态
6、DAT使癌细胞对铁死亡敏感,具有治疗作用
考虑到DAT能使细胞对GPX4抑制剂RSL3诱导的铁死亡敏感,作者进一步测试DAT是否能使这些原本对铁死亡耐药的癌细胞对GPX4的抑制更敏感。如图6a所示,使用不同浓度的RSL3处理不同类型肿瘤来源的细胞系。结果发现,与对RSL3敏感的MEFs和HT1080细胞相比,本试验中RSL浓度最高时,诱导这些癌细胞的铁死亡和脂质过氧化作用也大大降低(图6a)。重要的是,DAT以铁死亡敏感的方式显著提高了这些细胞对RSL3诱导的细胞死亡和脂质过氧化的敏感性(图6b, c)。
为了进一步研究该结论,进行小鼠体内模型实验。人H292肺癌细胞,对GPX4抑制抵抗,以Dox诱导的方式介导CRISPR/Cas9-介导的H292肺癌细胞GPX4敲除(图6a)。Western blot证实Dox处理后H292细胞中GPX4敲除的效率(图6d)。如预期的,当GPX4被敲除时,细胞死亡和脂质ROS生成水平较低,而这两者都被DAT以铁死亡敏感的方式增强(图6d)。随后,通过皮下接种含有可诱导GPX4敲除的H292细胞的裸鼠进行了体内异种移植实验。如图6e g所示,喂食Dox饲料的小鼠肿瘤中GPX4的表达显著降低。与对照组小鼠(-Dox-DAT)相比,服用Dox或单独服用DAT的小鼠肿瘤生长略有下降。综上所述,这些结果表明DAT可用于提高GPX4靶向治疗的效果,特别是对GPX4抑制耐药的肿瘤。

图6在体内和体外,DAT增加脂质ROS,使癌细胞对铁死亡作用敏感
总之,相对低剂量的铁死亡诱导剂,有望能被正常组织接受,并可能对这些癌症的治疗有效。施用DAT使癌细胞对铁死亡进一步敏感,可缩短治疗时间,提高疗效。上述发现可用于临床,以增强未来铁死亡诱导癌症治疗的效果,为今后肿瘤临床治疗提供新的策略。
参考文献:
Chen Guo-Qing., Benthani Fahad A., Wu Jiao., Liang Deguang., Bian Zhao-Xiang., Jiang Xuejun.(2020). Artemisinin compounds sensitize cancer cells to ferroptosis by regulating iron homeostasis. Cell Death Differ., 27(1), 242-254. doi:10.1038/s41418-019-0352-3






