一种可能导致肝癌抗PD1治疗耐药性的新机制
自然杀伤(NK)细胞在先天性抗肿瘤免疫反应中起关键作用。最近,已经在包括肝细胞癌(HCC)在内的各种恶性肿瘤中证实了NK细胞功能障碍。然而,人类肝癌中NK细胞功能障碍的分子生物学机制仍然不清楚。6月27日,来自复旦大学中山医院肝癌研究所的张鹏飞团队在molecular cancer(IF=15.302)上发表论文。他们报道在人类HCC组织中circUHRF1的表达高于在匹配的相邻非肿瘤组织中的表达。 circUHRF1水平升高表明HCC患者的临床预后较差,NK细胞功能异常。在HCC患者血浆中,circUHRF1主要通过外泌体方式由HCC细胞分泌,而circUHRF1抑制NK细胞衍生的IFN-γ和TNF-α的分泌。血浆外泌体circUHRF1的高水平与NK细胞比例减少和NK细胞肿瘤浸润减少有关。此外,circUHRF1通过miR-449c-5p的降解上调TIM-3的表达来抑制NK细胞的功能。最后,他们表明circUHRF1可能会导致HCC患者抗PD1免疫疗法产生抗药性。以上结果为HCC患者提供潜在的治疗策略。
技术路线:

结 果:
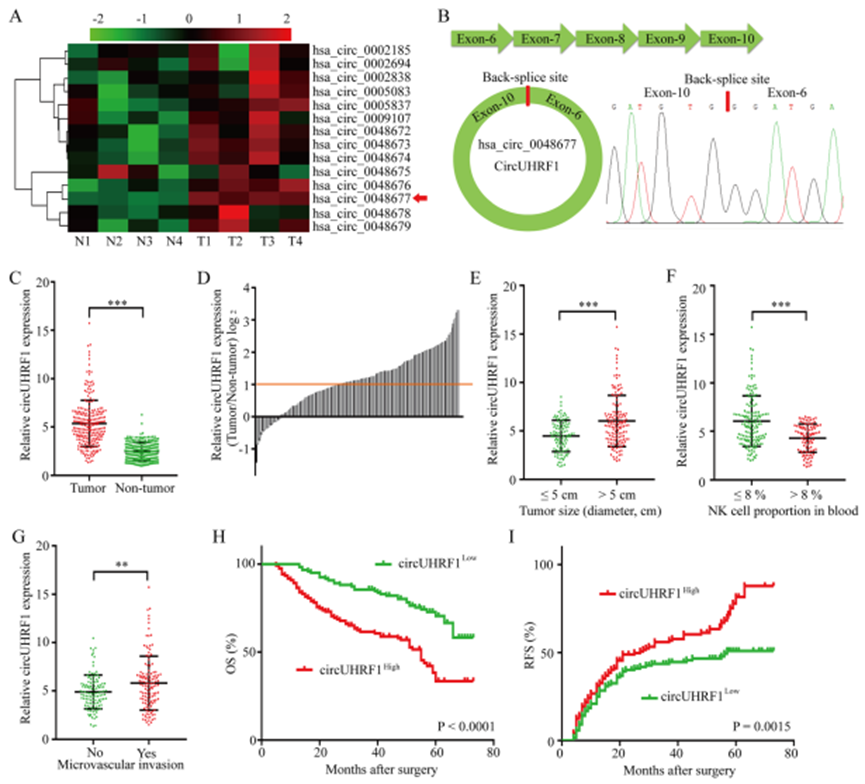
1.肝癌组织中与UHRF1相关的circRNA的分析
UHRF1经常被上调,并且在HCC的进展中起着关键的病理作用。因此,通过qRT-PCR检查了从UHRF1衍生的14个circRNA的水平。其中,hsa_circ_0048677(circUHRF1)是最丰富的circRNA,在HCC组织中被上调(图1a和b)。然后,通过qRT-PCR检查了circUHRF1在240例HCC组织和匹配的邻近非肿瘤组织中的表达。 HCC组织中CircUHRF1的表达明显高于相邻的非肿瘤组织(肿瘤/相邻的非肿瘤组织≥2; 136/240)(图1c和d)。接下来探究circUHRF1表达与240例HCC患者的临床病理特征之间的关系。结果表明,circUHRF1表达与临床病理特征显著相关(图1e-g)。Kaplan-Meier生存分析表明,circUHRF1高表达水平的患者的临床预后较差(图1h和i)。综上所述,HCC细胞中circUHRF1表达上调与患者不良预后相关,并表明circUHRF1表达增加可能与HCC的进展有关。
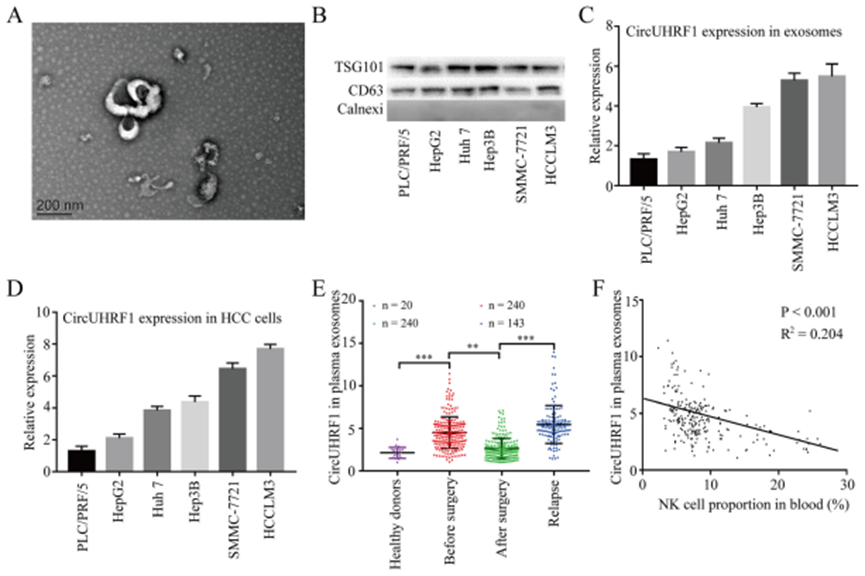
2.HCC细胞以外泌体方式分泌circUHRF1
假设circUHRF1可以通过外泌体从HCC细胞转移到其他细胞。为了验证这一假设,从HCC细胞系上清液中分离了外泌体,并通过TEM和Western印迹进行了评估(图2a和b)。在六个HCC细胞系和成对的外泌体中进行qRT-PCR分析,结果与其他细胞系相比,HCCLM3和SMMC-7721细胞系中circUHRF1明显上调,外泌体表达结果与亲代细胞的表达水平一致(图2c和2d)。与20名健康捐献者相比,HCC患者血浆外泌体circUHRF1水平升高(图2e)。此外,肿瘤切除后血浆外泌体circUHRF1水平降低,而在肿瘤复发患者中血浆外泌体circUHRF1水平升高,表明血浆外泌体circUHRF1主要由HCC细胞产生(图2e)。有免疫逃逸的患者血浆中外泌体circUHRF1水平显著升高,外周血中NK细胞比例降低(图2f)。这些数据表明血浆外泌体circUHRF1可以作为NK细胞相关的免疫逃逸的关键分子。
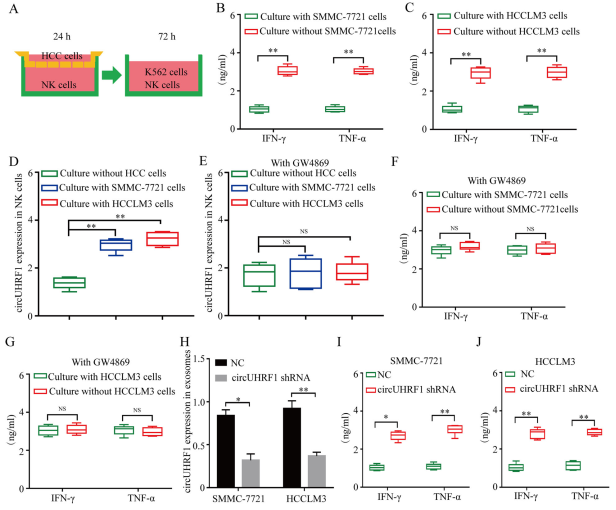
3.HCC细胞通过外泌体circUHRF1抑制NK细胞功能
为了确定HCC衍生的外泌体circUHRF1是否能诱导异体NK细胞发生改变,将来自6个健康供体的NK细胞与HCCLM3和SMMC-7721细胞以1:1的比例共培养24小时(图3a)。与SMMC-7721和HCCLM3细胞共培养的NK细胞表现出IFN-γ和TNF-α分泌的显著损害,circUHRF1表达显著增加(图3a-d),这被外泌体抑制剂GW4869削弱(图3e)。NK细胞与SMMC-7721和HCCLM3细胞先共培养,再用外泌体抑制剂处理,IFN-γ和TNF-α的分泌减弱(图3f和g)。为了进一步研究是否以外泌体circUHRF1依赖性方式介导HCC细胞对NK细胞功能的抑制作用,使用SMMC-7721和shRNA慢病毒载体建立了circUHRF1表达下调细胞。结果表明,外泌体circUHRF1水平的降低可有效减弱NK细胞中HCC衍生的外体诱导的IFN-γ和TNF-α分泌的损伤(图3h-j)。这些结果共同表明,源自HCC的外泌体circUHRF1能损害NK细胞的功能。
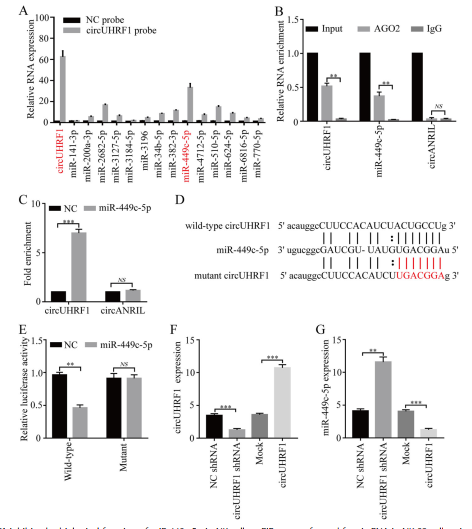
4.CircUHRF1和miR-449c-5p在NK细胞中彼此降解
通过StarBase v3.0分析,预测有14个miRNAs可能是circUHRF1的靶标。使用circUHRF1特异性探针进行circRNA体内沉淀(circRIP),并使用qRT-PCR检测了与circUHRF1形成复合体的14种预测miRNA。结果表明,与阴性对照相比,circUHRF1和miR-449c-5p显著富集(图4a),表明miR-449c-5p是与circUHRF1相互作用的miRNA。接下来进行一系列实验来验证这一结果(图4b-e)。此外,在NK-92细胞中过表达miR-449c-5p后circUHRF1的水平显著降低,而在circUHRF1过表达后miR-449c-5p的水平显著降低(图4f和g)。这些发现表明,circUHRF1和miR-449c-5p可能相互靶向,在NK细胞中相互影响。
5.CircUHRF1通过抑制miR-449c-5p活性上调TIM-3表达
推测circUHRF1可能充当miR-449c-5p海绵通过上调miR-449c-5p靶标的表达水平增强HCC患者的免疫逃逸。为了验证这一假设,首先分析了包括TIM-3在内的NK细胞中一组预测的miR-449c-5p靶基因(图5a)。接下来进行了实验验证TIM-3是miR-449c-5p的靶基因(图5b-d)。鉴于TIM-3相关途径在免疫逃逸中的关键作用,假设circUHRF1可能通过其竞争性circRNA活性成为HCC免疫逃逸的重要助力者。为了进一步验证这一假设,在单独或与circUHRF1一起转染miR-449c-5p模拟物的NK-92细胞中检测到TIM-3表达。结果表明, miR-449c-5p强迫表达导致TIM-3的mRNA和蛋白表达水平降低,而circUHRF1逆转了miR-449c-5p对TIM-3表达的这种抑制作用(图5b和c)。为了进一步证实体外研究结果,调查了另一40例HCC患者中circUHRF1和miR-449c-5p / TIM-3表达之间的相关性外周NK细胞。发现circUHRF1表达与外周NK细胞中的miR-449c-5p表达负相关,circUHRF1表达与周围NK细胞中TIM-3 mRNA表达正相关,miR-449c-5p表达与外周NK细胞中TIM-3 mRNA的表达负相关(图5e-g),表明外泌体circUHRF1的上调消除了miR-449c-5p对NK细胞中TIM-3的抑制作用。

6.CircUHRF1以NK细胞依赖性方式诱导HCC进展
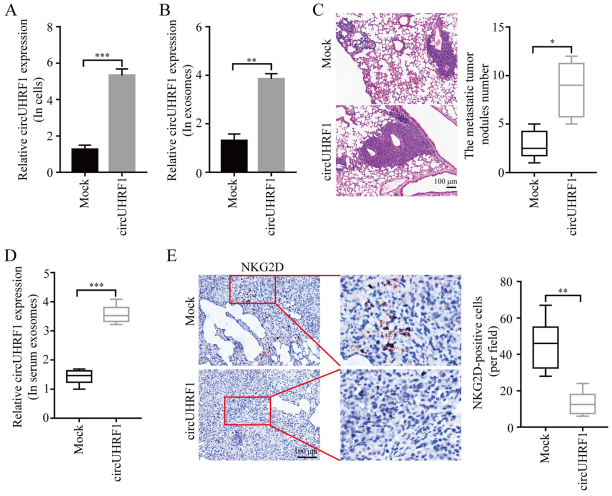
为了进一步探索circUHRF1在肝癌中的功能,使用了pLO5-ciR-circUHRF1慢病毒载体来上调circUHRF1在PLC / PRF / 5细胞中的表达。 qRT-PCR结果显示,转染pLO5-ciRcircUHRF1的PLC / PRF / 5细胞的circUHRF1水平显著高于转染pLO5-ciR-Mock的细胞中的circUHRF1并且外泌体更高的circUHRF1水平(图6a和6b)。使用PLC / PRF / 5细胞生成了NOD / SCID小鼠肺肿瘤转移模型。结果表明,与转染pLO5-ciR-Mock的HCC细胞相比,转染pLO5-ciR-circUHRF1的PLC / PRF / 5细胞显示出circUHRF1水平升高,诱导的转移性肿瘤结节数目明显增加,NKG2D阳性细胞数量明显减少(图6c-e)。这些结果表明circUHRF1以外泌体和NK细胞依赖性方式促进HCC进展。
7.CircUHRF1增强了肝癌抗pd1治疗的耐药性
由于强制circUHRF1表达抑制了HCC中的NK细胞功能,因此评估了circUHRF1过表达是否可以进一步阻止抗PD1治疗(Opdivo)的抗肿瘤作用。分析了30例接受抗PD1免疫治疗的复发性远处转移(包括肺转移)的HCC患者的回顾性数据。根据RECIST1.1分析,结果显示,部分缓解(PR)3例,疾病稳定(SD)7例,进行性疾病(PD)20例,PD组的circUHRF1表达水平远高于SD和PR组(图7a)。为了进一步探讨circUHRF1与免疫逃避之间的关系,检查了30例HCC患者组织中NKG2D的表达。与对PD1敏感的HCC患者相比,对PD1耐药的HCC患者的NKG2D阳性细胞数量明显减少(图7b)。分析显示,HCC组织中circUHRF1表达与NKG2阳性细胞数之间呈负相关(R2 = 0.1452; P = 0.0377)(图7c)。为了进一步评估circUHRF1对抗PD1治疗的抗性,通过皮下植入circUHRF1基因下调的HCCLM3细胞或相应的阴性对照细胞建立了异种移植模型。结果表明,植入circUHRF1基因敲低的细胞可提高对抗PD1治疗的敏感性,并提高总生存率(图7d-f)。综上所述,这些发现表明circUHRF1过表达可能会阻碍HCC对抗PD1治疗的反应,而靶向circUHRF1可能是恢复HCC对抗PD1治疗敏感性的有前途和有效的方法。

参考文献:
Zhang Peng-Fei., Gao Chao., Huang Xiao-Yong., Lu Jia-Cheng., Guo Xiao-Jun., Shi Guo-Ming., Cai Jia-Bin., Ke Ai-Wu.(2020). Cancer cell-derived exosomal circUHRF1 induces natural killer cell exhaustion and may cause resistance to anti-PD1 therapy in hepatocellular carcinoma. Mol. Cancer, 19(1), 110. doi:10.1186/s12943-020-01222-5






