外泌体PD-L1:在肿瘤进展和免疫治疗中的作用
2020年7月,《Trends Cancer 》杂志发表“Exosomal PD-L1: Roles in Tumor Progression and Immunotherapy.”文章,此报道总结了外泌体PD-L1和外泌体诱导的PD-L1在抑制抗肿瘤免疫中的作用,并讨论其对当前癌症免疫治疗的意义。
PD-L1是PD-1的配体,两者相互作用可一定程度上抑制机体的细胞免疫反应,这是人体中本就存在的信号通路,避免免疫反应的过度激活。而这条信号通路一旦被肿瘤细胞利用,则会造成肿瘤细胞逃脱免疫系统的监视和杀伤,也就是免疫逃逸。
大多研究认为PD-L1是一种跨膜蛋白,主要表达在细胞膜上,但深入研究发现,PD-L1不仅表达在细胞膜,还可能存在于外泌体和细胞微泡表面,甚至部分以游离形式存在,非细胞膜上的PD-L1统称为可溶性PD-L1。

结 论:
1.PD-L1在外泌体的表达
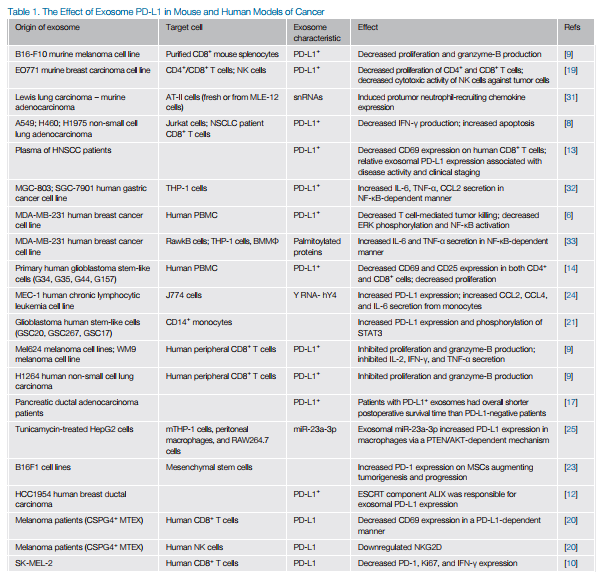
外泌体起源于核内体晚期小泡的向内出芽,形成多泡体(MVB)。人乳腺癌组织的免疫组化染色表明外泌体标志物CD63和PD-L1在MVB中共定位。MVB与质膜融合释放外泌体到细胞外。细胞表面生物素化实验表明MVB中的外泌体PD-L1起源于细胞表面PD-L1的内吞作用。非小细胞肺癌来源的外泌体共聚焦显微镜也证实了这些发现。
不同的肿瘤细胞系或不同类型的癌症中,包装在分泌外泌体中的PD-L1含量是波动的。一种假设是细胞系差异地将PD-L1负载到外泌体膜。HCC1954细胞中ALIX缺失导致PD-L1保留在肿瘤细胞表面,导致外泌体膜PD-L1减少。在PC3细胞中,通过敲除外泌体生物形成蛋白Rab27a和nSMase2来消除外泌体分泌,显著降低了CD63和PD-L1在蔗糖分块中的共同表达。在人乳腺癌细胞中,用药理抑制剂GW4869抑制外泌体分泌,导致外泌体标志物CD63和CD81表达下降, 以及PD-L1表达下降。
亲代细胞的转移能力决定了外泌体PD-L1释放。与原代细胞系分泌的外泌体比较,转移性黑色素瘤细胞系分泌的外泌体PD-L1表达更高。人WM9黑素瘤异种移植裸鼠的研究表明,与对照组相比,外泌体室中的PD-L1表达显著增加。此外,在多种癌症中,外泌体PD-L1表达水平的升高与肿瘤大小的增大、疾病活性的提高和总体临床分期呈正相关。 IFN-γ 刺激增加lPD-L1在肿瘤细胞上的表达,并增加外泌体的PD-L1表达。
2.外泌体PD-L1的免疫抑制特性
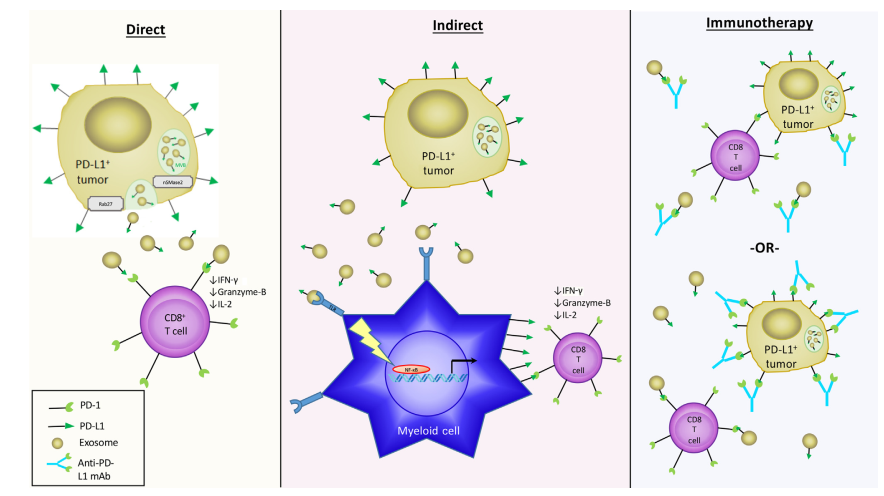
外泌体PD-L1的全身免疫抑制作用可分为两类:内源性外泌体PD-L1免疫抑制作用(直接)和外泌体诱导的PD-L1免疫抑制作用(间接)。
(1)内源性外泌体PD-L1免疫抑制作用(直接):
作为原发肿瘤的分泌成分,外泌体被认为具有广泛的转移前niche-增强特征。
外泌体表面PD-L1的表达使它们不仅能够在原发肿瘤的微环境中局部与其他免疫细胞结合,而且能够在系统上与其他免疫细胞结合(表1)。在患者外周血中肿瘤源性外泌体上PD-L1的表达水平和疾病分期呈正相关,提示外泌体是肿瘤缓解宿主免疫应答的重要机制。一组新出现的证据表明,在多种癌症中,外泌体能够通过直接结合PD-1诱导免疫抑制表型,从而抑制毒性T细胞的功能,从而使肿瘤免疫逃逸。
(2)PD-L1在次级细胞类型上的外泌体诱导:
外泌体通过诱导PD-L1在次级细胞上的表达,通过一种替代的间接机制调节免疫系统。各种肿瘤模型的外泌体标记显示,主要是吞噬细胞、淋巴细胞在其局部微环境中摄取外泌体。胶质母细胞瘤患者的CD14+单核细胞与健康对照组相比,显示了胶质母细胞瘤干细胞中标记外泌体的摄取增加。胶质母细胞瘤来源的外泌体治疗后对这些单核细胞的进一步表征显示,除了PD-L1外,MHC II、CD80、CD163和CD206的表达增加。此外,从多形性胶质母细胞瘤患者标本中直接切除的CD14+细胞,与健康献血者外周血相比,PD-L1表达增加。PD-L1表达升高与免疫抑制M2巨噬细胞中已知的转录因子pSTAT-3的升高有关,在某些情况下,磷酸化的p70S6激酶和Erk1/2升高,提示MAPK和mTOR信号通路也参与了PD-L1的表达调控。
肿瘤来源的外泌体通过toll样受体(TLRs)驱动次生细胞上PD-L1表达的一种机制被提出。在来源于慢性淋巴细胞白血病(CLL)的外泌体中大量发现的非编码RNA Y RNA hY4通过TLR7连接使单核细胞向促进CLL的关键PD-L1+表型极化。同样,虽然确切的TLR尚未被鉴定,但在肝细胞癌诱导的外泌体中的miR-23a-3p增加了腹膜巨噬细胞[25]上的PD-L1表达。
总的来说,外泌体刺激巨噬细胞/单核细胞会导致促肿瘤源性表型的极化,通常表现为PD-L1表达增加和免疫抑制。然而,PD-L1表达增加的确切机制尚不清楚,是未来研究的目标。
3.外泌体PD-L1对免疫治疗的影响
外泌体在PD-L1介导的免疫逃避中发挥作用的最显著数据集中于外泌体PD-L1与治疗反应之间的相关性。这些研究表明,监测循环外泌体PD-L1可能是预测肿瘤对免疫治疗反应的有效方法。首先,Chen等研究表明,最终抗pd -1治疗无效的患者在治疗前PD-L1+循环外泌体水平升高。有反应者和无反应者之间的可溶性PD-L1、微泡性PD-L1水平以及胞外囊泡以外来源的PD-L1水平无统计学差异。但如果患者治疗前外泌体PD-L1水平较低,且在抗pd -1治疗过程中外泌体PD-L1变化大于2.43倍,则更有可能最终对治疗产生成功应答。据认为,外泌体上PD-L1表达增加是由于产生IFN- tnf -的CD8+ T细胞被重新激活而导致肿瘤细胞上表达增加所致。缺乏外泌体PD-L1增加的患者被认为缺乏IFN-迟钝T细胞反应的充分恢复,这可能是治疗失败的原因。
在基线或治疗期间,高水平的外泌体PD-L1通过结合抗体与anti-PDL1治疗起相反的作用 (图1)。更有可能的是, 尽管活跃抗体治疗,外泌体PD-L1抵抗anti-PD-1疗法,继续直接或间接地发挥T细胞免疫抑制。无论哪种情况,接受高水平的PD-L1+外泌体处理的患者,肿瘤负担最大,免疫抑制最强,总体临床结果最差。因此,有必要进一步明确研究外泌体PD-L1对免疫治疗的不利影响,以及外泌体缺失是否是产生最有效免疫检查点反应的可行且必要的伴随治疗。
结 果:
肿瘤来源的外泌体已被证明在多种癌症中促进肿瘤生长和转移。在舆论的这篇文章中,我们展示了一个特定的肿瘤促进特点,如何PD-L1表情液,传授一种免疫抑制表型主要通过三个机制:直接内生外泌体PD-L1,间接诱导PD-L1和PD-L1-调控的免疫检查点封锁拮抗治疗(图1)。一般来说,液从转移性肿瘤细胞显示增加PD-L1表达式与非转移细胞。此外,在许多原发性癌症中,外泌体上PD-L1的表达水平通常与癌症分期的严重程度呈正相关,与生存率呈负相关。
图1: