乳腺癌中新的靶点 新的lncRNA出世啦!
乳腺癌是女性中最常见的一种恶性癌症,尽管乳腺癌的研究在诊断和联合治疗方面取得了进展,但乳腺癌患者的预后仍不能令人满意。lncRNA在癌症进展中扮演着重要的作用,并在癌症中异常表达。然而,lncRNA在乳腺癌中功能作用却有较大一部分不清楚。本文基于公共数据库,结合生物信息学分析,检测到lncRNA BCRT1(breast cancer related transcript 1)在乳腺癌组织中的过表达,并在乳腺癌组织中进一步验证发现其对miR-1303/PTBP3的调控途径,为乳腺癌的临床治疗提供了新的靶点。本文于2020年5月8日发表在《Molecular cancer》。

主要结果:
1、在乳腺癌中lncRNA BCRT1的表达上调且与不良预后有关
使用公共数据库GSE112848和TCGA分析与乳腺癌进展相关的lncRNA表达谱,(图1a-b)。考虑到旨在筛选治疗靶点或预后生物标志物,所以作者将重点放上上调的lncRNA上。其中,lncRNA BCRT1是乳腺癌组织中显著上调的lncRNA之一,作者选择它进行进一步的评估。
与正常乳腺上皮细胞(MCF10A)相比,lncRNA BCRT1的表达在4种乳腺癌细胞系中都显著上调表达(图1c)。在18对乳腺癌组织和正常乳腺癌组织中的PCR检测显示,lncRNA BCRT1在癌组织中显著高表达,并且lncRNA BCRT1在乳腺癌伴有远程转移的组织中也是高表达(图1d);此外,lncRNA BCRT1高表达与无疾病生存期和总体存活率的明显下降有关(图1e)。亚细胞定位显示lncRNA BCRT1主要分布在细胞质(图1f和g)。总之,这些发现共同揭示了lncRNA BCRT1在乳腺癌中上调和lncRNA BCRT1的高表达与乳腺癌预后不良有关。
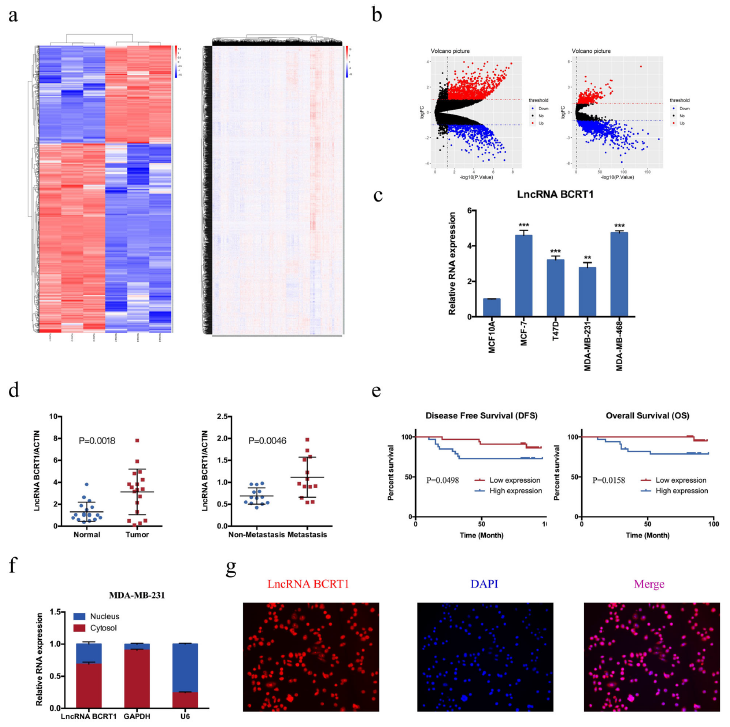
图1 LncRNA BCRT1的上调与乳腺癌的进展和预后不良有关
2、LncRNA BCRT1促进乳腺癌细胞增殖和肿瘤生长
为了验证lncRNA BCRT1在乳腺癌细胞中的生物学功能,利用siRNA敲除lncRNA BCRT1,其干扰效率如图2a。lncRNA BCRT1敲除后,乳腺癌细胞的增殖、集落形成和DNA合成效率都显著下降(图2b-d),而乳腺癌细胞的总体死亡率则显著增加(图2e)。相反地,构建使lncRNA BCRT1过表达的pcDNA3.1载体转染乳腺癌细胞后,其表达和增殖都显著升高(图2f-g)。此外,使用皮下异种移植模型验证lncRNA BCRT1在大鼠体内的生物学功能。与体外一致,与对照相比,过表达lncRNA BCRT1显著增加了肿瘤的重量和体积(图2h-i)。免疫组织化学(IHC)实验证实过表达lncRNA BCRT1后,大鼠体内Ki67的表达量增加,暗示着细胞增殖增加(图2j)。上述结果表明lncRNA BCRT1在体内外均可促进乳腺癌细胞增殖。

图2 LncRNA BCRT1基因下调抑制乳腺癌细胞的体外和体内增殖
3、LncRNA BCRT1促进细胞迁移和肿瘤转移
之后作者探究了lncRNA BCRT1对乳腺癌细胞运动能力的影响。结果显示,敲除lncRNA BCRT1后显著损害了乳腺癌细胞的迁移和侵袭,相反,过表达lncRNA BCRT1则乳腺癌细胞的运动力提高(图3a-b)。此外,使用乳腺癌的条件培养基去刺激HUVECs的血管生成以评估体外血管生成活性。结果显示,与对照相比,lncRNA BCRT1敲除组的血管平均长度显著下降,而过表达则相反(图3c)。
鉴于上皮间质转化(EMT)是癌症转移的主要机制,所以对LncRNA BCRT1是否影响EMT相关标志物的表达进行探究。WB显示,敲除LncRNA BCRT1可以增加上皮标志物E-cadherin的表达,且降低间质细胞标记物Fibronectin,N-cadherin,和Vimentin的表达(图3d),暗示着lncRNA BCRT1可以调节EMT过程从而调控乳腺癌的进展。
为了在体内验证上述结果,通过将乳腺癌细胞尾静脉注射构建裸鼠肺转移模型。对照组中的2只老鼠和lncRNA BCRT1过表达组全部的5只老鼠在4周后出现了肺部转移灶(图3e)。然后取这些大鼠的肺组织,进行HE染色,结果显示,过表达LncRNA BCRT1显著增加了大鼠肺部转移灶的的体积和数量(图3f)。综上所述,这些数据表明,lncRNA BCRT1促进乳腺癌细胞的肿瘤转移。
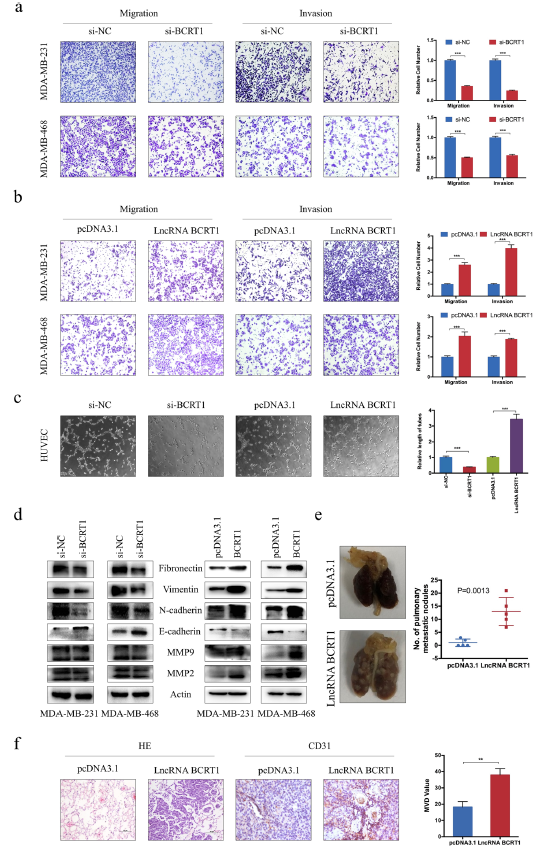
图3 LncRNA BCRT1的下调抑制了乳腺癌细胞的体内外转移
4、LncRNA BCRT1在乳腺癌细胞中充当miR-1303的海绵
鉴于lncRNA BCRT1定位于细胞质,作者推测lncRNA BCRT1可能通过调控miRNA来发挥功能,经过鉴定发现miR-1303可能是lncRNA BCRT1的潜在靶标(图4a)。荧光素酶结果显示,过表达miR-1303显著降低了lncRNA BCRT1野生型的荧光素酶活性,但是不影响突变体的活性(图4b)。AGO2的免疫沉淀结果显示,AGO2抗体可以拉下内源性lncRNA BCRT1和miR-1303(图4c)。此外,敲除lncRNA BCRT1后miR-1303的表达显著升高(图4d)。上述结果表明miR-1303是乳腺癌中lncRNA BCRT1的一个抑制靶点。
进一步地,探究miR-1303在乳腺癌细胞中的功能。结果显示,过表达miR-1303导致乳腺癌细胞的增殖效率下降,而死亡率增加,迁移和侵袭也下降(图4e-h)。救援实验进一步验证了lncRNA BCRT1与miR-1303的功能关系。
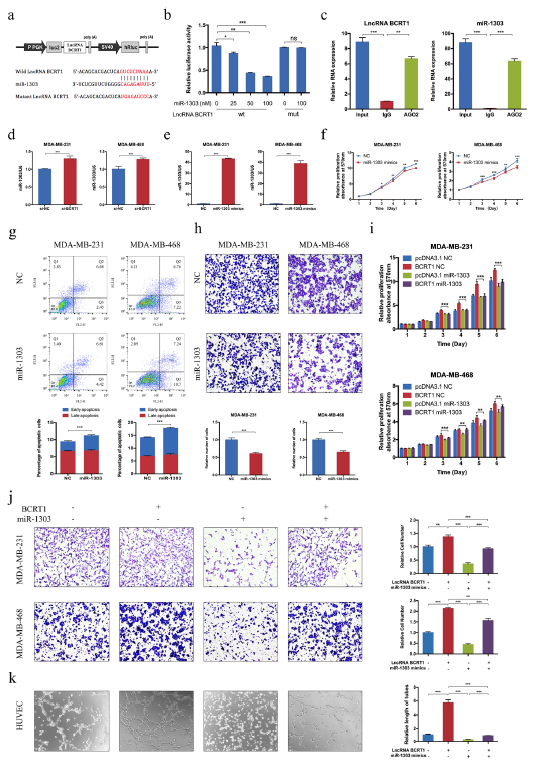
图4 LncRNA BCRT1在乳腺癌中充当miR-1303的海绵。
5、LncRNA BCRT1通过抑制miR-1303上调PTBP3的表达
作者使用4个数据库筛选到PTBP3可能是miR-1303的潜在靶点,此外,PTBP3在乳腺癌组织中上调表达,且高表达水平的PTBP3与乳腺癌的不良预后有关,重要的是,乳腺癌细胞中PTBP3的表达水平和lncRNA BCRT1的表达成正相关(图5a-c)。荧光素酶实验证实过表达miR-1303导致野生型PTBP3的活性下降而对突变型的无影响,表明PTBP3是miR-1303的直接靶标(图5d)。此外,PTBP3的mRNA水平和蛋白水平均由于miRNA的过表达或lncRNA BCRT1敲除而下降(图5f)。在拯救实验中,过表达miR-1303可以部分抵消因过表达lncRNA BCRT1引起的PTBP3表达升高的情况(图5g)。此外,敲除PTBP3可显著抑制细胞增殖,增加细胞凋亡,减弱细胞的迁移和侵袭(图5h-k)。上述结果表明lncRNA BCRT1通过调控miR-1303调控PTBP3的表达最终影响乳腺癌的进展。
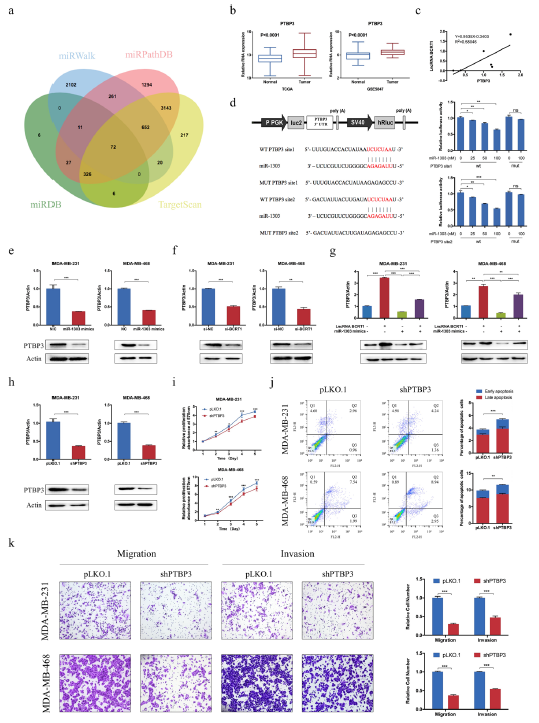
图5 LncRNA BCRT1通过保护PTBP3不受miR -1303诱导的降解而促进乳腺癌细胞的增殖和进展
6、外泌体lncRNA BCRT1促进M2表型极化,促进巨噬细胞诱导的肿瘤进
此前的研究表明肿瘤相关的巨噬细胞(TAMs),其M2表型,是肿瘤微环境(TME)中最丰富的细胞,并且通过调控血管生成、转移和免疫逃逸参与肿瘤进展。为了探究lncRNA BCRT1是否参与M2极化,作者评估了未极化的巨噬细胞、LPS/INF-γ-induced M1巨噬细胞、IL-4/IL-13-induced M2巨噬细胞中lncRNA BCRT1,M1和M2标记物的表达。结果显示M1巨噬细胞中M1相关基因(CD80、MCP-1、iNOS、IL-6)表达水平显著上调,M2巨噬细胞中M2相关基因(CD206、MRC-2)表达水平显著上调(图6a),这表明单核细胞极化成功。此外,与M1巨噬细胞相比,lncRNA BCRT1在M2巨噬细胞中表达显著升高(图6b),提示lncRNA BCRT1在巨噬细胞极化中的潜在作用。使用PMA处理24 h后,用si- NC或si- bcrt1转染THP-1细胞,然后加入IL-4和IL-13 24 h,诱导M2表型。结果显示,si-BCRT1组M1标记显著增加,M2标记显著减少(图6c)。此外,与对照组MDA-MB-231细胞相比,lncRNA BCRT1过表达MDA-MB-231细胞的上清导致M2标记物的表达升高(图6e)。
为了研究lncRNA BCRT1是否能被外泌体吸收,作者从乳腺癌细胞培养上清中提取外泌体,并使用WB检测外泌体蛋白如CD63、HSP70和HSP90的表达(图6f)。在MDA-MB-231细胞中lncRNA BCRT1过表达导致分泌的外泌体中lncRNA BCRT1的水平升高,而lncRNA BCRT1的敲除产生相反的结果(图6g),表明外泌体中存在lncRNA BCRT1。使用PKH26标记MDA-MB-231细胞衍生的外泌体,并将其与巨噬细胞一起温育以检查外泌体掺入,并确认标记的外泌体RNA可以被巨噬细胞内化(图6h)。
为了进一步研究lncRNA BCRT1诱导的M2表型巨噬细胞是否具有促进肿瘤的特征功能,使用外泌体或从lncRNA BCRT1过表达或对照细胞中分离的上清液处理了巨噬细胞。然后,收集受过教育的巨噬细胞的条件培养基,并用于治疗乳腺癌细胞或HUVEC。结果表明,使用外泌体或从lncRNA BCRT1过表达分离的上清液处理的巨噬细胞显著促进细胞迁移和血管生成(图6j-k),此外,也导致雏鸡胚胎的新血管密度增加(图6l)。
综上所述,这些结果表明lncRNA BCRT1可以通过外泌体转移,从而促进M2表型极化并增强其肿瘤促进功能。
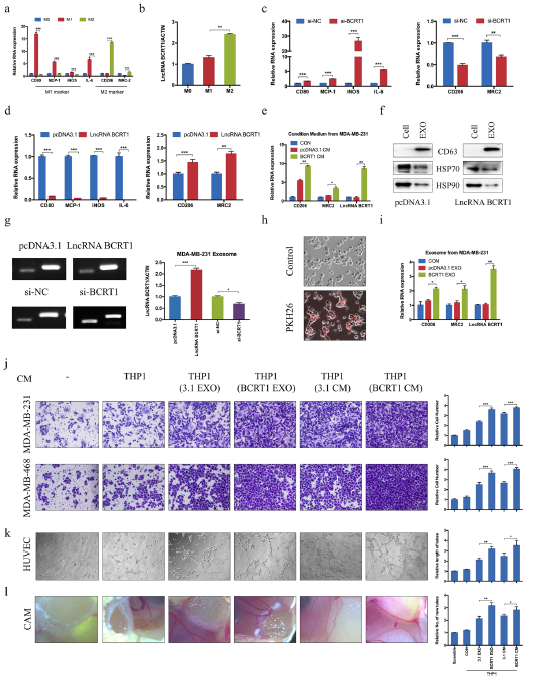
图6 lncRNA BCRT1可被乳腺癌细胞分泌并促进M2极化
7、缺氧条件下lncRNA BCRT1受到HIF-1α的转录调控
缺氧是各种癌症的主要肿瘤内特征之一,一些研究表明,癌症的低氧微环境可能是导致某些lncRNAs异常表达的原因,因而作者对lncRNA BCRT1是否对缺氧诱导敏感进行了探究。结果显示lncRNA BCRT1的表达随着HIF-1α的表达而升高(图7a-b)。无论常氧还缺氧情况下,HIF-1α的敲除都导致HIF-1α和lncRNA BCRT1的表达急剧下降,并且HIF-1α的敲除大幅消减了因缺氧诱导引起的lncRNA BCRT1的表达增加(图7c-e)。图7f-g为lncRNA BCRT1上预测到的两个HIF-1α响应元件(HREs)。进一步地,缺氧处理显著提高了转染全长lncRNA BCRT1启动子载体的细胞的荧光素酶活性,而HRE1的缺失则降低了荧光素酶活性,这表明HRE1对lncRNA BCRT1的转录至关重要(图7h)。此外,HIF-1α敲除显著反转了因缺氧处理引起的荧光素酶活性,这表明缺氧促进lncRNA BCRT1转录是通过将HIF-1α的HRE1与其启动子区域绑定。染色质免疫沉淀进一步证明了这个结果(图7i)。另一方面,数据分析发现PTBP3的表达与HIF-1α成正相关(图7j),并且缺氧处理导致PTBP3 mRNA和蛋白的表达水平升高(图7 k),而HIF-1α敲除减弱了这种影响(图7l)。以上结果表明缺氧转录调控lncRNA BCRT1表达是通过直接将HIF-1α HRE1绑定在启动子。
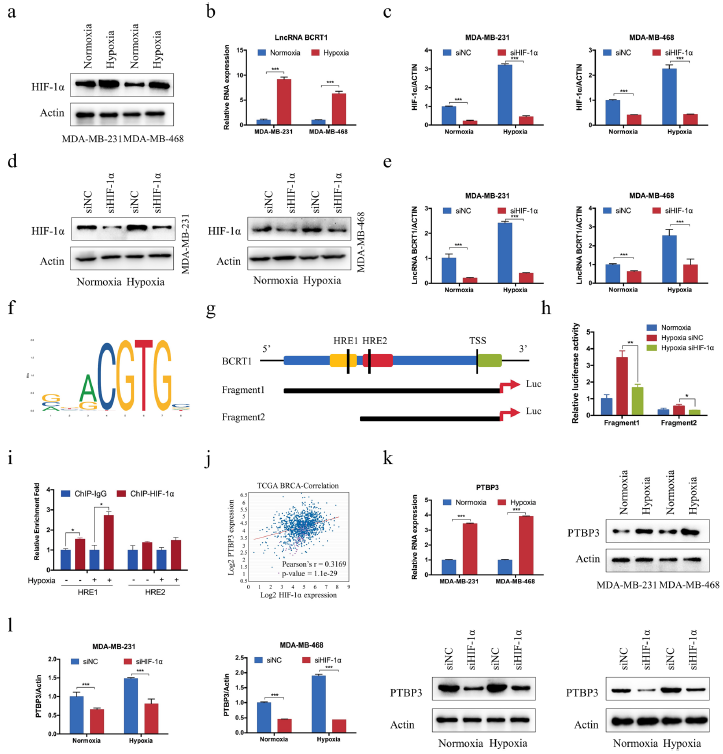
图7在缺氧期间LncRNA BCRT1受到HIF-1α的转录调控
8、LncRNA BCRT1介导低氧诱导的乳腺癌细胞恶性特性
缺氧是TAM的特征之一,与肿瘤的增殖,转移和药物抗性相关,因此,进一步研究LncRNA BCRT1是否参与了缺氧诱导的生物学功能。结果发现缺氧诱导导致LncRNA BCRT1和PTBP3的表达及细胞增殖增加,而lncRNA BCRT1和HIF-1α敲除能消除这种作用,此外,lncRNA BCRT1过表达可以部分反转HIF-1α敲除引起的抑制作用(图8a-c)。与缺氧处理后,MDA-MB-231细胞表现出更多的形态和迁移能力升高,但HIF-1α或lncRNA BCRT1敲除戏剧性的逆转这一结果(图8d-f)。这些结果表明lncRNA BCRT1可能参与了缺氧诱导的乳腺癌细胞的生物学功能。

图8 LncRNA BCRT1对于HIF-1α介导的低氧诱导肿瘤恶性属性至关重要
总 结:
总之,本文发现低氧反应型lncRNA BCRT1是乳腺癌的肿瘤促进剂,而lncRNA BCRT1的高表达与肿瘤转移和不良预后有关。LncRNA BCRT1充当miR-1303的海绵,以减轻其对PTBP3的抑制作用,并通过外泌体介导的转移促进M2极化。 本文帮助大家更好地了解lncRNA在乳腺癌进展中的作用,以及提供了针对这种恶性肿瘤的潜在治疗靶点和预后指标。
参考文献:
Liang Yiran., Song Xiaojin., Li Yaming., Chen Bing., Zhao Wenjing., Wang Lijuan., Zhang Hanwen., Liu Ying., Han Dianwen., Zhang Ning., Ma Tingting., Wang Yajie., Ye Fangzhou., Luo Dan., Li Xiaoyan., Yang Qifeng.(2020). LncRNA BCRT1 promotes breast cancer progression by targeting miR-1303/PTBP3 axis. Mol. Cancer, 19(1), 85. Doi: 10.1186/s12943-020-01206-5






