CK1α/CBX4轴在骨肉瘤转移中的作用
骨肉瘤是一种侵袭性恶性肿瘤,肺转移率高,缺乏治疗靶点。骨肉瘤转移或复发患者的治疗策略的确定是必要和紧迫的。因此,更好地了解骨肉瘤发生的分子机制和识别骨肉瘤的治疗靶点是迫切的研究目标。接下来小编为大家带来发表于“nature communications”上的文章“Targeting the CK1α/CBX4 axis for metastasis in osteosarcoma”。

在这里,我们报道了在骨肉瘤细胞系和组织中过表达的染色体盒同源物4(CBX4)。CBX4通过向Runx2启动子募集GCN5,通过转录上调Runx2促进骨肉瘤转移。CK1α通过抑制CBX4抑制细胞迁移和侵袭。骨肉瘤组织中CK1α与CBX4呈负相关,CK1α是预测骨肉瘤转移患者临床预后的重要指标。恩波吡维铵(PP)作为CK1α的选择性激活剂,可通过CK1α/CBX4轴抑制骨肉瘤的转移。
结果:
1)CBX4通过转录上调Runx2发挥作用
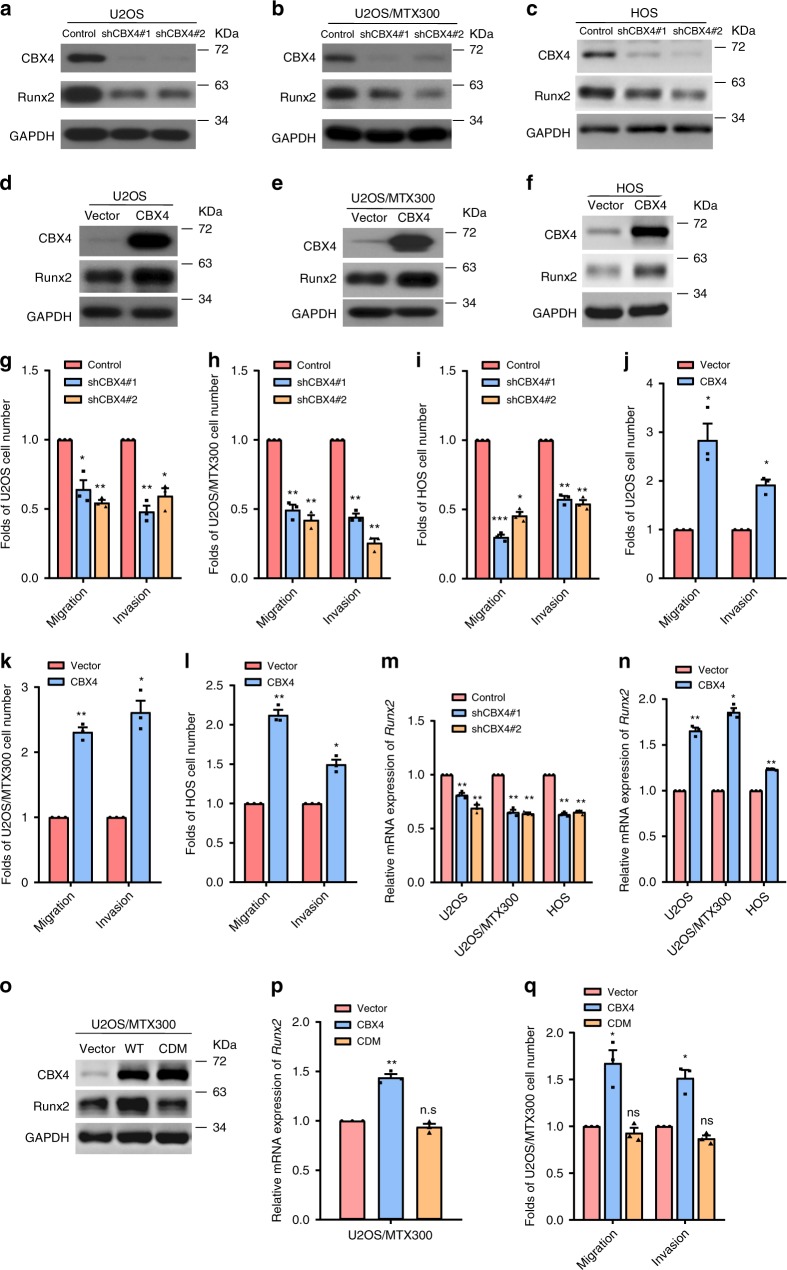
我们通过测序和qPCR确定骨肉瘤发展过程中的关键分子为CBX4。敲除CBX4可减少U2OS、U2OS/MTX300和HOS细胞的迁移和侵袭(图1a-c、g-i)。在稳定表达CBX4的细胞中,细胞迁移和侵袭持续增强(图1d-f,j-l)。
Runx2在促进骨肉瘤转移中起着关键作用。因此,我们好奇CBX4是否能影响骨肉瘤中Runx2的转录。敲除CBX4后,Runx2的蛋白质和mRNA水平降低,而CBX4的过表达增加了U2OS、U2OS/MTX300和HOS细胞中Runx2的蛋白质和mRNA水平(图1a-f,m,n)。然而,CDM-CBX4的色域突变体在mRNA和蛋白质水平上都不能增加Runx2,无论是迁移还是侵袭(图1o-q),总之,这些结果表明CBX4在调节Runx2以及骨肉瘤细胞的迁移和侵袭中起着重要作用。
2)在骨肉瘤细胞中,CBX4通过招募GCN5到Runx2启动子来增加Runx2
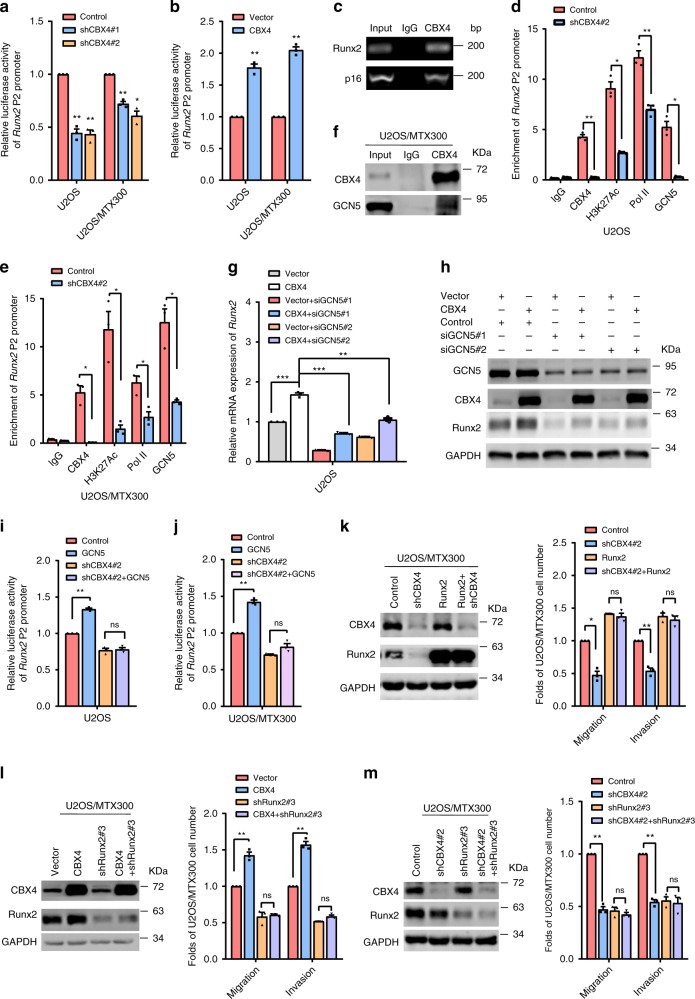
敲低或过表达CBX4可以分别抑制和增加Runx2启动子活性(图2a,b)。当使用p16(INK4a/ARF)启动子作为阳性对照,基于染色质免疫沉淀(ChIP)分析,CBX4与Runx2 P2启动子相连(图2c)。以RNA聚合酶II(Pol II)为阳性对照,通过敲除U2OS和U2OS/MTX300细胞中的CBX4,H3K27Ac与Runx2启动子的关联受到损害(图2d,e)Co-IP显示CBX4在外源和内源水平上与P300、CBP或GCN5结合,但与TIP60和PCAF均不结合(图2f)。另外,沉默GCN5消除了CBX4过表达诱导的mRNA和蛋白质水平的Runx2增加(图2g,h)。此外,CBX4基因敲除不仅消除了GCN5对Runx2启动子活性的增强(图2i,j),而且还减少了GCN5与Runx2启动子的结合(图2d,e)。Runx2的过表达则逆转了敲除CBX4引起的细胞迁移和侵袭的抑制(图2k),而内源性Runx2的缺失则消除了CBX4过表达引起的迁移和侵袭的增强(图2l),表明CBX4对骨肉瘤细胞迁移和侵袭的影响取决于Runx2。此外,Runx2的额外损耗不能进一步减少CBX4敲除细胞的迁移和侵袭(图2m)。总之,这些结果表明CBX4通过向骨肉瘤细胞中的Runx2启动子招募GCN5来增强Runx2的表达,从而促进细胞迁移和侵袭。
3)CHIP是负责CBX4泛素化和降解的E3连接酶
我们之前的数据表明,CBX4 C末端的10个氨基酸可能对其蛋白稳定性至关重要,而如上图所示,CBX4促进了骨肉瘤细胞的迁移和侵袭。我们试图通过 MS分析,鉴定负责降解CBX4的E3连接酶。CBX4相互作用蛋白中有三种著名的E3连接酶:TRIM21、MKRN2和CHIP(图3a)。然而,在外源和内源水平(图3b)下,CBX4蛋白水平仅通过CHIP而不是TRIM21或MKRN2降低,而通过siRNA或shRNA敲除CHIP可提高细胞内CBX4蛋白水平(图3c)。此外,野生型CHIP降低了蛋白水平,增强了CBX4的泛素化,缩短了半衰期(图3d-f),而siRNA敲除CHIP则降低了CBX4的泛素化,延长了半衰期(图3g,h)。一致地,CHIP和CBX4之间的相互作用已经在其外源和内源水平上被检测到(图3i)。这些结果表明,CHIP是导致CBX4泛素化和蛋白酶体/溶酶体降解的E3连接酶。
为了进一步鉴定CHIP诱导的CBX4泛素化位点,制备了一组CBX4片段。如图3j所示,在K178/280A突变株中,CHIP诱导的CBX4泛素化几乎被消除,而在K178A或K280A突变株中,CBX4的泛素化部分被减弱。为支持这些发现,与野生型CBX4相比,这三个突变株对CHIP降解的抗性更强(图3k)。这些结果表明CBX4的K178和K280是CHIP泛素化的关键位点。

4)CK1α在T437处磷酸化CBX4,促进其转化
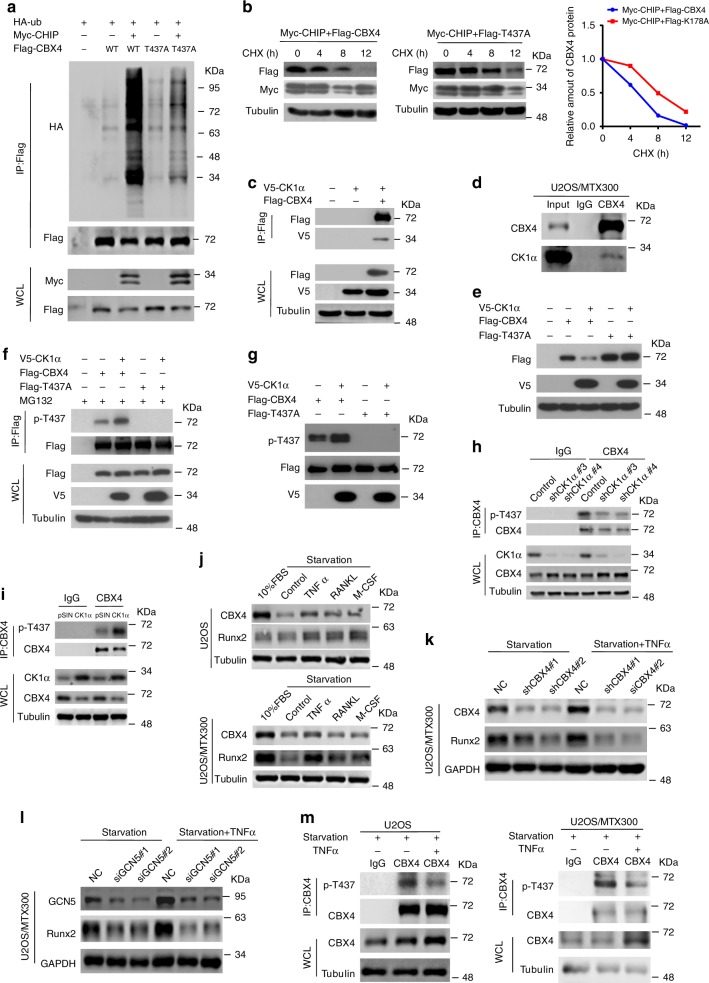
一般来说,CHIP介导的蛋白质降解是由其自身或其底物的磷酸化调节的。T437突变体影响CHIP介导的CBX4泛素化和降解(图4a,b),强烈表明T437可能是泛素介导的CBX4降解所需的显性磷酸化位点。
CBX4和CK1α之间的相互作用在细胞的外源和内源水平上都被检测到(图4c,d)。此外,CK1α降低了野生型CBX4的蛋白质水平,但没有降低其T437A突变体的蛋白质水平(图4e)。使用抗-T437抗体,当CBX4在T437磷酸化时,抗体能特异性地识别CBX4,通过在细胞中与CK1α共转染来增加T437处CBX4的磷酸化;在体外与纯化的V5-CK1α孵育后,CBX4在T437处的磷酸化作用也增加了,但其T437A突变体没有增加(图4f,4g)。此外,在U2OS/MTX300细胞中,CK1α的敲除和过表达分别降低和增强了T437处内源性CBX4的磷酸化,表明T437处内源性CBX4的磷酸化也依赖于CK1α(图4h,i)。
接下来,我们试图检测CK1α对T437处CBX4的磷酸化是否与骨肉瘤的进展有关。U2OS和U2OS/MTX300细胞均被几种与骨肉瘤进展密切相关的细胞因子治疗,如TNFα、RANKL和M-CSF20-22。有趣的是,TNFα可以提高这些细胞中CBX4和Runx2的蛋白水平(图4j)。TNFα增加Runx2蛋白水平依赖于CBX4或GCN5,可能是由于这些细胞中T437处CBX4磷酸化减少所致(图4k-m)。总之,这些结果确定CK1α在T437处磷酸化CBX4促进转换,并与骨肉瘤的进展相关。
5)CK1α通过抑制CBX4而起作用,它们在组织中呈负相关
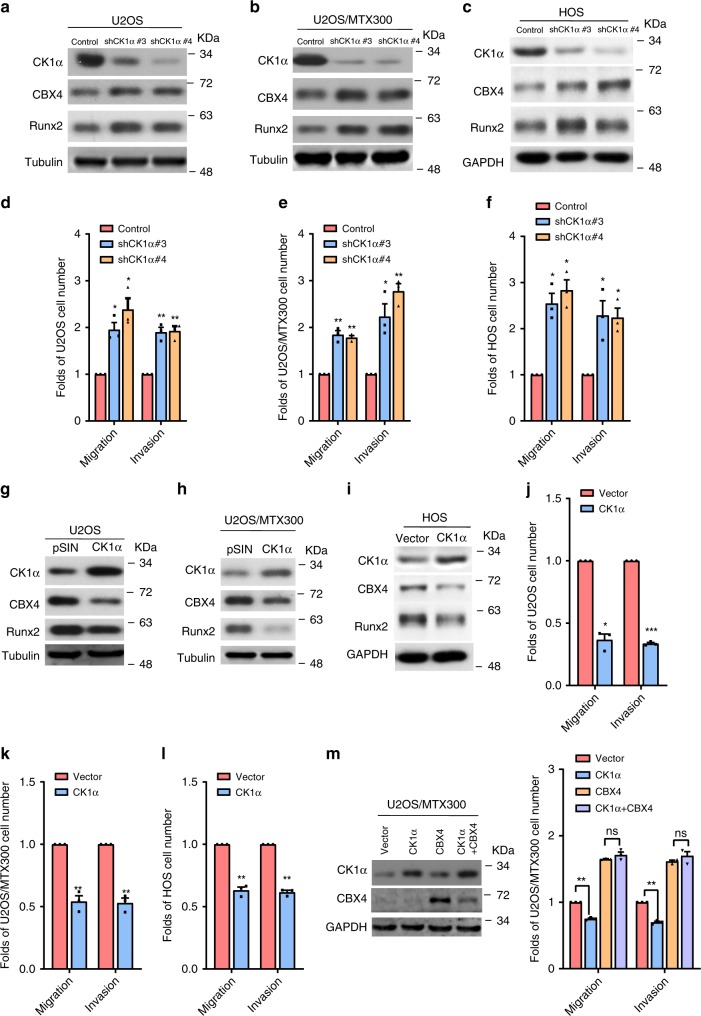
我们研究了CK1α对骨肉瘤细胞迁移和侵袭的影响。如图5a-f所示,在U2OS、U2OS/MTX300和HOS细胞中使用shRNAs敲除CK1α,CBX4和Runx2蛋白水平以及细胞迁移和侵袭均增加。相反,CK1α在这些细胞中稳定的外源表达降低了CBX4和Runx2的蛋白水平,以及细胞的迁移和侵袭(图5g-l)。更重要的是,过表达CBX4废除了由CK1α过表达诱导的细胞迁移和入侵的抑制(图5m)。这些结果表明,CK1α的过表达通过降低CBX4蛋白水平抑制了细胞的迁移和侵袭。
6)CK1α与CBX4在骨肉瘤组织中负相关
我们评价了CK1α调节CBX4的临床意义。结果表明,55个组织中有29个有高水平的CBX4,而55个组织中有19个有高水平的CK1α,这两种蛋白的水平在这个队列中呈负相关(图6a,b)。高水平CK1α和CBX4分别与骨肉瘤患者较好和较差的总体生存率相关(图6c,d)。此外,在24例诊断为转移的患者中,高水平的CK1α(而不是CBX4)与更好的总体生存率相关(图6e),尽管低水平的CBX4患者显示出比高水平的CBX4患者有更好的生存曲线的趋势,可能是由于小样本量转移(图6f)。提示CK1α是预测骨肉瘤转移患者临床预后的重要指标。

7)pyrvinium通过CK1α激活抑制CBX4抑制骨肉瘤肺转移
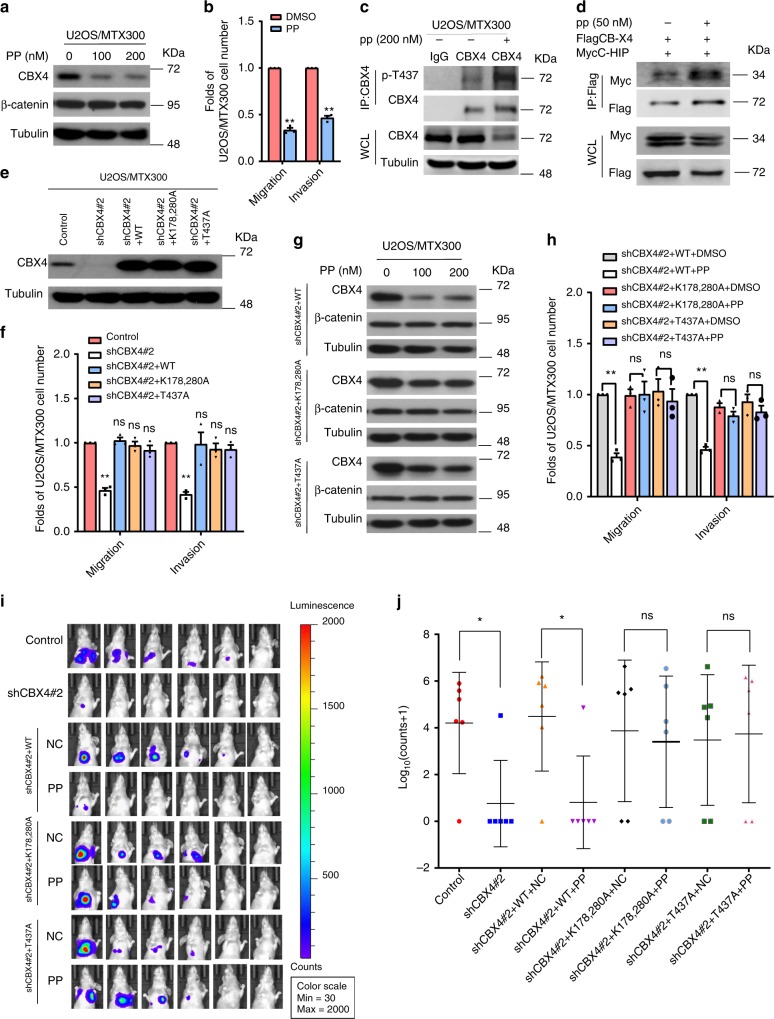
恩波吡维铵(PP)是FDA批准的一种选择性激活CK1α亚型的药物,在不同的癌症模型中具有抗肿瘤作用。因此,我们很想确定PP是否对骨肉瘤转移有影响。PP抑制U2OS/MTX300细胞内CBX4的内源性蛋白水平,但不抑制β-连环蛋白(图7a)。同时,细胞迁移和侵袭受到损害,而PP处理的细胞内源性CBX4 在T437位点的磷酸化水平增加(图7b,c)。一致地,细胞内的PP处理也增加了CBX4与CHIP的相互作用(图7d)。
最后,利用U2OS/MTX300-luci细胞,探讨PP对骨肉瘤原位转移模型的影响。如图7e-j所示,shRNA对内源性CBX4的敲除减少了细胞的迁移、侵袭和转移,而野生型CBX4及其突变株K178/280A或T437A的重新导入完全挽救了这些细胞。此外,与K178/280A和T437A突变体相比,PP处理对野生型CBX4蛋白水平有更显著的抑制作用。一致地,在稳定表达shRNA和WT-CBX4的U2OS/MTX300细胞中,PP处理会损害细胞迁移、侵袭和转移,但不损害其K178/280A或T437A突变体(图7h-j)。这些结果表明,PP通过诱导CBX4蛋白的降解而降低了骨肉瘤的转移,提示PP在骨肉瘤肺转移患者的临床试验中有一定的应用价值。
结论:
CBX4的过表达向Runx2启动子募集GCN5,转录上调Runx2,促进骨肉瘤的肺转移。CK1α在T437处磷酸化CBX4有利于其泛素化和CHIP降解,而PP作为CK1α的选择性激活剂可能有利于高表达CBX4的骨肉瘤患者。






