实锤!tRNA衍生的小RNA调节人和小鼠翻译起始后的核糖体蛋白水平
tRNA衍生的小RNA(TsRNAs)参与了许多细胞过程,但具体机制尚不清楚。以前发现Leu-CAG tRNA衍生的小RNA的3’端(LeuCAG3‘tsRNA)通过维持核糖体蛋白S28(RPS28)的水平来调节人类核糖体的生物发生。本文通过实验进一步验证了LeuCAG3的tsRNA可能通过一种保守的基因调控机制在脊椎动物中维持核糖体的生物发生,并于2019年12月发表在Cell Reports(IF:7.815)。

本文亮点:

1、在脊椎动物中LeuCAG3‘tsRNA的目标靶点位于保守的RPS28编码区;
2、LeuCAG3‘tsRNA在人和小鼠中均可调节RPS28起始阶段翻译;
3、LeuCAG3‘tsRNA调控的翻译在人和小鼠间保守
4、tsRNA调控的翻译机制可能在脊椎动物中保守
主要结果:
1、脊椎动物中RPS28 mRNA上的靶位点区域保守
作者先从44个脊椎动物的基因组tRNA数据库中筛选得到22nt的LeuCAG3‘tsRNA。通过构建系统进化树发现LeuCAG3‘tsRNA在RPS28 mRNA上的靶位点具有保守性(图1A),还发现两个潜在靶点,一个在CDS区,一个在3‘UTR(图1B和C)。靶点A和靶点B的碱基组成和结构如图D和E所示。

图1位于RPS28的CDS区的LeuCAG3‘tsRNA目标靶点在哺乳动物和鸟类中保守进化,且小鼠的Rps28 mRNA具有双链二级结构
2、在小鼠中LeuCAG3‘tsRNA对于18S rRNA的功能是必须的
前人的研究显示,在人类细胞中降低RPS28蛋白可通过抑制LeuCAG3‘tsRNA从而损害18S rRNA的处理途径,同时可降低人类癌细胞的生活力。于此结果类似,在小鼠中抑制LeuCAG3‘tsRNA可显著降低Hepa 1-6细胞的生活力(图2A)。此外,实验结果显示抑制LeuCAG3‘tsRNA显著降低了18S rRNA的水平,但并没有显著影响28S rRNA的丰度,并且LeuCAG3‘tsRNA不影响18S rRNA的翻译而是处理34S媒介RNA的必须物质(图2B-D)。
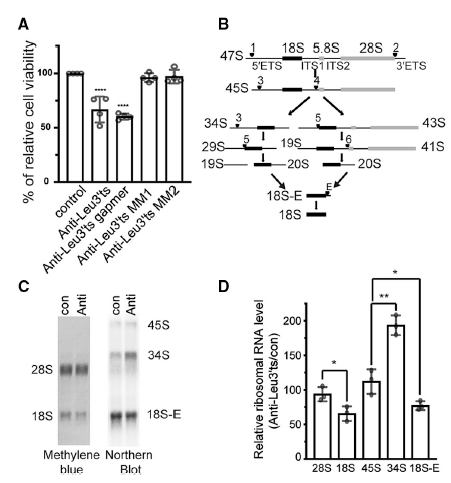
图2 在小鼠细胞中LeuCAG3‘tsRNA对于18S rRNA的功能是必须的
3、LeuCAG3‘tsRNA调控小鼠Rps28 mRNA翻译
抑制LeuCAG3‘tsRNA后使用WB和qPCR检测了Rps28 的蛋白和mRNA水平,结果显示Rps28 的蛋白水平显著下降而mRNA水平不变,证明LeuCAG3‘tsRNA影响翻译(图3A-C)。之后作者对Rps28 mRNA进行分级,并对较重Rps28 mRNA向较轻Rps28 mRNA转化的部分进行了计算量化,如图3D所示,与对照相比,抑制LeuCAG3‘tsRNA后,向较轻Rps28 mRNA转化的数量明显增多。以上结果证实LeuCAG3‘tsRNA调控小鼠和人的Rps28 mRNA翻译。
进一步探究LeuCAG3‘tsRNA的作用靶点是A还是B,进行了WB实验。如图3E-F所示,与野生型相比,抑制靶点A时Rps28 蛋白水平显著升高,而抑制靶点B后Rps28 蛋白的水平无显著变化,表明靶点B在细胞中并不活跃。
总之,以上结果表明小鼠LeuCAG3‘tsRNA调控Rps28 蛋白翻译主要依赖于CDS区域的保守靶点A而非靶点B。
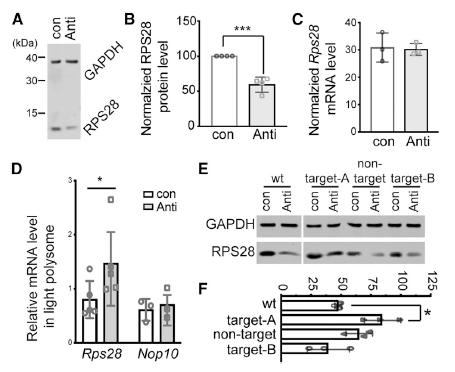
图3在小鼠中LeuCAG3‘tsRNA通过碱基互补与CDS靶位点配对对于Rps28 mRNA的翻译是必须的
4、LeuCAG3‘tsRNA在人和小鼠中调控Rps28 mRNA翻译后的起始阶段
作者模拟了使用哈林通碱或NaAsO2受LeuCAG3‘tsRNA影响翻译的示意图(图4A)。如果tsRNA影响80S复合物的形成,则哈林通碱或NaAsO2处理会使RPS28 mRNA停滞在40S亚基附近;如果tsRNA影响80S复合物形成后的步骤,则哈林通碱或NaAsO2处理会使RPS28 mRNA停滞在80S复合物上。
实验结果如图4B所示,与预期一致,哈林通碱或NaAsO2处理后RPS28 mRNA通常在9和14位点发生迁移,并累积在80S单核糖体上。此外,哈林通碱或NaAsO2处理后的细胞中抑制LeuCAG3‘tsRNA并不影响RPS28 mRNA在80S单核复合体上的积累。以上结果表明LeuCAG30tsRNA在人和小鼠中的翻译后起始水平上调节RPS28 mRNA。

图4 在人和小鼠中LeuCAG3‘tsRNA调控RPS28延伸阶段的翻译
本文报道了在灵长类动物中存在功能性的3‘UTR靶位点,而在许多脊椎动物中存在CDS靶位点。作者证实,这个tsRNA也通过与CDS目标位点相互作用来调节小鼠Rps28的翻译。进一步证实,mRNA翻译的变化发生在两个物种的启动后步骤。总体而言,结果表明LeuCAG3的tsRNA可能通过一种保守的基因调控机制在脊椎动物中维持核糖体的生物发生。
参考文献:
Kim Hak Kyun., Xu Jianpeng., Chu Kirk., Park Hyesuk., Jang Hagoon., Li Pan., Valdmanis Paul N., Zhang Qiangfeng Cliff., Kay Mark A. (2019). A tRNA-Derived Small RNA Regulates Ribosomal Protein S28 Protein Levels after Translation Initiation in Humans and Mice. Cell Rep, 29(12), 3816-3824.e4. doi: 10.1016/j.celrep.2019.11.062。






