小胶质外泌体与帕金森氏病
帕金森氏病的病理特征包括黑质中多巴胺能神经元的丢失和突触核蛋白(a-syn)的积累。小胶质细胞是大脑中的主要免疫细胞,在帕金森氏症中吞噬死细胞并帮助清除错误折叠的a-syn聚集体。分泌外泌体是小胶质细胞抗原呈递和释放机制的一部分。小胶质外泌体是否影响帕金森氏病,这篇文章来为大家解答。

技术路线:

结果:
1. 外泌体介导神经元之间的a-syn的传播
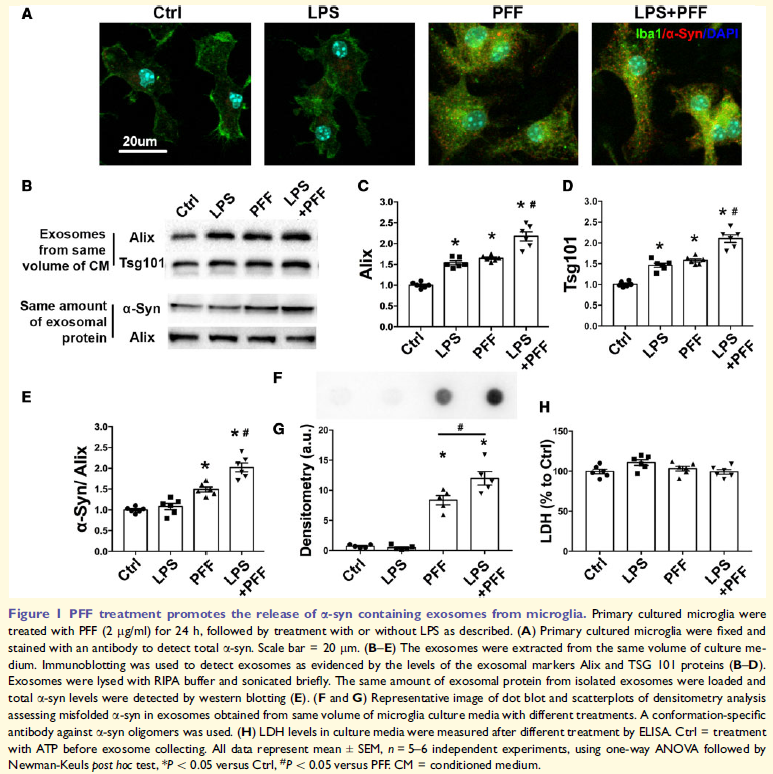
PFF或PFF/LPS组合处理的小胶质细胞中检测到a-syn,表明小胶质细胞可以摄取PFF,但缺乏有效降解纤维性a-syn的能力。LPS、PFF、LPS/PFF处理的小胶质细胞增加了外泌体的释放,PFF增加外泌体中的a-syn水平,PFF和LPS共处理增加最多,表明外泌体可能在消除细胞内异常a-syn中发挥重要作用。PFF处理小胶质细胞衍生的外泌体中可检测到具有神经毒性的寡聚a-syn的存在。这些表明PFF处理的小胶质细胞释放包含a-syn的外泌体,LPS进一步增强PPF的效应。
2. 外泌体介导a-syn在小胶质细胞和神经元之间的传递
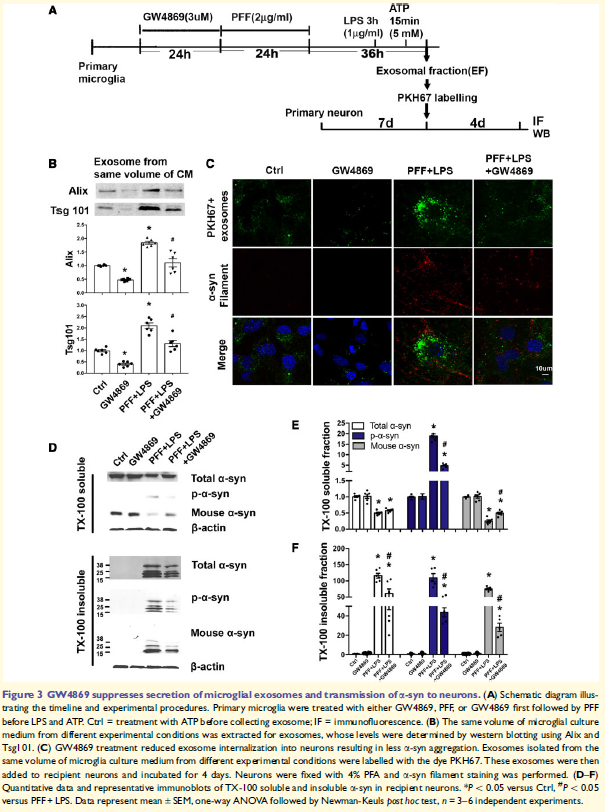
外泌体EF(来自PFF处理的小胶质细胞),和EF-c(未治疗的小胶质细胞的外泌体)或无外泌体条件培养基分别与皮层神经元孵育4天。TX-100不溶性a-syn在受体神经元中的聚集在EF组显著增加,而可溶性内源性a-syn减少,表明包含a-syn的外泌体招募内源性a-syn形成不溶性。


3. 外泌体合成的抑制减少a-syn从小胶质细胞到神经元的传递
外泌体抑制剂GW4869处理小胶质细胞发现外泌体的分泌减少,外泌体进入神经元明显减少,a-syn聚集减少,减少TX-100不溶性a-syn,提示降低小胶质细胞释放含a-syn的外泌体可减少a-syn扩散到神经元。
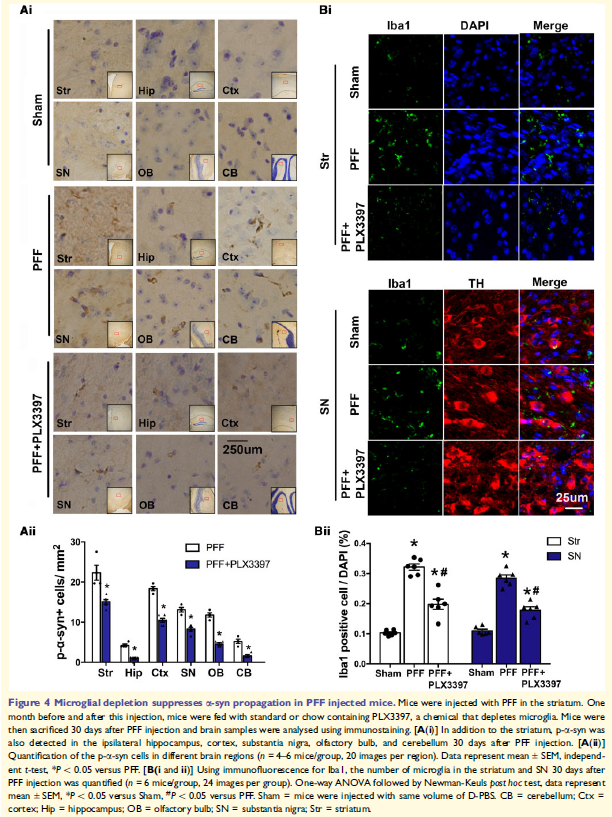
4. 小胶质细胞耗竭抑制PFF诱导的a-syn在体内传播
小鼠背侧纹状体立体定向注射PFF 30天后,p-a-syn积累存在于大脑多个区域,SN和纹状体中的Iba1阳性小胶质细胞增加,表明小胶质细胞参与了a-syn的传播。消耗小胶质细胞药物PLX3397喂食老鼠处理大大减少大脑中Iba1阳性小胶质细胞的数量。PFF + plx3397处理的小鼠SN和纹状体中iba1阳性的小胶质细胞减少,异常p-a-syn聚集明显减少,仅PLX3397处理没有影响。这些表明小胶质细胞耗竭抑制a-syn聚合和传输。
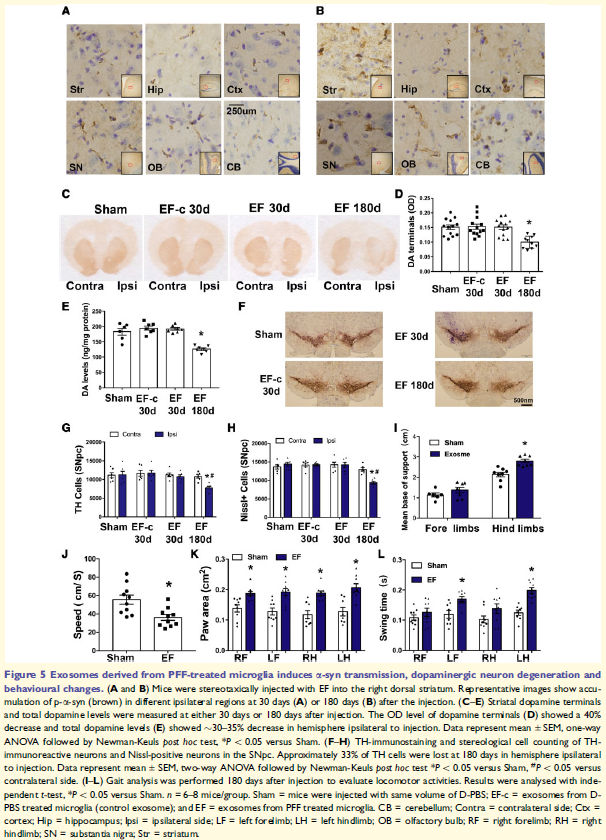
5. 小胶质外泌体介导a-syn在大脑中传播
注射EF的小鼠大脑可检测到p-a-syn的积累,多巴胺能终密度减少,纹状体多巴胺总含量减少,同侧SNpc中TH阳性细胞相应丢失,这些表明小胶质外泌体在黑质纹状体通路中以一种依赖于时间的方式触发逆行细胞死亡。
检测到小鼠的行为变化,发现后肢的支撑基础增加,平均步行速度减少,两只脚的爪面积增加。以上这些变化表明步行速度减少,总体活动没有明显改变。这些表明小胶质细胞外泌体a-syn与帕金森病的进展有关。
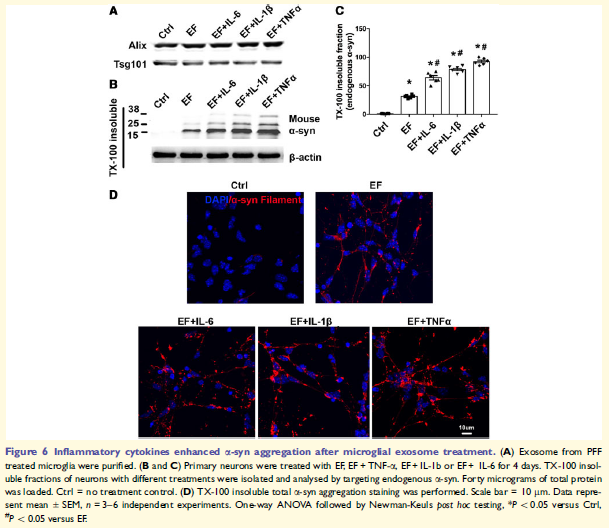
6. 促炎细胞因子增强小胶质外泌体诱导的a-syn的聚集
小胶质细胞活化同时释放促炎因子,EF与促炎细胞因子共处理神经元细胞增加TX-100不溶性内源性a-syn,表明EF介导a-syn传输,小胶质细胞炎症反应加速这一过程。
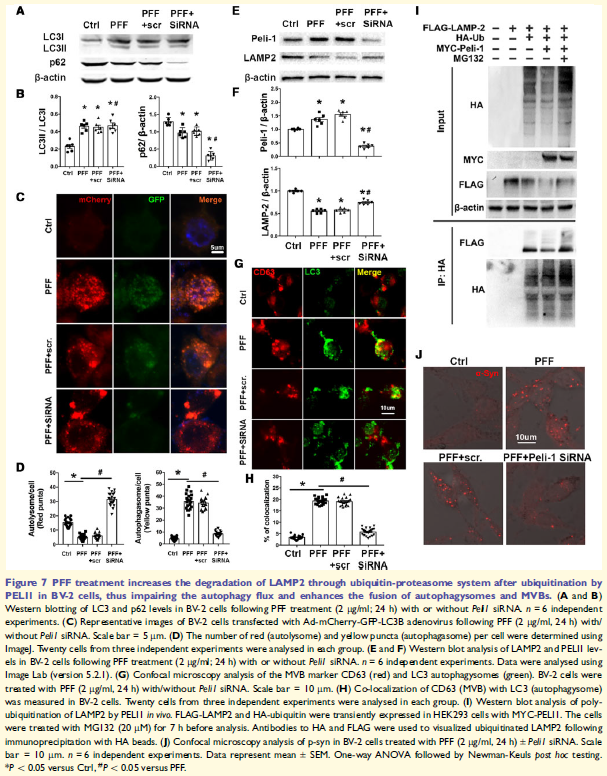
7. PELI1介导的溶酶体故障导致小胶质细胞自噬通量失调和外泌体分泌
自噬是a-syn降解的重要途径,观察到PFF处理的BV-2细胞诱导自噬体积累。研究发现,在PF F处理的BV-2细胞中溶酶体结构蛋白LAMP2的水平明显减少,CD63 + LC3 +浓度增加,这些表明PFF引起溶酶体功能障碍。PFF处理BV-2细胞E3泛素连接酶PELI1水平增加,在HA泛素存在下,LAMP2被有效多泛素化,而PELI1过表达增强LAMP2的降解。沉默PELI1逆转PFF诱导的LAMP2减少,减弱自噬体积累,恢复自噬通量,并减少自噬体与MVB的融合。
8. 帕金森氏症患者CSF小胶质细胞/巨噬细胞来源外泌体诱导神经元a-syn聚集
CSF中CD11b +外泌体超过总外泌体,帕金森氏病和MSA患者中小胶质细胞/巨噬细胞外泌体中总a-syn的含量。CD11b +外泌体与皮质神经元一起孵育,观察到帕金森氏病和MSA患者的CD11b +外泌体诱导TX-100不溶性a-syn。这些表明小胶质细胞/巨噬细胞衍生的外泌体含有a-syn,在细胞间传播中起重要作用。







