肿瘤内肠道菌群的积累促进了基于CD47的免疫治疗
越来越多的证据表明,调节肠道微生物群会影响宿主对各种癌症治疗的反应,尤其是免疫治疗。目前,CD47正作为一种潜在的癌症治疗靶点在多项临床试验中进行研究。今天小编为大家介绍一篇发表于“Journal of Experimental Medicine”的文章“Intratumoral accumulation of gut microbiota facilitates CD47-based immunotherapy via STING signaling”。这篇文章揭示了肠道菌群优先在肿瘤部位定植并通过STING信号通路促进基于CD47的免疫治疗。

结果:
1)CD47阻断的抗肿瘤反应依赖于胃肠道外积累的肠道微生物群
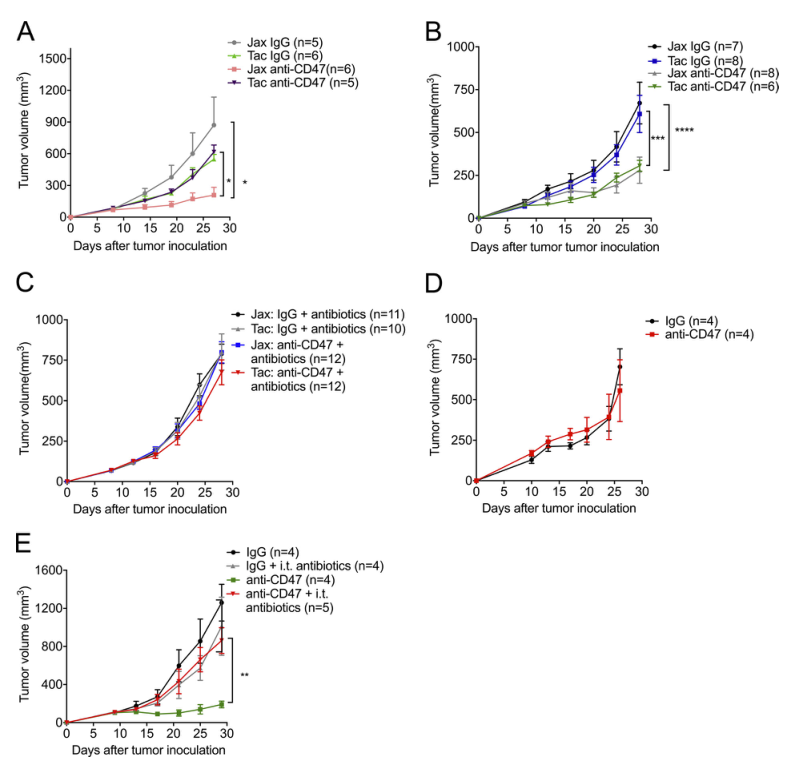
为了研究CD47抗体的抗肿瘤作用是否由小鼠体内的肠道菌群决定,我们使用WT小鼠、抗生素喂养的小鼠和无菌小鼠来检测CD47免疫治疗的抗肿瘤作用。据报道,来自Jackson实验室(Jax)和Taconic Biosciences(Tac)的WT小鼠有一种独特的肠道微生物群,有助于它们的独特免疫特征。我们观察到荷瘤Jax小鼠对CD47阻断有反应,而荷瘤Tac小鼠无反应(图1A)。为了探讨抗CD47免疫治疗的反应是否归因于它们的肠道微生物群,我们将Jax小鼠和Tac小鼠同居3周;WT-Jax小鼠和Tac小鼠在同居后对CD47阻断反应类似(图1b)。这一结果表明,小鼠应答者(Jax小鼠)的共生菌经口转移或接触传播,可以充分挽救CD47阻断的非应答者(Tac小鼠)的抗肿瘤反应。为了证实肠道菌群在基于CD47的免疫治疗中的重要作用,我们在接种肿瘤之前给Jax和Tac小鼠喂服抗生素混合物以减少肠道菌群。喂食抗生素混合物的Jax小鼠对抗CD47治疗无效(图1C)。为了进一步确认肠道微生物群对反应至关重要,还使用了无菌小鼠(图1D)。无菌小鼠对抗CD47抗体治疗无效。抗生素喂养介导全身微生物群的系统性减少。此外,瘤内注射抗生素混合物降低了小鼠应答者抗CD47治疗的疗效(图1E)。这些发现表明,聚集在胃肠道外的共生肠道微生物在促进基于CD47的免疫治疗中的有效作用。
2)双歧杆菌,一种肿瘤靶向的微生物群成员,可充分恢复无应答者抗CD47免疫治疗的抗肿瘤疗效
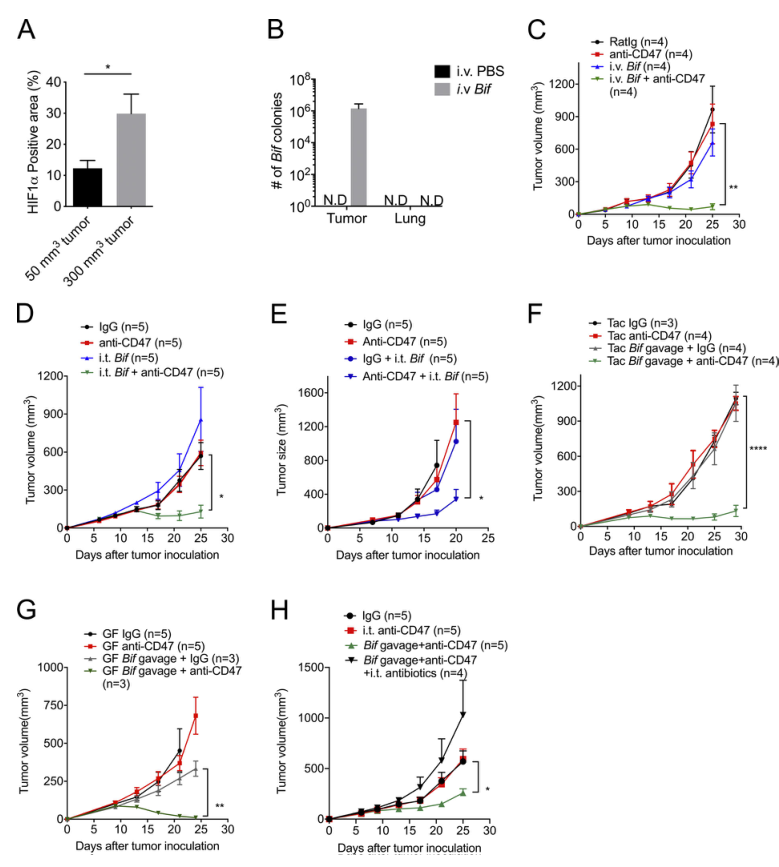
厌氧菌主要存在于胃肠道。随着肿瘤大小的增加,TME变得更缺氧(图2A)。双歧杆菌是一种功能性肠道微生物群,通过改善DCs的功能促进基于PDL1的免疫治疗。但双歧杆菌如何以及在何处增强免疫力还没有很好的定义。为了追踪共生厌氧菌(如双歧杆菌)如何与免疫细胞相互作用,我们给Tac小鼠注射了双歧杆菌混合物(双歧杆菌、长双歧杆菌、乳双歧杆菌和短双歧杆菌)。令人惊讶的是,在全身给药7d后,通过使用厌氧培养板选择性培养双歧杆菌和16S rDNA鉴定,可在肿瘤组织中容易检测到双歧杆菌(图2B)。然而,在肺中没有检测到双歧杆菌。尽管单用双歧杆菌的全身给药不能控制肿瘤生长,但它挽救了对CD47阻断无效的小鼠的抗肿瘤效果(图2C)。提示双歧杆菌的肿瘤靶向性是肠道微生物群影响抗肿瘤反应的可能机制之一。
为了进一步探讨双歧杆菌在全身给药后对肿瘤的抗肿瘤作用,我们也采用了双歧杆菌的瘤内注射给药的方法。使用低剂量的双歧杆菌也可以通过CD47阻断小鼠结肠肿瘤或淋巴瘤肿瘤的无应答者来恢复肿瘤控制的能力,这与系统处理双歧杆菌的结果一致(图2D- E)。这些结果表明,双歧杆菌在TME中的积累能充分提高抗CD47免疫治疗的抗肿瘤作用。
最近,口服共生细菌作为一种抗肿瘤策略备受关注。研究表明,口服更高剂量的双歧杆菌恢复了基于CD47的免疫疗法对无应答小鼠(Tac小鼠)和无菌小鼠(图2、F和G)的抗肿瘤作用。然而,口服热灭活细菌并没有显示出挽救效果。这一结果显示口服活双歧杆菌而非灭活双歧杆菌足以促进CD47阻断的治疗效果。此外,在双歧杆菌灌胃的小鼠中,低剂量抗生素混合物的瘤内注射给药足以消除CD47阻断的作用(图2 H)。
3)I型IFN信号和T细胞是双歧杆菌介导的肿瘤控制的关键
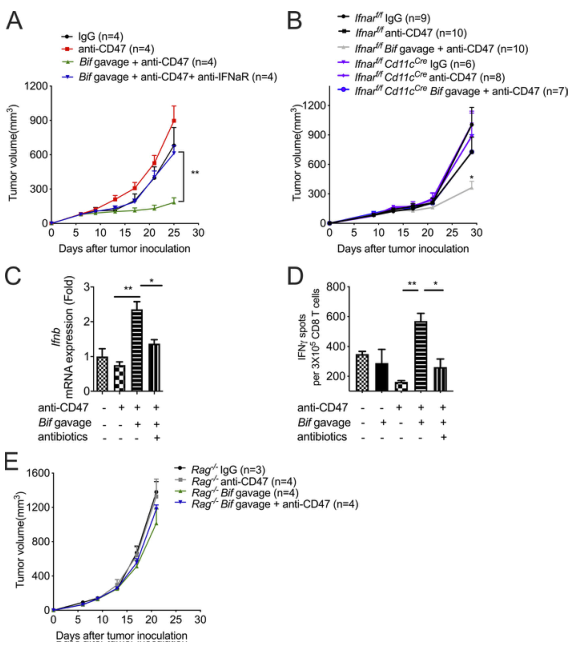
据报道,CD47阻断的抗肿瘤作用依赖于I型IFN信号和肿瘤相关树突状细胞的交叉启动。研究发现,即使是双歧杆菌给药,I型IFN信号阻断也会导致对CD47阻断的耐药性(图3A)。为了确定TME中哪些细胞群需要I型IFN信号才能在双歧杆菌给药和CD47阻断后产生有效的抗肿瘤反应,我们使用了在DCs中Ifnar被敲除的小鼠。口服双歧杆菌不能促进Ifnarf/fCd11cCre小鼠中CD47的阻断(图3 B)。这一发现表明,DCs中的I型IFN信号通路对双歧杆菌促进的CD47阻断的治疗效果至关重要。为探讨双歧杆菌对DCs中I型IFN信号转导的影响,对分离的肿瘤DCs中IFNβ的表达进行了检测。双歧杆菌和抗CD47治疗无效小鼠的肿瘤树突状细胞中IFNβ的表达升高(图3C)。骨髓来源的树突状细胞与MC38肿瘤细胞和双歧杆菌共培养也得到了类似的结果。另一方面,口服双歧杆菌后用抗生素混合物消除双歧杆菌,可降低肿瘤树突状细胞中IFNβ的表达(图3C)。综上所述,这些发现证明了I型干扰素信号在通过CD47阻断的双歧杆菌局部促进肿瘤控制中的重要作用。
据报道,I型IFN信号转导可促进树突状细胞的交叉启动,从而刺激适应性免疫反应。ELISPOT法检测肿瘤DCs的交叉启动能力。只有接受了双歧杆菌和抗CD47抗体的瘤内注射的Tac小鼠的肿瘤树突状细胞才能诱导CD8+T细胞中IFNγ的增加(图3D)。用抗生素混合物消除双歧杆菌降低了肿瘤树突状细胞的交叉启动能力。此外,双歧杆菌给药无法恢复CD47阻断对Rag-/-小鼠的抗肿瘤作用(图3E)。双歧杆菌以IFNβ依赖和T细胞依赖的方式共同促进了基于CD47的免疫治疗。
4)双歧杆菌通过STING信号促进CD47免疫治疗
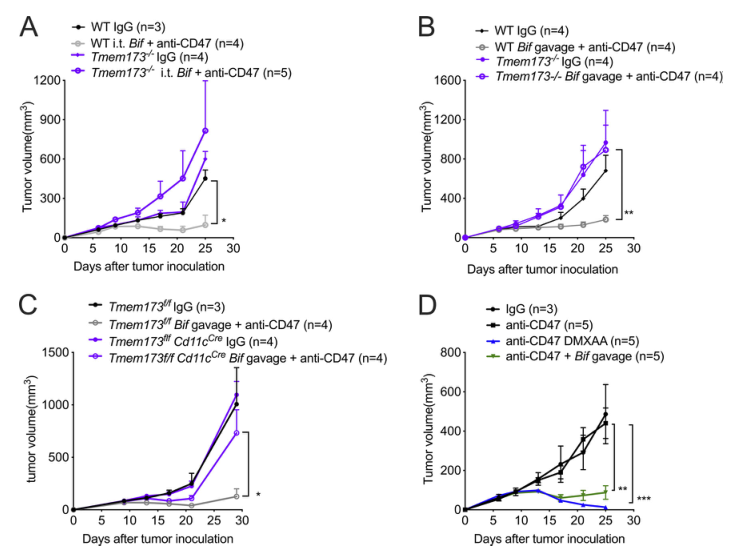
STING途径在抗D47介导的抗肿瘤作用中调节I型IFN的表达。然而,STING途径与双歧杆菌的抗肿瘤作用之间的直接关系尚未明确。我们观察到,注射双歧杆菌未能促进Tmem173–/–小鼠的抗CD47免疫治疗,在该治疗中,小鼠的STING被击倒(图4A)。因此,STING信号通路对双歧杆菌的抗肿瘤作用至关重要。当Tmem173–/–小鼠口服双歧杆菌时也得到了类似的结果(图4B)。口服双歧杆菌也未能促进Tmem173f/fCd11Cre小鼠的抗CD47免疫治疗,证实双歧杆菌的抗肿瘤功能依赖于DCs内的STING信号通路(图4C)。本研究提示以肿瘤组织为靶点的STING激动剂可能有效。事实上,与双歧杆菌相比,注射DMXAA(一种小鼠刺激性激动剂)同样提高了WT-TAC小鼠抗CD47治疗的抗肿瘤效果(图4D)。
结论:
本研究为临床研究肿瘤微环境内的微生物与免疫治疗的协同作用开辟了一条新的途径,揭示了一些患者对免疫治疗无反应的情况。






